Geschlechtsdetermination
Unter Geschlechtsdetermination werden jene Abläufe verstanden, die die Entwicklung des somatischen Geschlechts in einem Organismus bestimmen. Diese Abläufe finden bei Säugetieren in der Embryogenese statt, bei anderen Organismen verändert sich das Geschlecht im Laufe ihres Lebens.
| Übergeordnet |
| Reproduktions-Entwicklungsprozess |
| Untergeordnet |
| Genetische/Somatische/Männliche/Weibliche/Primäre/Paarungstyp-Geschlechtsdetermination |
| Gene Ontology |
|---|
| QuickGO |
Für die Festlegung des Geschlechts sind zwei verschiedene Mechanismen bekannt.
- Die genetische oder chromosomale Geschlechtsdetermination, die auf den genetischen Unterschieden der Geschlechter basiert.
- Die modifikatorische Geschlechtsdetermination, welche von äußeren Faktoren (z. B. Temperatur) abhängt.
Erstere führt u. a. bei den Säugetieren, letztere u. a. bei vielen Reptilien zu einer somatischen Geschlechtsfestlegung.
Bekannte biologische Geschlechter
Die meisten Organismen, die ihre Nachkommen durch sexuelle Fortpflanzung zeugen, kennen zwei biologische Geschlechter: Ihre Individuen werden eingeteilt in männlich oder weiblich. Bei anderen Arten gibt es Hermaphroditen, die männliche und weibliche Merkmale in einem Individuum vereinigen. Einige Fisch-, Echsen- und Insektenarten sind allesamt weiblich und reproduzieren sich durch Parthenogenese. Bei einigen Arthropoden wird das weibliche Geschlecht durch die Infektion mit Bakterien der Gattung Wolbachia erzwungen. Bei aus Hybriden bestimmter Ameisenarten (Pogonomyrmex barbatus und P. rugosus) hervorgegangenen Ameisen-Populationen sind die Väter von Arbeiterinnen und Königinnen genetisch voneinander verschieden.[1][2] Pilze haben keine Geschlechter, es gibt bei Schlauchpilzen und Ständerpilzen aber verschiedene Paarungstypen, die nur bei Verträglichkeit miteinander die Fortpflanzung einleiten können.[3] Der Gemeine Spaltblättling hat über 23.000 Paarungstypen, der Einzeller Tetrahymena hat sieben verschiedene Paarungstypen.
Genetische Determinationssysteme
Von genetischem oder chromosomalem Geschlecht wird gesprochen, wenn die Geschlechtsbestimmung auf der Art oder Anzahl der vorhandenen Chromosomen beruht.
Geschlechtsdetermination durch Geschlechtschromosomen
Wenn Weibchen und Männchen gleich viele Chromosomen haben, sich aber mindestens eins der Chromosomen bei Weibchen und Männchen unterscheidet, spricht man von Geschlechtschromosomen (Gonosomen). Beispielsweise haben bei Säugern Weibchen zwei X-Chromosomen, sie sind also bezüglich der Geschlechtschromosomen homozygot. Männchen haben ein X- und ein Y-Chromosom und somit unterschiedliche Geschlechtschromosomen, sie sind hemizygot (XX/XY-System). Das Y-Chromosom enthält das SRY-Gen, welches Bedeutung bei der Ausprägung des männlichen Genitaltraktes hat. Ist kein SRY-Gen vorhanden, kann dessen Wirkung vollständig oder zum Teil durch SOX9 und andere beteiligte Gene kompensiert werden. Bei Abwesenheit beider Gene wird laut Ergebnissen einer Studie das Gen FOXL2 aktiv und sorgt für die Entwicklung eines weibliches Genitaltraktes.[4] Ein ZW/ZZ-System kommt beispielsweise bei Vögeln vor. Hier sind die Weibchen hemizygot (ein W- und ein Z-Chromosom) und die Männchen homozygot (ZZ). Bei einigen Gruppen der Reptilien kommen ebenfalls Geschlechtschromosomen vor. Bei Fischen und Amphibien fehlen Geschlechtschromosomen meist.[5][6][7]
Auch bei getrenntgeschlechtlichen Pflanzenarten (Zweihäusigkeit, siehe diözisch) gibt es unterscheidbare Geschlechtschromosomen. Die evolutionär sehr jungen zweihäusigen Pflanzenarten stellen eher Ausnahmen dar. Hierunter fallen aus den Reihen der Bedecktsamer (Angiospermen) z. B. die Weiße Lichtnelke (Silene latifolia), die Große Brennnessel (Urtica dioica, mit Hinweis auf die Diözie im Artnamen), Hanf (Cannabis sativa), die Papaya (Carica papaya) oder auch der Ginkgo (Ginkgo biloba), als ein Vertreter der Nacktsamer (Gymnospermen).
Haplodiploidie
Haplodiploidie ist eine Form der genetischen Geschlechtsdetermination, bei der ein Geschlecht nur einen Chromosomensatz trägt (haploid) und das andere Geschlecht einen doppelten Chromosomensatz (diploid). Üblicherweise ist das männliche Geschlecht haploid. Die bekanntesten Beispiele sind Bienen und Ameisen.
Die Milbenart Brevipalpus phoenicis, ein Schädling tropischer Nutzpflanzen, besteht nur aus haploiden Weibchen, die sich parthenogenetisch vermehren. Einer Untersuchung zufolge handelt es sich eigentlich um genetische Männchen, die durch eine Infektion mit Bakterien zu Weibchen verändert werden.[8] Verweiblichung durch Bakterieninfektion ist auch bei anderen Gliederfüßern bekannt, meist durch Wolbachia.
Modifikatorische Determinationssysteme
Bei Krokodilen hängt das Geschlecht von der Temperatur der Eier ab: bis etwa 30 °C entstehen Weibchen, ab 34 °C entstehen nur noch Männchen. Bei Temperaturen dazwischen schlüpfen Krokodile beiderlei Geschlechts. Bei Schildkröten ist es umgekehrt. Höhere Temperaturen führen zu weiblichen Nachkommen, tiefere Temperaturen zu männlichen.
Neben der Temperatur können auch andere Elemente des Lebensraums das Geschlecht eines Organismus bestimmen. Der Krebs Gammarus duebeni etwa produziert zu Beginn der Paarungszeit Männchen und später Weibchen. Der Übergang wird durch die Länge des Tageslichts bestimmt.[9] Der Große Wasserfloh produziert bei einer Kombination von Nahrungsknappheit, erhöhter Populationsdichte und verkürzter Tageslänge im Herbst männliche Nachkommen.[10] Beim Grünen Igelwurm hängt das Geschlecht der Larven davon ab, ob sie auf ein erwachsenes Weibchen treffen oder auf unbesetztem Meeresboden landen.[11]
Hermaphroditen und sequenzielle Hermaphroditen

Manche Tierarten sind Hermaphroditen und haben sowohl männliche als auch weibliche Geschlechtsorgane, andere sind sequenzielle Hermaphroditen. So sind Anemonenfische und manche Würmer (Anneliden) als junge Tiere männlich und erwachsene Tiere weiblich. Hier ist das Geschlecht von der Größe des Individuums abhängig.[12][13]
Die große Mehrzahl der Pflanzenarten ist hermaphroditisch. Die hermaphroditischen Pflanzen werden weiter unterteilt in zwittrige, nämlich solche mit zwittrigen Blüten, und einhäusige (monözische), solche mit getrennten männlichen und weiblichen Blüten an einer Pflanze. Im Gegensatz dazu haben zweihäusige (diözische) Pflanzenarten weibliche und männliche Individuen. Hier gibt es unterscheidbare Geschlechtschromosomen (siehe oben). Es wird angenommen, dass bei Pflanzen die Getrenntgeschlechtlichkeit evolutionär jünger ist als die Hermaphroditie.
Gonadale Geschlechtsdeterminierung
Als gonadales Geschlecht wird die Zuordnung zum weiblichen oder männlichen Geschlecht anhand des Geschlechtsmerkmals „Keimdrüse“ (Gonade; Eierstock oder Hoden) bezeichnet. Aufgrund der Hormonproduktion durch die Keimdrüsen wird das gonadale Geschlecht deshalb auch als hormonales oder endokrines Geschlecht bezeichnet.
Ausgangspunkt für die Geschlechtsdifferenzierung bei Säugetieren ist die bipotente Gonadenanlage. In Säugetieren induziert das Y-Chromosom die Entwicklung der Hoden und damit die männliche Sexualentwicklung. Die gonadale Geschlechtsdeterminierung durch das XY-System wurde unabhängig voneinander erstmals 1905 von Dr. Nettie Stevens und Edmund Beecher Wilson beschrieben.
Ein beeindruckender Beweis für diese These stammt aus Versuchen mit Kaninchen. Alfred Jost kastrierte embryonale Kaninchen in utero in einem Entwicklungsstadium, in dem die Differenzierung der inneren und äußeren Geschlechtsorgane noch nicht eingesetzt hat. Die Entnahme der Gonaden zu einem bestimmten Zeitpunkt während der Embryonalentwicklung führte sowohl bei männlichen als auch bei weiblichen Kaninchen zur Ausbildung weiblicher Geschlechtsorgane[14]. Diese Experimente zeigten, dass die Anwesenheit der Hoden die Ausbildung der weiblichen Geschlechtsorgane unterdrückt, während sie die Entwicklung des männlichen Phänotyps fördern.
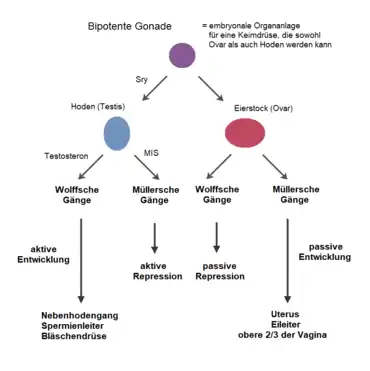
Beim Menschen wird das gonadale Geschlecht durch das chromosomale oder genetische Geschlecht bestimmt. Das gonadale Geschlecht führt in der ungestörten weiteren Embryonalentwicklung mit der Produktion der entsprechenden Sexualhormone zur Ausbildung eines männlichen oder weiblichen Phänotyps – dem gonoduktalen Geschlecht, zu dessen Bestimmung die inneren Geschlechtsorgane herangezogen werden, und dem genitalen Geschlecht, das anhand der äußeren Geschlechtsorgane definiert wird. Die Entwicklung der inneren Geschlechtsorgane ist beim männlichen Embryo durch die Entwicklung der Wolffschen Gänge und beim weiblichen Embryo der Müllerschen Gänge gekennzeichnet. Ist beispielsweise der Hoden-determinierende Faktor (HDF) vorhanden, entwickelt sich aus den zunächst indifferenten Gonadenanlagen die Hoden, ansonsten die Eierstöcke.
Männliche Entwicklung
Bei männlichen Embryonen wird nach der sechsten Woche das sogenannte SRY-Gen auf dem Y-Chromosom abgelesen und ein Protein gebildet, das als Hoden-determinierender Faktor (HDF) bezeichnet wird. Dieses Eiweiß reguliert als Transkriptionsfaktor die Expression des DMRT1-Gens und zahlreicher anderer Gene des Genoms und leitet die Geschlechtsdifferenzierung ein. Unter dem Einfluss von HDF findet beim männlichen Embryo ein Umbau zu den inneren Geschlechtsorganen statt (vor allem den paarige Hoden, Nebenhoden, Samenleitern sowie der Vorsteherdrüse).[15] Im männlichen Embryo wird die Entwicklung der weiblichen Geschlechtsorgane auch durch das Anti-Müller-Hormon (AMH) unterdrückt, das in den Sertolizellen des embryonalen Hodens produziert wird.[16]
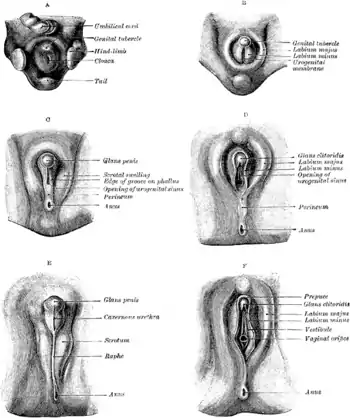
Weiterhin regt das HDF bestimmte somatische Zellen dazu an, sich zu testosteronproduzierenden Leydig-Zellen zu entwickeln. Nach Beginn der Testosteronproduktion in diesen Zellen etwa in der siebten Woche fördert dieses Androgen die weitere Differenzierung der Wolffschen Gänge und die Entwicklung der Nebenhoden, der Samenleiter und der Samenblase wird verstärkt. Außerdem wird mit Hilfe des Enzyms Steroid-5α-Reduktase (SRD5) das Testosteron in den Zielzellen zu der biologisch aktivsten Form Dihydrotestosteron (DHT) umgewandelt. Unter dem Einfluss dieses DHT verlängert sich dann der Protophallus des Genitalhöckers (urogenital sinus / genital tubercle)[17] zu einem Penis (Phallus), die Urogenitalrinne schließt sich zur Pars spongiosa der Harnröhre und bildet den Harnröhrenschwellkörper. Aus dem zentralen Teil des Phallus entsteht der Penisschwellkörper und gegebenenfalls der Penisknochen.[18][19]
Weibliche Entwicklung
In Abwesenheit des Y-Chromosoms und damit des SRY-Gens wie auch des Hoden-determinierenden Faktors (HDF) und des Anti-Müller-Hormons (AMH) differenziert sich im weiblichen Embryo unter dem Einfluss spezieller weiblicher Gene wie beispielsweise des FOXL2-Gens die zunächst indifferente, bipotente Gonadenanlage zu Ovarien. Aus den Müllerschen Gängen entwickeln sich die Gebärmutter, die Eileiter und die oberen zwei Drittel der Vagina.
Geschlechtsdeterminierung und Intersexualität beim Menschen
Das beim Menschen für die Geschlechtsdetermination hauptverantwortliche Gen SRY verbleibt während der väterlichen Keimzellreifung normalerweise auf dem Y-Chromosom. In seltenen Fällen (Häufigkeit ca. 1:10.000 Männer) kommt es durch ein Crossing-over zu einer Übertragung des Gens auf das X-Chromosom. Dadurch entstehen Individuen mit weiblichem Genotyp (XX) und männlichem Phänotyp. Sie haben männliche innere und äußere Genitale, jedoch meist kleine Hoden und sind aufgrund von Azoospermie infertil. Es wurden auch schon XX-Männer beschrieben, bei denen SRY nicht nachweisbar war. In diesen Fällen übernehmen X-chromosomale oder autosomale Gene die Funktion von SRY.
Darüber hinaus gibt es auch Menschen mit einem weiblichen Phänotypen und einem männlichen Genotyp (XY). Dieses durch den Endokrinologen G. Swyer in den 1950er Jahren erstbeschriebene und nach ihm benannte Syndrom zeichnet sich durch fehlende Hodenentwicklung und Genitalentwicklung trotz männlichen Genotyps aus. Es tritt sehr selten auf (Häufigkeit ca. 1:100.000 Frauen). Die primären Geschlechtsorgane (Gebärmutter, Klitoris, Vagina) sind „weiblich“ ausgeprägt, jedoch werden, da XY-Chromosomal, keine Ovarien ausgebildet, sondern sogenannte Stranggonaden, die mehr oder weniger hormonaktiv sein können. Bis zur Pubertät verläuft die Entwicklung „weiblich“. Während der Pubertät tritt eine mehr oder minder ausgeprägte Virilisierung ein, eine „weibliche“ Ausbildung der sekundären Geschlechtsmerkmale (Brustentwicklung, Menstruation) bleibt aus. Die genetische Ursache ist in 30 % der Fälle ein defektes oder fehlendes SRY-Gen. Weiterhin bewirken verschiedene Mutationen des 5α-Reduktase-2-Gens durch den daraus resultierenden 5α-Reduktase-2-Mangel eine Störung der Geschlechtsentwicklung.[18][19]
Die Fokussierung des SRY-Gens ist mittlerweile umstritten. Stattdessen werden aktuell in der Biologie Netzwerkmodelle favorisiert, bei denen zahlreiche genetische sowie umweltbedingte Faktoren zusammenwirken. In Gen-Expressionsanalysen zeigten sich in den relevanten Zellgruppen in der fraglichen Zeit der Geschlechtsdetermination etwa 1000 Gene exprimiert, etwa 80 dieser Gene sind etwas genauer beschrieben (mit durchaus widersprüchlichen Ergebnissen).[20] Ein Beispiel ist der Fall eines Menschen, der den Genotyp XY besitzt, jedoch den Phänotyp einer Frau. Hier wurde eine Mutation im CBX2-Gen festgestellt.[21] Ein anderes Gen, das bei der sogenannten Autosomalen Geschlechtsumkehr beteiligt sein kann, ist SOX9 (Kampomele Dysplasie).[22][23]
Historische Vorstellungen von Geschlechtsentstehung
Zur Geschlechtsprognostik (vorgeburtliche Geschlechtserkennung), an der von Sippe oder Familie schon in alter Zeit Interesse bestand, finden sich im mittelalterlichen Schrifttum als mantisch zu bezeichnende Verfahren, etwa unter Einsatz von Selleriesamen.[24]
Die früheste naturphilosophische Erklärung zur Geschlechtsentstehung findet sich bei Alkmaion, der im 5. Jahrhundert v. Chr. davon ausging, dass gemäß der sogenannten Zweisamenlehre (Zweisamentheorie) das quantitative Überwiegen des „Samens“ des einen Geschlechtspartners über den des anderen für die Heranbildung eines weiblichen bzw. männlichen Keimlings ursächlich sei. Der Verfasser der zwischen dem 2. und 6. Jahrhundert v. Chr. entstandenen hippokratischen Schrift Über den Samen legte zugrunde, dass sowohl die Frau als auch der Mann über männliche und weibliche Samen verfüge und die Geschlechtsdetermination von dem Verhältnis der beiden unterschiedlich „starken“ Samenanteile bei der Entstehung des Keimlings abhänge. Auf Parmenides geht die Vorstellung zurück, dass die Geschlechtsentstehung von der Platzierung des (geschlechtsindifferenten) Samens in der (entsprechend der Tieranatomie einiger Säugetierarten als zweikammerig gedachten) Gebärmutter (Uterus bicornis) bestimmt sei. So entstünden im rechten Teil der Gebärmutter Jungen und im linken Mädchen. Auch in einem der Aphorismen des Hippokrates heißt es zu dieser Rechts-Links-Theorie: „Von den Embryonen befinden sich die männlichen mehr auf der rechten, die weiblichen mehr auf der linken Seite in der Gebärmutter.“ Empedokles hatte die Ansicht vertreten, dass in einer wärmeren Gebärmutter männliche (im humoralpathologischen Sinne konstitutionell wärmere) Individuen und in einer kälteren weibliche entstünden (Humoralpathologisch galt die Frau als kälter und feuchter als der Mann, was sich häufig auch in der mittelalterlichen Diagnostik und Therapie widerspiegelte[25]). Entsprechend dieser Geschlechterentstehungslehre findet sich dann auch bei Galenos diese Vorstellung, welche er mit der unterschiedlichen Blutversorgung (mit unterschiedlich warmem Blut) der Uterushälften theoretisch untermauert.[26]
Sprachliche Geschlechtsdetermination
Betrachtet man den Begriff Determination als Zuordnung (siehe dazu Determination (Logik)) so werden vor allem für das Tierreich eigene Begriffe für „Männchen“ oder „männliches Tier“ und „Weibchen“ oder „weibliches Tier“ und geschlechtsneutral für die Nachkommen verwendet. Beispielsweise
- Bulle – Kuh – Kalb bei Paarhufern und Walen
- Hahn – Henne – Küken bei Vögeln (etwa Birkhahn und Birkhenne)
- Eber – Sau – Ferkel bei Schweinen
- Rüde – Färse – Welpe bei Hunden und Wölfen
Siehe auch
Literatur
- Julianne Imperato-Mcginley, Vivian Sobel, Yuan-Shan Zhu: Fetal hormones and sexual differentiation. In: Obstetrics and Gynecology Clinics of North America. Band 31, Nr. 4, Januar 2005, S. 837–856, DOI:10.1016/j.ogc.2004.08.005 (Volltext).
Einzelnachweise
- Cahan S. Helms, L. Keller: Complex hybrid origin of genetic caste determination in harvester ants. In: Nature. Juli 2003, Band 424, Nr. 6946, S. 306–309, PMID 12867980.
- J. Whitfield: Everything you always wanted to know about sexes. In: PLOS Biology. Juni 2004, Band 2, Nr. 6:, Artikel e183/ Epub. 15. Juni 2004, PMID 15208728.
- G. Haase: Biologie der Pilze. In: Medizinische Mikrobiologie und Infektiologie. Springer, Berlin/ Heidelberg 2016, ISBN 978-3-662-48677-1, S. 609–613, doi:10.1007/978-3-662-48678-8_76 (springer.com [abgerufen am 3. August 2020]).
- N. Henriette Uhlenhaut, Susanne Jakob, Katrin Anlag, Tobias Eisenberger, Ryohei Sekido: Somatic Sex Reprogramming of Adult Ovaries to Testes by FOXL2 Ablation. In: Cell. Band 139, Nr. 6, Dezember 2009, S. 1130–1142, doi:10.1016/j.cell.2009.11.021 (elsevier.com [abgerufen am 3. August 2020]).
- J. von Hofsten, P. E. Olsson: Zebrafish sex determination and differentiation: involvement of FTZ-F1 genes. In: Reproductive Biology and Endocrinology. 10. November 2005, Band 10, Nr. 3, S. 63, PMID 16281973.
- D. M. Green: Heteromorphic sex chromosomes in the rare and primitive frog Leiopelma hamiltoni from New Zealand. In: Journal of Heredity. 1988, Band 79, S. 165–169.
- K. M. Reed, R. B. Phillips: Polymorphism of the nucleolus organizer region (NOR) on the putative sex chromosomes of Arctic char (Salvelinus alpinus) is not sex related. In: Chromosome Research. 1997, Band 5, S. 221–227.
- Andrew R. Weeks, Frantisek Marec, Johannes A. J. Breeuwer. A mite species that consists entirely of haploid females. In: Science. Nr. 292, 2001, S. 2479–2482, doi:10.1126/science.1060411.
- J. McCabe, A. M. Dunn: Adaptive significance of environmental sex determination in an amphipod. In: Journal of Evolutionary Biology. Band 10, Nr. 4, Juli 1997, ISSN 1010-061X, S. 515–527, doi:10.1046/j.1420-9101.1997.10040515.x (wiley.com [abgerufen am 3. August 2020]).
- Yasuhiko Kato, Kaoru Kobayashi, Hajime Watanabe, Taisen Iguchi: Environmental Sex Determination in the Branchiopod Crustacean Daphnia magna: Deep Conservation of a Doublesex Gene in the Sex-Determining Pathway. In: PLoS Genetics. Band 7, Nr. 3, 24. März 2011, ISSN 1553-7404, S. e1001345, doi:10.1371/journal.pgen.1001345, PMID 21455482, PMC 3063754 (freier Volltext) – (plos.org [abgerufen am 3. August 2020]).
- Ludek Berec, Patrick J. Schembri, David S. Boukal: Sex determination in Bonellia viridis (Echiura: Bonelliidae): population dynamics and evolution. In: Oikos. Band 108, Nr. 3, März 2005, S. 473–484, doi:10.1111/j.0030-1299.2005.13350.x (wiley.com [abgerufen am 3. August 2020]).
- R. Collin: Sex ratio, life-history invariants, and patterns of sex change in a family of protandrous gastropods. In: Evolution; An International Journal of Organic Evolution. April 2006, Band 60, Nr. 4, S. 735–745, PMID 16739455.
- D. J. Allsop, S. A. West: Sex-ratio evolution in sex changing animals. In: Evolution; international journal of organic evolution. Mai 2004, Band 58, Nr. 5, S. 1019–1027, PMID 15212382.
- Alfred Jost: Problems of fetal endocrinology: the gonadal and hypophyseal hormones. In: Recent Progress in Hormone Research. 1953, Band 8, S. 379–418.
- Deutscher Ethikrat: Intersexualität - Stellungnahme. Berlin, 23. Februar 2012, ISBN 978-3-941957-27-5, S. 30–31 (Volltext als PDF-Datei [abgerufen am 8. Mai 2021]).
- Serge Nef, Luis F. Parada1: Hormones in male sexual development. In: Genes & Development. 2014, Band 14, S. 3075–3086, doi:10.1101/gad.843800.
- Hey-Joo Kang, Julianne Imperato-McGinley, Yuan-Shan Zhu, Zev Rosenwaks: The effect of 5α-reductase-2 deficiency on human fertility. In: Fertility and sterility. Band 101, Nr. 2, Januar 2014, S. 310–316, doi:10.1016/j.fertnstert.2013.11.128 (Volltext).
- Julianne Imperato-McGinley, Yuan-Shan Zhu: Androgens and male physiology—The syndrome of 5 alpha-reductase-2 deficiency. In: Molecular and Cellular Endocrinology. Band 19, Nr. 1, Dezember 2002, S. 51–59, DOI:10.1016/S0303-7207(02)00368-4 (Volltext).
- Hey-Joo Kang, Julianne Imperato-McGinley, Yuan-Shan Zhu, Zev Rosenwaks: The effect of 5α-reductase-2 deficiency on human fertility. In: Fertility and sterility. Band 101, Nr. 2, Januar 2014, S. 310–316, DOI:10.1016/j.fertnstert.2013.11.128 (Volltext).
- H.-J. Voß: Making Sex Revisited: Dekonstruktion des Geschlechts aus biologisch-medizinischer Perspektive. Transcript-Verlag, Bielefeld 2010, S. 237ff.
- Ewen Callaway: Girl with Y chromosome sheds light on maleness. In: newscientist.com vom 9. April 2009; zuletzt abgerufen am 23. Juni 2016.
- Thomas Wagner, Jutta Wirth, Jobst Meyer u. a.: Autosomal sex reversal and campomelic dysplasia are caused by mutations in and around the SRY-related gene SOX9. In: Cell. 16. Dezember 1994, Band 79, Nr. 6, S. 1111–1120, doi:10.1016/0092-8674(94)90041-8.
- Gerd Scherer: Analyse von Funktion und Regulation des SOX9-Gens, des Gens für Kampomele Dysplasie und autosomale Geschlechtsumkehr. (Förderung von 1995 bis 2002) Projektbeschreibung bei der Deutschen Forschungsgemeinschaft (DFG) Auf: gepris.dfg.de; zuletzt abgerufen am 23. Juni 2016.
- Matthias Kreienkamp: Das St. Georgener Rezeptar. Ein alemannisches Arzneibuch des 14. Jahrhunderts aus dem Karlsruher Kodex St. Georgen 73. Teil II: Kommentar (A) und textkritischer Vergleich. Medizinische Dissertation, Würzburg 1992, S. 142.
- Roland Siegmund: Das „Speyrer Frauenbüchlein“. [1460] Medizinische Dissertation, Würzburg 1990, S. 18 f.
- Jutta Kollesch, Diethard Nickel: Antike Heilkunst. Ausgewählte Texte aus dem medizinischen Schrifttum der Griechen und Römer (= Reclams Universal-Bibliothek. Band 771). Philipp Reclam junior, Leipzig 1979; 6. Auflage ebenda 1989, ISBN 3-379-00411-1, S. 26 f., 75–81 (Abschnitte: Hippokrates, Über den Samen, Kap. 6–8 und Hippokrates, Aphorismen, Buch V, Aph. 48) und 185 f.
Weblinks
- Genitalentwicklung: Sexuelle Differenzierung auf anatomischer Ebene. Auf: lecturio.de, aktualisiert am 5. Oktober 2020, abgerufen am 27. Oktober 2020.
- F. Seseke, R.-H. Ringert: Embryologie des Urogenitaltraktes. Auf: swbplus.bsz-bw.de, abgerufen am 27. Oktober 2020.
- Embryonalentwicklung, Kapitel 21.5: Die äusseren Genitalien. Auf: embryology.ch, abgerufen am 27. Oktober 2020.
- Grundlagen der Entwicklungsbiologie (Memento vom 4. Februar 2009 im Internet Archive)
- Die Entdeckung des X-Chromosoms (Memento vom 31. März 2009 im Internet Archive)