Blutkreislauf des Menschen und der Säugetiere
Der Blutkreislauf des Menschen und der Säugetiere ist das Strömungssystem des Blutes im Körper des Menschen und der Säugetiere, ausgehend vom Herzen zu den Organen und wieder zurück zum Herzen. Seine Aufgabe ist die Versorgung der Organe mit Sauerstoff, Nährstoffen, Signalstoffen und anderem sowie die Entsorgung von Kohlendioxid und Stoffwechselprodukten. Er spielt auch eine wichtige Rolle bei der Wärmeregulation.
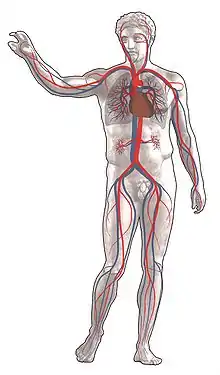
rot = sauerstoffreiches Blut
blau = sauerstoffarmes Blut
Blutgefäße, die Blut zum Herzen leiten, werden als Venen (Blutadern) bezeichnet, diejenigen, die Blut vom Herzen hin zu den Organen leiten, als Arterien (Schlagadern). Diese Bezeichnungen gelten unabhängig davon, ob das Blut im jeweiligen Gefäß sauerstoffarm oder sauerstoffreich ist. Je stärker sich die Blutgefäße verzweigen, desto kleiner wird ihr Durchmesser. Arterien werden zuerst zu Arteriolen und diese zu Kapillaren, in welchen der größte Teil des Stoffaustausches mit den Geweben stattfindet. Diese führen wiederum zusammen und bilden die postkapillären Venolen, die sich zu Venen vereinigen.
Der Kreislauf des Menschen ist besser untersucht als bei den verschiedenen Säugetierarten, daher beziehen sich die Angaben im Artikel auf den Menschen, wenn nicht anders angegeben. Der Blutkreislauf ist innerhalb der Säugetiere jedoch sehr ähnlich.
Funktion
Blut erfüllt im Körper verschiedene Aufgaben. Es transportiert Sauerstoff aus den Lungen zum Gewebe und Kohlenstoffdioxid zurück. Weiterhin wird das Gewebe mit Nährstoffen aus dem Verdauungstrakt versorgt und von entstandenen Stoffwechsel- und Abfallprodukten befreit, die zu den Ausscheidungsorganen (Nieren und Leber) transportiert werden. Blut dient zudem als wichtiges Medium für den Transport von Hormonen zwischen einzelnen Organsystemen sowie von Komponenten der Immunabwehr und der Blutgerinnung zu Orten im Körper, an denen sie gebraucht werden.
Der Blutkreislauf dient demzufolge letztendlich dazu, es dem Blut zu ermöglichen, sich durch den gesamten Körper zu bewegen. Weiterhin spielt der Blutkreislauf eine wichtige Rolle bei der Thermoregulation. Über den Grad der Durchblutung der Haut wird die Wärmeabgabe über die Körperoberfläche reguliert.
Anatomie des Blutkreislaufs der Säugetiere
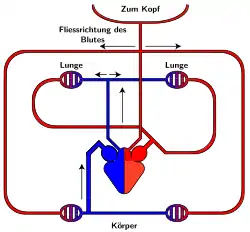
rot = sauerstoffreiches Blut
blau = sauerstoffarmes Blut
Im Gegensatz zu den wechselwarmen Wirbeltieren ist das Herz der Säugetiere wie das der Vögel vollständig in vier Räume (Herzhöhlen genannt) geteilt. Deshalb kann es als in zwei Hälften geteilt betrachtet werden, obwohl es sich im gesamten um ein einziges Organ handelt. Jede dieser Hälften besteht aus einem Vorhof und einer Kammer, die jeweils als Einheit arbeiten. Während die rechte Herzhälfte das Blut durch den Lungenkreislauf pumpt, der das Blut mit Sauerstoff anreichert, pumpt die linke Herzhälfte das Blut durch den Körperkreislauf, um die Organe mit Nährstoffen und Sauerstoff zu versorgen.
Diese beiden Kreisläufe sind in Reihe geschaltet, so dass das gesamte Blut immer auch durch den Lungenkreislauf fließen muss. Im Unterschied dazu sind die Organe im Körperkreislauf parallel geschaltet.
Die Existenz zweier Blutkreisläufe (großer Körper- und kleiner Lungenkreislauf) hat wichtige Vorteile:
- Der Druck kann in beiden Kreisläufen unterschiedlich sein. Im Lungenkreislauf ist er erheblich niedriger, so dass es nicht zu starkem Flüssigkeitsaustritt aus den Blutgefäßen kommt, der einen Gasaustausch behindern würde.
- Die Lunge mit ihren Kapillaren funktioniert als Filter gegen Blutgerinnsel (Thromben) u. ä., bevor das Blut von der linken Herzseite unter anderem zum Gehirn gepumpt wird. Die Lunge hat dazu thrombenlösende Eigenschaften.
Im Lungenkreislauf verlässt das Blut die rechte Herzkammer über den Lungenstamm (lat. Truncus pulmonalis) in Richtung der Lungen, wo es mit Sauerstoff angereichert wird. Dann wird es von der Lungenvene (lat. Vena pulmonalis) in den linken Vorhof gepumpt. Vom linken Vorhof gelangt es in die linke Kammer, von wo aus es durch die Aorta in den Körperkreislauf gepumpt wird. Bei den Säugern verläuft die Aorta auf der linken Körperseite. Nach der Versorgung der Organe kehrt das nun mit Kohlendioxid angereicherte Blut durch die obere und die untere Hohlvene in den rechten Vorhof zurück. Wenn das Blut vom rechten Vorhof in die rechte Kammer kommt, beginnt der Kreislauf von neuem.
Eine Besonderheit stellt das Pfortadersystem dar. Blut, das von den Organen des Verdauungstrakts kommt, wird in der Pfortader gesammelt und gelangt in die Leber, wo die aufgenommenen Nährstoffe verwertet werden. Auch die Hirnanhangsdrüse (Hypophyse) hat ein Pfortadersystem.
Forschungsgeschichte
Dass Herzschlag und Puls zusammenhängen, wurde schon im Papyrus Ebers um 1550 v. Chr. beschrieben. Im 5. Jahrhundert v. Chr. soll der chinesische Arzt Pien Ts'Io anhand des getasteten Pulses Diagnosen und Prognosen von Erkrankungen erstellt haben.[1] Eine Schrift des Corpus Hippocraticum aus dem 3. Jahrhundert v. Chr. enthält bereits Beschreibungen der Herzklappen,[2] doch wurde deren Funktion zu diesem Zeitpunkt noch nicht erkannt.[3]
Da sich Blut nach dem Tod in den Venen sammelt, erscheinen Arterien in toten Körpern nahezu leer. Verschiedene antike Anatomen vermuteten daher, dass diese Gefäße Luft enthielten und eine Rolle im Transport des Atems spielten (altgriechisch αρτηρία artēría, deutsch ‚Luftader‘). Herophilos von Chalkedon unterschied zwischen den Venen und den Arterien, von denen er glaubte, dass sie den Pulsschlag selbständig erzeugen würden. Erasistratos beobachtete, dass bei lebendigem Leib durchtrennte Arterien bluten. Allerdings vermutete er, dass hierbei die entweichende Luft durch das aus kleinen Verbindungsadern zwischen Venen und Arterien nachströmende Blut ersetzt wird. Somit war er der erste, der Kapillaren postulierte, jedoch mit verkehrter Richtung des Blutflusses.
Im 2. Jahrhundert wusste Galenos nicht nur, dass Blutgefäße Blut transportieren, er unterschied auch dunkleres venöses von arteriellem Blut, das heller und dünner ist. Den unterschiedenen Flüssigkeiten schrieb er verschiedene Aufgaben zu. Wachstum und Energie kämen von dem dunkleren Blut, das in der Leber aus Galle gebildet und über die Venen in Körpergewebe transportiert würde. Hingegen brächte das aus dem Herz kommende arterielle Blut Vitalität durch die enthaltene Luft. Nach seinen Vorstellungen floss Blut aus diesen beiden Organen jeweils in alle Teile des Körpers, wo es gebraucht und verbraucht werde. Ein Rückstrom zu Herz oder Leber fand hiernach nicht statt. Auch kam dabei dem Herz keine pumpende Aufgabe zu. Es nähme in der Diastole Blut saugend auf, dessen Transport durch die Pulsierungen der Arterien erfolge. Galen glaubte, dass arterielles Blut aus venösem Blut gebildet wird, das durch Poren in der Scheidewand zwischen den Kammern aus der rechten in die linke Herzkammer sickert. Im Unterschied zu Aristoteles vor ihm – und Avicenna[4] nach ihm – ging Galen nicht von drei, sondern von zwei Herzkammern aus.
Im 13. Jahrhundert entdeckte Ibn an-Nafis, ein arabischer Arzt und Anatom, soweit bekannt erstmals, dass Blut in einem Kreislauf durch die Lunge fließt. Seine Erkenntnisse, die als Zeichnungen bis in die heutige Zeit überliefert sind, gelangten jedoch damals nicht in den europäischen Raum. Dort beschrieb der spanische Arzt und humanistische Gelehrte Michael Servetus (1511–1553) dasselbe Phänomen 1546,[5] wie wenige Jahre später unabhängig davon auch der italienischen Arzt und Anatom Realdo Colombo, ohne dass diese Ergebnisse einer breiteren Öffentlichkeit bekannt wurden.[6] Daher wurde Ende des 16. Jahrhunderts weiterhin mehrheitlich die Ansicht vertreten, dass das Blut im Herz gebildet werde und von dort ins Gewebe sickere.[7]
Im 17. Jahrhundert wurde der Blutkreislauf im Körper erstmals durch William Harvey zutreffend beschrieben, nachdem zuvor jahrhundertelang die Lehre Galens die medizinische Lehrmeinung bestimmt hatte. Harvey stellte seine Überlegungen aufgrund der Entdeckung der hydraulischen Funktionsweise der Venenklappen durch seinen Lehrer, den Italiener Girolamo Fabrizio, an, da er eine Verbindung zur Funktion des Herzens suchte. Er fand sie in der Kreislauftheorie, die er in seinem 1628 in Frankfurt/Main erschienenen Werk Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus (Anatomische Studien über die Bewegung des Herzens und des Blutes in Tieren) veröffentlichte. Diese Arbeit begann die Fachwelt zu überzeugen. Wie das Blut vom arteriellen in den venösen Schenkel kommt, konnte allerdings erst 1661 Marcello Malpighi mit seiner Entdeckung der Kapillaren erklären.
Im 17. Jahrhundert gab es noch Versuche, Kenntnisse des von Harvey entdeckten Blutkreislaufs bereits bei Hippokrates nachzuweisen. So 1665 von dem Hippokratesverehrer Johannes Antonides van der Linden und 1680 von Georg Wolfgang Wedel.[8]
Aufbau und Typen von Blutgefäßen
Blutgefäße werden aufgrund ihres Aufbaus und ihrer Funktion in mehrere Arten unterteilt. Die Arterien transportieren das Blut unter hohem Druck und mit hoher Fließgeschwindigkeit, deswegen besitzen sie eine dicke, muskuläre Gefäßwand. Durch sie gelangt das Blut aus dem Herzen in die verschiedenen Gewebe. Von den Arterien gehen die Arteriolen ab, sie dienen als Kontrollventile und haben deswegen starke muskuläre Wände, die die Gefäße verengen (Vasokonstriktion) oder weiten (Vasodilatation) können. Sie verzweigen sich weiter zu den Kapillaren, die den Austausch von Flüssigkeiten, Nährstoffen, Elektrolyten, Hormonen und anderen Stoffen zwischen Blut und Gewebe vornehmen und deswegen mit einer dünnen Gefäßwand (nur Endothel) ausgestattet sind, die für niedermolekulare Stoffe durchlässig (selektiv permeabel) ist. In einigen Organen (Leber, Milz) sind die Kapillaren erweitert und das Endothel wird diskontinuierlich, dann spricht man von Sinusoiden.
Venolen haben nur eine dünne Gefäßwand. Sie sammeln das Blut aus den Kapillaren, um es wieder den Venen zuzuführen, die es von der Peripherie zurück zum Herzen transportieren. Weiterhin dienen sie als Blutspeicher. Sie haben dünne muskuläre Wände, die das Weiten oder Verschließen der Gefäße erlauben. Ein Teil der Flüssigkeit tritt im Kapillargebiet aus den Gefäßen aus und wird über Lymphgefäße abtransportiert. Die großen Lymphsammelstämme münden nahe dem Herzen wieder in das Venensystem.
Benachbarte Blutgefäße mit gleichem Zielgebiet werden als Kollateralen bezeichnet. In fast allen Körperregionen gibt es Verbindungen zwischen diesen benachbarten Blutgefäßen, sogenannte Anastomosen. Diese sorgen dafür, dass bei einer Verlegung (etwa einer Thrombose) oder Verletzung eines Blutgefäßes die Versorgung vom Nachbargefäß übernommen werden kann. Arterien, die keine Anastomosen aufweisen, nennt man Endarterien. Kommt es zu einer Verlegung einer Endarterie, so wird der entsprechende Gewebsabschnitt nicht mehr mit Blut versorgt und stirbt ab (Infarkt). Die Anastomosen können aber auch zu schwach sein, um eine vollständige Kompensation eines Ausfalls zu ermöglichen. In diesem Fall spricht man von funktionellen Endarterien. Eine Verstopfung oder Verletzung dieser Arterien führt zu einer Minderdurchblutung (Ischämie).
Hämodynamik
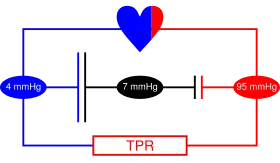
In der Hämodynamik gelten approximativ[9] die Gesetze der Hydromechanik. Zur Beschreibung des Herz-Kreislauf-Systems bedient man sich Analogien zu elektrischen Stromkreisen:
- Elektrische Spannung entspricht der Druckdifferenz
- Elektrische Stromstärke (Ladung pro Zeit) entspricht der Volumenstromstärke (Blutvolumen pro Zeit)
- Elektrischer Widerstand entspricht dem Gefäßwiderstand
Die kirchhoffschen Regeln lassen sich folgendermaßen übertragen:
- Bei Aufzweigung oder Vereinigung von Gefäßen ist die Summe der Volumenstromstärken der zuführenden Gefäße gleich der Summe der Volumenstromstärken der abführenden Gefäße. Dies ergibt sich intuitiv aus der Überlegung, dass kein Blut verloren geht.
- Zwischen zwei Punkten im Gefäßsystem A und B besteht eine Druckdifferenz, die sich als Summe der Druckdifferenzen auf dem Weg von A nach B berechnen lässt. Für jeden beliebigen Weg durch das Gefäßsystem erhält man dieselbe Druckdifferenz zwischen A und B.
Von besonderer Bedeutung ist die Entsprechung des ohmschen Gesetzes:
- oder umgestellt
mit
| Variable | Bedeutung | SI-Einheit |
|---|---|---|
| Volumenstrom durch das Gefäß | m3·s−1 | |
| Druckdifferenz zwischen Punkt A und Punkt B | kg·m−1·s−2 | |
| Gefäßwiderstand | kg·m−4·s−1 |
Dieses besagt, dass die Druckdifferenz zwischen zwei Punkten eines Gefäßsystems umso größer ist, je größer der Gefäßwiderstand und je größer der Volumenstrom durch das Gefäß ist. Umgestellt nach dem Volumenstrom ergibt sich, dass dieser umso größer ist, je größer die Druckdifferenz und je kleiner der Widerstand ist. Der Abfall des Druckes im Verlauf eines Gefäßsystems lässt sich damit als Antrieb des Blutstroms auffassen. Oder anders gesagt: Die Druckdifferenz ist die Ursache, der Volumenstrom die Wirkung. All diese Zusammenhänge gelten sowohl für einzelne Gefäße als auch für größere Stromgebiete (z. B. ganzes Organ, alle Arterien, gesamter Körperkreislauf); die entsprechenden Widerstände ergeben sich dabei unter sinngemäßer Anwendung der Regeln zur Addition von elektrischen Widerständen in Reihen- und Parallelschaltung aus den Widerständen der enthaltenen Einzelgefäße oder Gefäßsysteme.
Der Widerstand des gesamten Körperkreislaufs heißt totaler peripherer Widerstand (TPR). Weil die gedanklich zusammengefassten Kreislaufabschnitte „Arterien“, „Arteriolen“, „Kapillaren“, „Venolen“ und „Venen“ in Reihe geschaltet sind, lässt sich der TPR durch Addition der zusammengefassten Widerstände dieser Kreislaufabschnitt berechnen. So entfallen vom Widerstand[10]
- 45–55 % auf die terminalen Arterien und Arteriolen (Widerstandsgefäße, regulierbar),
- 20–25 % auf die Kapillaren,
- 3–4 % auf die Venolen und nur
- 3 % auf die mittleren und großen Venen.
Aus der Reihenschaltung folgt ferner, dass die Stromstärke in all diesen Kreislaufabschnitten dieselbe ist, nämlich das Herzzeitvolumen. Weil der Volumenstrom derselbe ist, treten wegen in den Abschnitten mit dem größten Widerstand auch die größten Druckabfälle auf: Beträgt der Mitteldruck in der Aorta und in den großen Arterien noch etwa 130 hPa (100 mmHg), fällt er in den Arterienästen auf 50 hPa (40 mmHg) ab, und beträgt in den Kapillaren nur noch 33 hPa (25 mmHg). In den Venolen beträgt er 27 hPa (20 mmHg), in den Pfortadern letztendlich nur noch 4 hPa (3 mmHg). Insgesamt wird der Blutstrom durch den Körperkreislauf also von einer Druckdifferenz in der Größenordnung 90 mmHg angetrieben, diese Differenz wird auch als arteriovenöse Druckdifferenz (Differenz zwischen mittlerem arteriellen und zentralem Venendruck) bezeichnet. Der Widerstand des Lungenkreislaufs ist viel niedriger als der des Körperkreislaufs; weil die Stromstärke (normale Anatomie vorausgesetzt) aber dieselbe sein muss, sind hier nur 7 mmHg Druckdifferenz zwischen den Pulmonalarterien (14 mmHg) und den Lungenvenen (7 mmHg) nötig.[11]
Unter Verwendung der Größen arteriovenöse Druckdifferenz für , totaler peripherer Widerstand für und Herzzeitvolumen für , lassen sich Aussagen über den gesamten Körperkreislauf treffen: Eine Senkung des TPR erhöht bei gleichbleibender arteriovenöser Druckdifferenz wegen das Herzzeitvolumen, anders gesagt muss die Frequenz oder das Schlagvolumen des Herzens steigen, damit der Blutdruck konstant bleibt. Wird dagegen das Herzzeitvolumen konstant behalten, sinkt wegen die arteriovenöse Druckdifferenz und damit der arterielle Blutdruck.
Blutdruck und -volumen
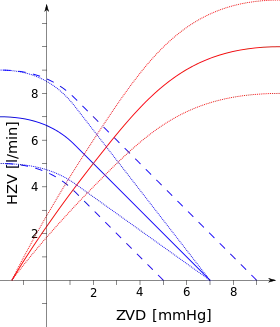
Herzfunktionskurve (HZV steigt mit zunehmendem ZVD wegen Frank/Starling)
|
Gefäßfunktionskurve (ZVD sinkt mit zunehmendem HZV wegen Verlagerung von Blut ins Hochdrucksystem)
|
| Die Verschiebungen der Kurven treten im Rahmen der sympathischen (s) und parasympathischen (p) Steuerung auf, können aber auch Krankheiten modellieren. |
Man unterscheidet zwischen dem Niederdruck- und dem Hochdrucksystem. Zum Niederdrucksystem gehören die Venen des Körperkreislaufs, das rechte Herz, die Gefäße des Lungenkreislaufs, der linke Vorhof und nur während der Diastole auch die linke Herzkammer.[12] Zum Hochdrucksystem gehören die linke Kammer während der Systole sowie die Arterien und Arteriolen des Körperkreislaufs.[12] Das Niederdrucksystem enthält fast 85 % des Blutvolumens,[12]
Ohne Herztätigkeit ergibt sich ein mittlerer Füllungsdruck von etwa 6–7 mmHg in beiden Systemen.[13] Ein arbeitendes Herz hält verglichen mit diesem Zustand eine Verschiebung von Blut ins Hochdrucksystem aufrecht. Dabei steigt der mittlere arterielle Blutdruck stark an, während der zentrale Venendruck nur um etwa 2–4 mmHg abfällt.[13] Der Grund dafür sind die sehr unterschiedlichen Dehnbarkeiten beider Systeme: Eine gleiche Druckveränderung geht im Niederdrucksystem mit einer 200-mal größeren Volumenveränderung einher als im Hochdrucksystem.[12] Venen stellen daher Kapazitätsgefäße dar, deren Kapazität (Compliance, Volumen pro Druck) durch gesteigerten glattmuskulären Tonus gesenkt werden kann,[14] wobei der zentrale Venendruck steigt.[15] Dies tritt als Anpassung an körperliche Aktivität auf (da ein erhöhter zentraler Venendruck über den Frank-Starling-Mechanismus das Schlagvolumen des Herzens erhöht), ferner kompensatorisch bei Blutverlust (der fast vollständig das Niederdrucksystem betrifft) sowie als Teil der Orthostase-Reaktion. Im umgekehrten Fall, der zum Beispiel bei Bluttransfusionen auftritt, ändert sich ebenfalls hauptsächlich das Volumen des Niederdrucksystems.
Spricht man umgangssprachlich vom Blutdruck, so meint man den Blutdruck der Arterien im Körperkreislauf. Dieser schwankt zwischen Systole (der Auswurfphase des Herzens) und Diastole (der Füllungsphase in den vier Herzhöhlen) und wird als Doppelwert dieser beiden Phasen angegeben. Dabei werden zuerst der systolische und dann der diastolische Wert genannt. Durchschnittlich liegen diese Werte für die Systole zwischen 130 und 190 hPa (100–140 mmHg) und für die Diastole zwischen 80 und 120 hPa (60–90 mmHg). Der Unterschied zwischen dem systolischen und dem diastolischen Blutdruck wird als Pulsamplitude, als Blutdruckamplitude oder als Pulsdruck bezeichnet.
Blutfluss
Obwohl das Herz nur während der Systole Blut auswirft, ist der Blutstrom durch den Körper recht gleichmäßig. Dies liegt an der sogenannten Windkesselfunktion der Aorta und der großen Arterien. Während der Systole dehnt sich die Gefäßwand aus; so nimmt die Schlagader einen Teil des ausgeworfenen Blutes auf – und gibt ihn in der Diastole, in der kein Blut aus dem Herzen austritt, wieder ab. Diese Volumendehnbarkeit (Compliance) wandelt also das stoßweise austretende Blut in einen gleichmäßigeren Strom um. Würde der Druck nicht durch die elastischen Gefäße gespeichert werden können, so würde der Druck in der Aorta wesentlich dramatischer schwanken. Interessanterweise würde im zeitlichen Mittel aber wesentlich weniger Blut durch die Gefäße strömen, da viel Strömungsenergie für das ständige Beschleunigen des Blutes aufgezehrt würde.
Die Druckwelle bewegt sich beim jungen, erwachsenen Menschen mit etwa 6 Metern pro Sekunde, beim alten Menschen verdoppelt sich die Geschwindigkeit. Da mit zunehmendem Lebensalter die Gefäßwände immer unelastischer werden, vermindert sich der Druckspeichereffekt mit dem Lebensalter immer mehr und der Volumenstrom reduziert sich.
Von der Geschwindigkeit der Druckwelle zu unterscheiden ist die wesentlich geringere Fließgeschwindigkeit des Blutes. Das Produkt von Fließgeschwindigkeit v und Querschnittsfläche A aller parallel geschalteten Gefäße eines Kreislaufabschnitts (z. B. aller Arterien, aller Arteriolen, aller Kapillaren, aller Venolen oder aller Venen) muss im zeitlichen Mittel dem Herzzeitvolumen entsprechen. Aus dem Volumenstrom und dem Kontinuitätsgesetz
ergibt sich, dass die Fließgeschwindigkeit in der verhältnismäßig engen Aorta am größten (bei einem Querschnitt von 5 cm² maximal 1,2 m/s, im Mittel 0,15 m/s bis 0,2 m/s)[16] und in den postkapillären Venolen am kleinsten ist (bei einem geschätzten Gesamtquerschnitt von 0,3 m² unter Annahme eines Herzzeitvolumens von 5,6 l/min 0,3 mm/s)[10]. Die niedrige Fließgeschwindigkeit bei geringem Druck prädestiniert die postkapillären Venolen für den Durchtritt von Immunzellen.
Während der Blutfluss in den Arterien allein von der Pumpkraft des Herzens realisiert wird, spielen bei Venen verschiedene Faktoren eine Rolle. Zu einem gewissen Grad wirkt die Pumpkraft über das Kapillarbett hinaus auch auf die Venen (sog. vis a tergo, „Kraft von hinten“). In den Venen wird das Blut vor allem schubweise über von außen wirkende Kräfte zurück zum Herz transportiert. Die äußeren Kräfte sind vor allem die Kontraktionen umliegender Skelettmuskeln (Muskelpumpe), außerdem die Druckwellen durch anliegende Arterien. Bei den großen Venen im Körperinneren wird der Blutfluss durch die Druckschwankungen bei der Atmung (Erweiterung der Venen durch den Unterdruck bei der Inspiration) realisiert. Venenklappen verhindern, dass Blut durch die Kraftwirkung oder aufgrund der Schwerkraft in die falsche Richtung fließt. Der Ansaugdruck durch die Erweiterung der Vorhöfe des Herzens spielt nur bei den herznahen großen Venen eine Rolle.
Regulation der Durchblutungsstärke
Die gleichzeitige maximale Durchblutung aller Gefäße ist nicht möglich, da maximale Durchblutung minimale Gefäßwiderstände bedeutet und der totale periphere Widerstand damit so niedrig wäre, dass selbst bei maximalem Herzzeitvolumen der Blutdruck nicht mehr im Soll gehalten werden könnte (dieser lebensbedrohliche Zustand tritt näherungsweise beim anaphylaktischen Schock auf). Der Körperkreislauf besteht daher aus vielen parallel geschalteten Anteilen, die je nach Aktivität zu- oder abgeschaltet werden können, sodass der periphere Widerstand nicht unnötig niedrig ist und das Herz geschont wird. So wird etwa nach der Nahrungsaufnahme der Verdauungsapparat vorrangig versorgt, andere Organsysteme werden gedrosselt, Hochleistungssport ist dann nicht möglich. Die Realisierung dieser Zu- und Abschaltungen erfolgt über mehrere Wege:
- Die Gefäßweite (das Lumen) der Arterien und besonders der Arteriolen wird durch den Spannungszustand (Tonus) der glatten Muskulatur in der Gefäßwand gesteuert. Gefäßweitung (Vasodilatation) senkt den Gefäßwiderstand und steigert die Durchblutung, Gefäßverengung (Vasokonstriktion) steigert den Gefäßwiderstand und senkt die Durchblutung. Durch die Tätigkeit lokaler Schrittmacherzellen[17] ist der Tonus der Arteriolen selbst bei Konstanz aller steuernden Signale nicht statisch, sondern oszilliert mit niedriger Frequenz (Vasomotion), sodass die Durchblutung auf Ebene der Mikrozirkulation zeitlich periodischen Schwankungen unterliegt. Zu einem gegebenen Zeitpunkt ist durchschnittlich nur ein Drittel der Kapillaren durchströmt, wobei sowohl dieser Anteil als auch der Strom durch die einzelne Kapillare bei Dilatation der vorgeschalteten Arteriole zunimmt.[18]
- Arteriovenöse Anastomosen: Anastomosen sind Querverbindungen zwischen Blutgefäßen, in diesem Fall zwischen Arteriole und Venole. Die Öffnung von arteriovenösen Anastomosen ermöglicht in manchen Organen die Umgehung des Kapillarbetts.
- Vorkapillare Schließmuskeln: Normale Arterien können zwar ihr Lumen verengen, aber nicht bis zu einem vollständigen Verschluss. In den kleinsten Arteriolen gibt es dagegen spezielle Bildungen der mittleren Wandschicht, die als Sphincter praecapillaris bezeichnet werden. Diese können das Lumen verschließen und somit den Blutfluss im sich anschließenden Kapillarbett reduzieren.
- Sperrarterien: Sperrarterien sind Arterien, die ebenfalls ihr Lumen verschließen können. Solche Sperrarterien gibt es am Penisschwellkörper. Sie sind normalerweise geschlossen und erst ihre Öffnung löst einen Blutfluss und damit die Schwellkörperfüllung (Erektion) aus.
- Drosselvenen: Drosselvenen sind Venen, die ihr Lumen einengen können. Sie kommen vor allem in der Schleimhaut des Darmes vor. Bei einer Einengung werden der Blutabfluss aus dem Darm verlangsamt und damit die Blutmenge vergrößert und die Zeit zum Übertritt der resorbierten Nährstoffe in das Blut verlängert. Außerdem sind sie im Nebennierenmark zu finden.
Beim gesunden Tier (oder Mensch) kann eine ausreichende Durchblutung in einer weiten Spanne von Umgebungs- und Belastungsbedingungen aufrechterhalten werden. Dabei stehen die Ansprüche der Organe nach guter Versorgung, die Verteilung des Blutstroms nach den Anforderungen der Thermoregulation an den Wärmetransport und die Minimierung der Herzarbeit im Widerstreit zueinander, was sich in den unterschiedlichen Regelkreisen widerspiegelt. Hinzukommen Mechanismen zur Senkung der Durchblutung bei Gefäßverletzung und zur Steigerung der Durchblutung bei Entzündung und Heilung. Kreislaufregulatorische Einrichtungen werden durch
- neuronale Signale aus dem Zentralnervensystem,
- hormonale Signale und
- lokal-chemische Signale beeinflusst,
wobei die lokalen Signale eine ausreichende Blutversorgung sichern und die globalen Signale, die der Konstanz des Blutdrucks dienen, überschreiben können. Sportliche Aktivität bewirkt beispielsweise globale Vasokonstriktion, die lokal zugunsten der arbeitenden Muskulatur und der Wärmeabgabe über die Haut aufgehoben wird; im Ergebnis ist der periphere Widerstand nur so stark erniedrigt, dass der Blutdruck bei erhöhtem Herzzeitvolumen konstant oder sogar erhöht ist.
Systemische Steuerung über das Nervensystem
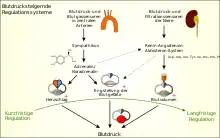
Regelzentrum der zentralen Kreislaufsteuerung sind Neuronenpopulationen in der Formatio reticularis der Medulla oblongata und den bulbären Abschnitten des Pons. Diese werten Informationen von Kreislaufsensoren aus, die den arteriellen Blutdruck, die Pulsfrequenz, den Füllungsdruck des Niederdrucksystems und den pH-Wert, Kohlendioxid- und Sauerstoff-Partialdruck des Blutes messen. Über Sympathikus und Parasympathikus werden Herzaktivität (Chronotropie, Inotropie usw.) und Gefäßtonus (Widerstand der Widerstandsgefäße und Dehnbarkeit der Kapazitätsgefäße) in geeigneter Weise beeinflusst, sodass negativ rückgekoppelte Regelkreise entstehen.
- Baroreflex: In der Wand der Aorta und des Karotissinus messen Dehnungssensoren (Barorezeptoren) den transmuralen Druck und leiten die Information über den Nervus vagus bzw. Nervus glossopharyngeus zum Nucleus tractus solitarii. Diese Regulation wirkt aber nur akuten Blutdruckänderungen entgegen, wie zum Beispiel beim Aufstehen aus dem Liegen. Ist der Blutdruck jedoch immer auf einem erhöhten (oder erniedrigten) Niveau, so erfolgt eine Anpassung und der „neue“ Blutdruck wird gleich gehalten. Ein Ausfall der Barosensoren führt zu einem erhöhten und stark schwankenden Blutdruck. Die zentrale Verarbeitung von Druckinformationen – auch von solchen, die Sensoren im Niederdrucksystem gewinnen – ist ferner im Volumenhaushalt, der über das Blutvolumen und den Frank-Starling-Mechanismus den Blutdruck langfristig reguliert, von Bedeutung.
- Ischämiereaktionen: Die Gaspartialdrücke und der pH-Wert werden von spezialisierten Sensoren (sog. Chemorezeptoren) in Paraganglien erfasst, die ebenfalls an der Halsschlagader (Glomus caroticum), der Aorta (Paraganglion supracardiale, Syn. Glomus aorticum) und der Lungenarterie liegen. Sauerstoffunterversorgung des Gehirns löst über den Cushing-Reflex globale Vasokonstriktion mit der Konsequenz eines teils massiven Blutdruckanstiegs aus.
Durch eine Verletzung von Nerven oder deren Fehlfunktion kann es zu einem spinalen oder neurogenen Schock kommen.
Der Hypothalamus wirkt als übergeordnetes Zentrum auf die bisher besprochene Regulation; er löst vegetative Reaktionen aus und nimmt als oberstes Regelzentrum der Thermoregulation Einfluss auf die Durchblutung der Haut, die darüber hinaus Stellglied lokaler und spinaler thermoregulatorischer Regelkreise ist. Die Großhirnrinde kann in Form einer zentralen Mitinnervation Einfluss auf die Kreislaufsteuerung nehmen, sodass bereits vor Beginn einer körperlichen Leistung die Herzaktivität gesteigert und die betroffene Muskulatur besser durchblutet wird (Startreaktion).
Sympathikus
Der postganglionäre Neurotransmitter des Sympathikus ist das Noradrenalin. Aus Varikositäten an den kleinen Arterien und Arteriolen freigesetzt bindet es an α1-Rezeptoren der glatten Muskulatur und steigert deren Tonus über eine Erhöhung des intrazellulären Calciums. Die sympathische Steuerung weist einen Ruhetonus auf, der in Organen mit stark wechselnder Durchblutung besonders ausgeprägt ist; eine Vasodilatation wird durch Nachlassen des Sympathikotonus erreicht. Die Noradrenalinausschüttung wird lokal moduliert: Angiotensin II wirkt stimulierend (auch auf die Synthese, die Wiederaufnahme wird dagegen gehemmt), H⁺, K⁺, Adenosin, Histamin, Serotonin, Prostaglandin E1, Acetylcholin und NO wirken hemmend. Noradrenalin hemmt seine eigene Ausschüttung im Sinne einer negativen Rückkopplung durch Bindung an α2-Rezeptoren der Varikosität.[19]
Parasympathikus
Die durch den Parasympathikus vermittelte Vasodilatation ist nur in wenigen Organen von Bedeutung, etwa in den Speicheldrüsen und den Geschlechtsorganen (Erektion). Als Transmitter wirken NO und Bradykinin.
Systemische Steuerung über Hormone
Hormone und Gewebshormone wirken entweder direkt auf die Muskulatur der Gefäßwand oder über endothelvermittelte Mechanismen (weiter unten behandelt).
Katecholamine
- Noradrenalin aus dem Blut wirkt wie Noradrenalin aus sympathischen Varikositäten konstriktiv durch Bindung an α1-Adrenorezeptoren.
- Adrenalin wird (neben Noradrenalin) im Nebennierenmark ins Blut ausgeschüttet und wirkt ebenfalls konstriktiv über α1-Rezeptoren. Nur bei niedrigen Konzentrationen löst es in den Gefäßen von Skelettmuskel, Myokard und Leber aufgrund der dort zusätzlich exprimierten β2-Rezeptoren eine Vasodilatation aus. β2-Rezeptoren binden Adrenalin mit größerer Affinität als α1-Rezeptoren, bei hohen Konzentrationen werden jedoch beide Rezeptoren aktiviert, wobei die Wirkung der α1-Rezeptoren dominiert.
Autakoide
- Eikosanoide haben unterschiedliche Effekte auf die Gefäße. Während Prostaglandin-F2 und Thromboxane A2 und B2 konstriktiv wirken, haben Prostaglandin-E2 und PGI2 dilatative Wirkungen.
- Die Wirkungen von Serotonin auf die glatte Muskulatur sind komplex und hängen von der Art der exprimierten Rezeptoren ab.
Hormone der Volumen- und Osmoregulation
- Angiotensin II aus dem Renin-Angiotensin-Aldosteron-System wirkt konstriktiv, indem es die Noradrenalinfreisetzung an der sympathischen Varikosität fördert (siehe oben). Die direkte Wirkung an der glatten Muskulatur ist nur in der Niere bedeutsam; die Vasokonstriktion vermindert dort die Harnproduktion und trägt damit indirekt zur Erhöhung des Blutdrucks bei.
- ADH wirkt in hohen Konzentrationen, wie sie physiologisch nur im Schock auftreten, kreislaufzentralisierend (dilatativ in Herz und Gehirn, sonst konstriktiv), weshalb es auch Vasopressin genannt wird.
Mediatoren der neurogenen Entzündung
Im Rahmen der neurogenen Entzündung setzen Schmerzfasern Substanz P und CGRP frei, die (ausschließlich bzw. teilweise NO-vermittelt) vasodilatativ wirken.
Bayliss-Effekt
Beim Bayliss-Effekt tritt eine Kontraktion der Gefäßmuskulatur als Reaktion auf eine Erhöhung des transmuralen Drucks auf (myogene Antwort), sodass der Blutdruck in den nachgeschalteten Gefäßabschnitten konstant gehalten wird. Er tritt in Gehirn, Niere und Verdauungstrakt auf, nicht aber in der Haut oder der Lunge. Der Bayliss-Effekt betrifft wie der lokal-metabolische Effekt vor allem die (terminalen) Arteriolen.
Lokal-metabolischer Effekt
Der lokal-metabolische Effekt passt die Durchblutung den Stoffwechselbedingungen des Organs an (zum Beispiel Steigerung der Durchblutung des Magen-Darm-Traktes während der Verdauung oder der Hand nach kälteinduzierter Minderdurchblutung). Eine Erhöhung der Konzentrationen von Kohlendioxid, H⁺, K⁺, ADP, AMP, Adenosin oder allgemein der Osmolarität (allesamt Zeichen erhöhter metabolischer Aktivität bzw. Unterversorgung) bewirkt dabei durch direkte Wirkung an der glatten Muskulatur eine Vasodilatation. Die daraus resultierende bessere Durchblutung verhindert das Anfallen oder begünstigt den Abtransport dieser Stoffe. Besonders wichtig ist diese Art der Steuerung im Herzmuskel (Myokard) und im Gehirn.
Sauerstoffmangel löst eine Vasodilatation aus, die daraus resultierende Mehrversorgung mit Blut wirkt diesem entgegen (nur in der Lunge kommt es zur Vasokonstriktion, damit das Blut zur Oxygenierung bevorzugt in gut belüftete Lungenabschnitte gelangt). Die Vasodilatation wird dabei durch NO vermittelt, das bei niedrigem Sauerstoffpartialdruck hämoglobinkatalysiert aus Nitrit und S-nitrosierten Proteinen freigesetzt sowie vermehrt vom Endothel gebildet wird (zusammen mit PGI2).[20] Als Hypoxiesignal dient ferner das ATP/ADP-Verhältnis in den glatten Muskelzellen der Gefäße; über Aktivierung von K⁺ATP-Kanälen kommt es zur Hyperpolarisation und damit zur Erschlaffung der Muskulatur mit der Folge verstärkter Durchblutung des hypoxischen Areals.[21]
Endothelvermittelte Mechanismen
Das Endothel (die die Gefäßwand auskleidende Zellschicht) bildet vasoaktive Autakoide, die oft zugleich Wachstumsfaktoren sind:
- dilatativ: NO, PGI2, EDHF (stimuliert durch Bradykinin), CNP
- konstriktiv: Endothelin-1, Urotensin II
Stickstoffmonoxid (NO) wird von der NO-Synthase aus Arginin abgespalten. Da der Signalweg Calmodulin-abhängig ist, wirken Calcium-steigernde Liganden wie Acetylcholin, Histamin, Serotonin, ATP, Thrombin, Bradykinin und Substanz P dilatativ. Die ersten fünf haben eine gegenteilige Wirkung an der glatten Muskulatur, die bei intaktem Endothel aber von der NO-vermittelten Wirkung überwogen wird.[22]
Ein bedeutender Stimulus für die NO-Synthese ist die detektierte Schubspannung über dem Endothel, die unter Annahme gleichbleibender Stromstärke bei laminarer Strömung umgekehrt proportional zur dritten Potenz des Gefäßradius ist. Wenn der Blutstrom in nachgeschalteten Gefäßabschnitten durch lokale Mechanismen gesteigert wird, bewirkt die gesteigerte Schubspannung eine aszendierende Dilatation der Arteriolen und kleinen Arterien. Dieser Mechanismus unterstützt die bedarfsgerechte Blutversorgung bei lokal gesteigerter Stoffwechselaktivität, da die lokal-metabolischen Effekte nicht bis zu den zuführenden Gefäßen reichen.[23]
Endothelin-1 stimuliert zum einen die Freisetzung von NO, zum anderen wirkt es lokal direkt auf die Gefäßmuskulatur, dann aber konstriktiv. Es wird vom Endothel nach Stimulation durch Angiotensin II und ADH freigesetzt.
Lymphsystem
Das Lymphsystem dient dazu, Wasser und darin gelöste Stoffe aus dem Körpergewebe wieder dem Blutkreislauf zuzuführen. In Umgebung der Kapillaren findet ein Flüssigkeitsaustausch zwischen Blut und Gewebe statt, angetrieben vom effektiven Filtrationsdruck, der sich aus den Differenzen der hydrostatischen und kolloidosmotischen Drücken auf beiden Seiten ergibt. Während im arteriellen Schenkel der Kapillaren der Flüssigkeitsausstrom überwiegt, wechselt der effektive Filtrationsdruck mit Abnahme des Blutdrucks hin zu den postkapillären Venolen das Vorzeichen, sodass ein großer Teil der Flüssigkeit wieder in die Blutgefäße zurückkehrt. Da dieser Prozess aber nicht hundertprozentig effektiv ist, sammeln Lymphgefäße die restliche Flüssigkeit, jetzt Lymphe genannt, und führen sie den Venen in der Nähe des Herzens wieder zu. Auf dem Weg dorthin fließt die Lymphe durch die Lymphknoten, in denen sie gefiltert und dem Immunsystem präsentiert wird. Die Filtrationsbilanz hängt auch vom Tonus der Widerstandsgefäße ab: Vasokonstriktion senkt den Filtrationsdruck und stellt damit auch einen mittelfristigen Mechanismus zur Erhöhung des Plasmavolumens dar.
Der Blutkreislauf vor und nach der Geburt
Entwicklung beim Embryo
Der Blutkreislauf ist eines der am frühesten angelegten Organsysteme des Embryos. Die Blutgefäße entwickeln sich, vom Dottersack ausgehend, aus sogenannten „Blutinseln“ im embryonalen Bindegewebe. Durch die Verschmelzung der beiden Endokardschläuche am Kopfende des Embryos, verschiedene Krümmungsvorgänge und Bildung von Scheidewänden entsteht daraus das Herz mit seinen beiden Vorhöfen und den Herzkammern. Das Herz gelangt erst mit dem Längenwachstum des Embryos in seine definitive Lage in der Brusthöhle.
In der Frühphase der Entwicklung des Blutkreislaufes gibt es im vorderen Bereich des Embryos zunächst vier Aorten, zwei rückenseitige (dorsale Aorten) und zwei bauchseitige (ventrale Aorten). Die dorsalen Aorten besitzen pro embryonalen Körpersegment jeweils Abgänge nach dorsal (rückenwärts) und ventral (bauchwärts), im Bereich der Urniere auch nach lateral (seitlich), die als Segmentarterien bezeichnet werden. Die Dorso- und Ventralaorten sind im Bereich der Kiemenbogen untereinander durch die sechs Kiemenbogenarterienpaare miteinander verbunden.
Nun finden im vorderen Embryonalbereich komplexe Umbildungen statt. Die ersten fünf lateralen Segmentarterien sowie die erste, zweite und fünfte Kiemenbogenarterie verschließen sich beidseitig, die dorsalen Aorten zwischen viertem und fünftem Kiemenbogen. Der Vorderabschnitt der ventralen Aorten wird damit zur definitiven äußeren Halsschlagader (Arteria carotis externa), aus der dritten Kiemenbogenarterie und dem Vorderabschnitt der dorsalen Aorten beidseitig die innere Halsschlagader (Arteria carotis interna).
Die rechte dorsale Aorta verschließt sich hinter der sechsten lateralen Segmentarterie und wird zusammen mit der vierten rechten Kiemenbogenarterie zur späteren rechten Schlüsselbeinarterie (Arteria subclavia dextra). Die linke Schlüsselbeinarterie entsteht dagegen nur aus der sechsten lateralen Segmentarterie.
Die vierte linke Kiemenbogenarterie entwickelt sich zum Aortenbogen (Arcus aortae), die definitive Aorta entsteht aus dessen Fortsetzung in die linke ventrale Aorta. Der Anfangsabschnitt der rechten ventralen Aorta bildet sich zum Arm-Kopf-Stamm (Truncus brachiocephalicus) um.
Die beiden sechsten Kiemenbogenarterien wachsen in die Lungenanlage ein und werden zu den Lungenarterien (Arteriae pulmonales). Rechts verliert sie ihre Verbindung zur ventralen Aorta, aus ihrem Anfangsabschnitt entsteht der Lungenstamm (Truncus pulmonalis). Die sechste linke Kiemenbogenarterie erhält jedoch ihre Verbindung zur linken ventralen, also definitiven Aorta bei. Sie bildet damit eine Kurzschlussverbindung zwischen Lungen- und Körperkreislauf, den Ductus arteriosus (Ductus Botalli). Durch die Bildung eines spiraligen Septums (Septum aorticopulmonale) im Ursprung des unpaarigen Anfangsabschnitts der dorsalen Aorten erhält die definitive Aorta Anschluss an die linke Herzkammer, der Truncus pulmonalis an die rechte Herzkammer. Diese sehr komplizierten Umbauvorgänge des Herzens und der herznahen Arterien führen gelegentlich zu Missbildungen (z. B. Fallot-Trilogie, Fallot-Tetralogie, Fallot-Pentalogie).
Die ursprünglichen ventralen Segmentarterien der nun definitiven Aorta bilden sich bis auf drei unpaare Hauptstämme (Truncus coeliacus, Arteria mesenterica superior und Arteria mesenterica inferior) in der Bauchhöhle zurück. Die lateralen Segmentarterien werden zu den Nieren- (Arteria renalis) und Keimdrüsenarterien (Arteria testicularis bzw. Arteria ovarica). Lediglich die dorsalen Segmentarterien behalten ihr ursprüngliches segmentales Abgangsverhalten und bilden die Zwischenrippenarterien (Arteriae intercostales superiores) bzw. Lendenarterien (Arteriae lumbales).
Blutkreislauf beim Fötus
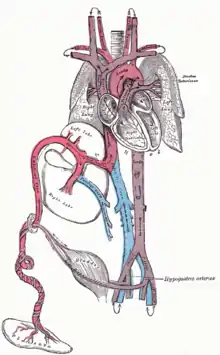
Etwa ab dem 21. Tag nach der Konzeption (ca. 35. Tag nach dem ersten Tag der letzten Regelblutung – gynäkologische Schwangerschaftsrechnung) beginnt das Herz des Embryos zu schlagen, in den folgenden Wochen wird auch die Lunge angelegt. Da die Lungen des Fötus im Mutterleib noch funktionslos sind, bezieht der Föt sein sauerstoffreiches Blut über die Nabelschnur aus der Plazenta. Das sauerstoffreiche Blut gelangt aus der Nabelvene in der Nabelschnur über den Ductus venosus in die untere Hohlvene und umgeht damit zum Großteil die Leber, ein kleinerer Teil versorgt über die Pfortader die Leber mit sauerstoffreichem Blut. Dann gelangt es durch die untere Hohlvene in den rechten Vorhof. Schon in der Hohlvene mischt es sich mit dem sauerstoffarmen Blut aus dem Körperkreislauf und wird zu Mischblut. Ein Teil strömt durch das Foramen ovale in den linken Vorhof, wird in die linke Herzkammer gepumpt und verlässt das Herz durch die Aorta, um zuerst das Gehirn, das am empfindlichsten auf Sauerstoffmangel reagiert, und den oberen Teil des Körpers zu versorgen. Aus der rechten Kammer gelangt das übrige Blut in den Truncus pulmonalis, ein Teil (etwa ein Drittel) wird in die noch nicht entfalteten Lungen gepumpt. Durch die geringe Sauerstoffversorgung der Lunge sind die Lungengefäße verengt, was den Fließwiderstand erhöht. Die restlichen zwei Drittel des sauerstoffangereicherten Blutes gelangen vom Truncus pulmonalis noch vor der Lunge über den Ductus arteriosus in die Aorta (Rechts-links-Shunt) hinter den Abgängen zum Gehirn und umgehen damit ebenfalls den Lungenkreislauf. Dieses Mischblut versorgt den unteren Teil des Körpers, bis der größte Teil über die von den inneren Beckenarterien abgehenden Nabelarterien wieder in die Plazenta fließt, wo er mit Sauerstoff angereichert wird.
Umbildungen nach der Geburt
Bei der Geburt endet die Versorgung durch die Plazenta. Dies lässt den Kohlendioxidgehalt im Blut ansteigen, was durch Chemorezeptoren einen starken Anreiz zum Atmen erzeugt. Durch das Heben des Brustkorbs sinkt der Druck innerhalb des Brustkorbes. Dies führt zum Leersaugen von Plazenta und Nabelvene und zur Entfaltung der Lungen. Da diese nun das Blut mit Sauerstoff anreichern, weiten sich die Gefäße in der Lunge, was den Gefäßwiderstand reduziert. Deshalb gelangt mehr Blut in die Lungen, die Flussrichtung im Ductus arteriosus kehrt sich um. Bis zu dessen Schließung wird die Lunge noch kurze Zeit mit Aortenblut versorgt. Nach dem Verschluss wird der Ductus arteriosus zum Ligamentum arteriosum. Während die Blutmenge im rechten Vorhof durch den Wegfall des Zuflusses aus der Plazenta abnimmt, steigt sie im linken Vorhof durch die Versorgung der Lunge. Das resultierende Druckgefälle und die Verringerung gefäßverengender Prostaglandine führen dazu, dass sich das Foramen ovale ebenfalls innerhalb der ersten beiden Wochen nach der Geburt verschließt. Ebenso verschließt sich der Ductus venosus.
Bleiben diese Anpassungen aus, kann es zu einer persistierenden fetalen Zirkulation kommen.
Krankheiten des Kreislaufsystems
Herz-Kreislauf-Erkrankungen (auch kardiovaskuläre Erkrankungen genannt) führen heute in den Industrienationen die Todesursachenstatistik mit Abstand an. In Deutschland wird mit leicht abfallender Tendenz knapp die Hälfte aller Todesfälle auf Krankheiten des Kreislaufsystems zurückgeführt.
Während bei Kindern und jungen Erwachsenen Herz-Kreislauf-Erkrankungen selten sind und dabei die angeborenen Herzfehler im Vordergrund stehen, führt hauptsächlich die mit dem Alter zunehmende Arteriosklerose zu einem altersabhängigen Anstieg der Prävalenz für Herzinfarkte, Schlaganfälle und andere Durchblutungsstörungen. Unter den Herzerkrankungen (vgl. Kardiologie) sind Durchblutungsstörungen des Herzmuskels (Koronare Herzkrankheit) und Herzklappenfehler am häufigsten anzutreffen, bei den Gefäßerkrankungen (vgl. Angiologie) sind es die arterielle Verschlusskrankheit (AVK) der Arterien und das Krampfaderleiden (Varikose) sowie die Thrombose bei den Venen. Der Bluthochdruck (arterielle Hypertonie) gehört zu den häufigsten chronischen Erkrankungen. Er ist die zweithäufigste Diagnose bei Hausärzten und gilt als bedeutsamster Risikofaktor für Herz-Kreislauf- und Nierenerkrankungen. Zu den Infektionen des Kreislaufsystems[24] gehören die Sepsis und katheterassoziierte Infektionen.
Bei Störungen des Lungenkreislaufs kann sich eine pulmonale Hypertonie, ein Bluthochdruck beschränkt auf den Lungenkreislauf, entwickeln.
Kommt es zu einem Herzinfarkt, vernarbt im Anschluss das abgestorbene Herzmuskelgewebe. Dieses Narbengewebe weist andere mechanische Eigenschaften auf als das umgebende Muskelgewebe. Das umgebende Muskelgewebe passt sich den mechanischen Eigenschaften des Narbengewebes an, was zum einen die Leistungsfähigkeit des Herzmuskelgewebes in der Umgebung der Narbe weiter beeinträchtigt und zum anderen zu weiteren Infarkten führen kann. Beide Faktoren können die Leistung des Herzmuskels immer weiter reduzieren, bis es zu einer Herzinsuffizienz kommt, wodurch es zu einem Versagen des Kreislaufsystems (bis hin zum Kreislaufstillstand) kommen kann.
Literatur
- Charles Reginald Schiller Harris: The heart and the vascular system in ancient Greek medicine from Alcmaeon to Galen. Oxford 1973.
- J. R. Levick: Physiologie des Herz-Kreislauf-Systems. Barth, Heidelberg u. a. 1998, ISBN 3-8252-8129-9 (UTB 8129).
- Herbert Reindell, Helmut Klepzig: Krankheiten des Herzens und der Gefäße. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 450–598.
- F. Reubi: Die Geschichte des Kreislaufs. In: Schweizerische Medizinische Wochenschrift. Band 115, 1985, S. 944–949.
- Stefan Silbernagl, Agamemnon Despopoulos: Taschenatlas der Physiologie. Thieme, Stuttgart 2003, ISBN 3-13-567706-0.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, Kapitel 28 Kreislauf.
- G. Whitteridge: William Harvey and the Circulation of the Blood. London / New York 1971.
Einzelnachweise
- Axel W. Bauer: Kardiovaskuläre Erkrankungen. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 722.
- Corpus Hippocraticum: De corde.
- Karlhans Abel: Die Lehre vom Blutkreislauf im Corpus Hippocraticum. In: Hermes. Band 86, 1958, S. 192–219.
- Gotthard Strohmaier: Avicenna. Beck, München 1999, ISBN 3-406-41946-1, S. 118 f.
- Michael Servetus Research. Manuskript von Paris, ein Entwurf für Christianismi Wiedereinsetzung
- Im Jahre 1546 war es nur ein Manuskript. Miguel veröffentlichte dieses im Jahre 1553 in Christianismi Restitutio (restitutio = Wiedereinsetzung). Während seiner Hinrichtung als Häretiker wurden auch fast alle seine Bücher verbrannt; nur drei Exemplare überlebten.
- Barbara I. Tshisuaka: Blutkreislauf. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 194 f.
- Richard Toellner: Zum Begriff der Autorität in der Medizin der Renaissance. In: Rudolf Schmitz, Gundolf Keil (Hrsg.): Humanismus und Medizin., Weinheim 1984 (= Deutsche Forschungsgemeinschaft: Mitteilungen der Kommission für Humanismusforschung. Band 11), ISBN 3-527-17011-1, S. 159–179, hier: S. 177.
- Gesetz von Hagen-Poiseuille#Eingeschränkte Gültigkeit im Blut
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 581.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 621.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 582.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 583.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 584.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 552.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 579.
- Hans-Christian Pape, Armin Kurtz, Stefan Silbernagl (Hrsg.): Physiologie. 7. Auflage. Georg Thieme Verlag, Stuttgart 2014, ISBN 978-3-13-796007-2, S. 220.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 588, 768.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 594.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 597.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 773.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 597, 601, 602.
- Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 602, 607.
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 36–60.