Lungenkreislauf
Als Lungenkreislauf oder kleiner Kreislauf wird der Teil des Blutkreislaufs bezeichnet, der das Blut vom Herzen zur Lunge bringt und wieder zurückführt.
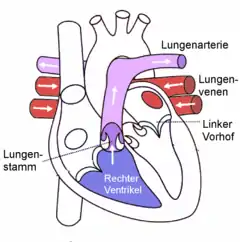
Das sauerstoffarme Blut wird vom rechten Ventrikel (Herzkammer) über den Lungenstamm (Truncus pulmonalis) abgeführt. Dieser Stamm teilt sich in die rechte und linke Lungenarterie (Arteria pulmonalis). Diese verzweigen sich in der jeweiligen Lunge in immer feinere Gefäße und gehen schließlich in die Haargefäße (Kapillare) über, welche die Lungenbläschen (Alveolen) umspannen. Dort erfolgt der Gasaustausch, d. h. das Blut gibt Kohlenstoffdioxid (CO2) ab und nimmt Sauerstoff (O2) auf (durch Diffusion).
Das nun sauerstoffreiche Blut fließt über sich vereinende und zunehmend größer werdende Venen wieder zurück zum Herzen. Dort münden zwei rechte Lungenvenen (Venae pulmonales dextrae) und zwei linke (Venae pulmonales sinistrae) über einen Venenhauptstamm (Vena pulmonalis) in den linken Vorhof (Atrium cordis sinistrum).
Da die Lungenarterien sauerstoffarmes Blut transportieren, wird die Lunge selbst hauptsächlich in einem Bronchialkreislauf durch die Bronchialarterien mit sauerstoffreichem Blut versorgt; bei diesen Bronchialarterien handelt es sich um Abgänge der Aorta.
Beim Fötus besteht vom Truncus pulmonalis eine Verbindung zur Aorta, der Ductus arteriosus. Ebenso existiert eine Öffnung zwischen rechtem und linkem Herzvorhof, das Foramen ovale. Diese beiden Bildungen schließen den Lungenkreislauf weitgehend kurz, die Lunge wird beim Fötus ja noch nicht belüftet.
Zur mit Ibn an-Nafīs (al-Quraschi) im 13. Jahrhundert beginnenden Entdeckungsgeschichte des Lungenkreislaufs siehe Blutkreislauf des Menschen und der Säugetiere#Forschungsgeschichte.
Lungenkreislauf im Überblick
- Transport von „sauerstoffarmem“ Blut
- Transport von „sauerstoffreichem“ Blut
rechter Vorhof → Trikuspidalklappe → rechte Herzkammer → Pulmonalklappe → Lungenarterien → Kapillargebiet der Lungenbläschen → Lungenvenen → linker Vorhof → Mitralklappe → linke Herzkammer
Pulmonalvaskulärer Widerstand (PVR)
Der pulmonalvaskuläre Widerstand (der Widerstand der Lungengefäße) wird nach dem Gesetz von Hagen-Poiseuille definiert als das Verhältnis der Druckdifferenz zwischen A. pulmonalis und linkem Atrium zum pulmonalen Blutfluss. Der pulmonalvaskuläre Widerstand (PVR) der Lungenstrombahn ist beim Gesunden in etwa nur 1/10 so groß wie der totale periphere Widerstand des Körperkreislaufes (Norm: 45-120 dyn × sec × cm−5 = 0,56-0,94 mmHg × min/l[1]). Deswegen ist der arterielle Blutdruck im Lungenkreislauf mit 20/8 mmHg deutlich niedriger als im großen Kreislauf (120/80 mmHg).
Dieser pulmonalvaskuläre Widerstand kann auch in R units (resistance units) gemessen werden; diese Einheit wird nach ihrem Erstbeschreiber Wood auch als Wood-Einheit bezeichnet. Diese übliche Wood-Einheit (resistance unit) ist also 1 RU = 1 mmHg/(l/min) = 1 mmHgmin/l. Diese Wood-Einheiten können durch Multiplikation mit dem Faktor 8 × 106 in metrische Widerstandseinheiten (Pa × s × m−3) im Internationalen Einheitensystem (SI) umgerechnet werden. Die Wood-Einheiten werden in der pädiatrischen Kardiologie angewendet und häufig auf die Körperoberfläche des Kindes bezogen. Diese Division durch die Körperoberfläche führt zu einer Normierung der Resistance auf eine Standardkörperoberfläche von einem Quadratmeter. Aus der Einheit mmHgmin/l wird die Einheit mmHgmin/lm². In der Inneren Medizin werden meist die metrischen SI-Einheiten angegeben. Mit dem Schweregrad der pulmonalvaskulären Veränderungen steigt der pulmonalvaskuläre Widerstand.
Pathophysiologie
Ein Abfall der O2-Konzentration in den Alveolen (= Hypoxie) führt zu einer Vasokonstriktion der Lungenarterien in den entsprechenden Lungenabschnitten und somit zu einer Erhöhung des PVR. Dieser Mechanismus wird als pulmonale hypoxische Vasokonstriktion oder Euler-Liljestrand-Mechanismus bezeichnet. Er dient dazu, die Durchblutung in schlecht belüfteten Lungenabschnitten zu vermindern und so den pulmonalen Blutfluss in besser belüftete Lungengebiete umzuleiten. Dadurch nimmt der Anteil des Blutes ab, welches zwar durch die Lunge fließt dort aber nicht mit Sauerstoff beladen (oxygeniert) wird (Reduktion des Shuntvolumens). Die neuronale Regulation der Lungenstrombahn ist nur von geringer Bedeutung. Der PVR unterliegt somit nur einer geringen sympathischen (= Vasokonstriktion) und parasympathischen Regulation.
Bei einer Einengung der Lungenstrombahn (etwa durch Pulmonalsklerose, Lungenembolie, entzündliche Verengung der Lungenvene, Lungenparenchymzerstörung, pleurale Verschwartungen oder Engerstellung der Lungenarteriolen) kann es durch die Druckerhöhung im kleinen Kreislauf zur pulmonalen Hypertonie kommen.[2]
Literatur
- Peter Lotz: Anatomie und Physiologie des Respirationstrakts. In: Jürgen Kilian, Herbert Benzer, F. W. Ahnefeld (Hrsg.): Grundzüge der Beatmung. Springer, Berlin u. a. 1991, ISBN 3-540-53078-9, 2., unveränderte Auflage, ebenda 1994, ISBN 3-540-57904-4, S. 3–45, hier: S. 35–43.
Einzelnachweise
- Mewis, Riessen, Spyridopoulos (Hrsg.): Kardiologie compact - Alles für Station und Facharztprüfung. 2. Auflage. Thieme, Stuttgart, New York 2006, ISBN 3-13-130742-0, S. 110.
- Herbert Reindell, Helmut Klepzig: Krankheiten des Herzens und der Gefäße. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 450–598, hier: S. 578–580 (Die Hypertonie im großen und kleinen Kreislauf).