Blaumeise
Die Blaumeise (Cyanistes caeruleus, Syn.: Parus caeruleus) ist eine Vogelart der Gattung Cyanistes aus der Familie Meisen (Paridae). Der Kleinvogel ist mit seinem blau-gelben Gefieder einfach zu bestimmen und in Mitteleuropa sehr häufig anzutreffen. Bevorzugte Lebensräume sind Laub- und Mischwälder mit hohem Eichenanteil; die Blaumeise ist auch häufig in Parkanlagen und Gärten zu finden. Außer in Europa kommt sie in einigen angrenzenden Gebieten Asiens vor, in Nordafrika und auf den Kanarischen Inseln. Die Population der Kanaren wird oft auch als eigene Art angesehen (Afrikanische Blaumeise, Cyanistes teneriffae).
| Blaumeise | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Blaumeise (Cyanistes caeruleus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Cyanistes caeruleus | ||||||||||||
| (Linnaeus, 1758) |
Die Blaumeise bevorzugt tierische Nahrung, vor allem Insekten und Spinnen. Außerhalb der Fortpflanzungsperiode steigt die Bedeutung von Sämereien und anderer pflanzlicher Kost. Beim Nahrungserwerb fällt die Blaumeise durch ihre Geschicklichkeit auf, sie kann sich an die äußersten Zweige klammern und auch kopfüber hängend nach Nahrung suchen.
Blaumeisen brüten meist in Baumhöhlen, auch Nistkästen werden häufig angenommen. Der Hauptkonkurrent um Bruthöhlen und bei der Nahrungssuche ist die deutlich größere Kohlmeise.
Aussehen und Merkmale
Die Blaumeise ist mit einer Körperlänge von knapp zwölf Zentimetern deutlich kleiner als die Kohlmeise. Die hellblauen Gefiederpartien am Kopf und auf der Oberseite treten in Mitteleuropa bei keinem anderen Singvogel auf und erlauben so eine einfache Bestimmung. Der dunkel hornbraune Schnabel ist verglichen mit dem verwandter Arten kurz und hoch. Die Iris ist braun, die Füße sind dunkel blaugrau, die Krallen grau.[1]

Federkleid und Mauser
Im Kopfbereich zeigt das Gefieder der Blaumeise ein sehr typisches Muster, das durch das Fehlen schwarzer Gefiederpartien weniger kontrastreich wirkt als bei den Schwesterarten. Die vom Schnabelansatz bis zum vorderen Augenwinkel weiße Stirn geht oben in die charakteristische hellblaue Kopfplatte über. Die Federn im Scheitelbereich können zu einer niedrigen, stumpfen Haube aufgestellt werden. Vom Schnabelansatz zieht ein schmaler, schwarzer Augenstreif bis zum dunkelblauen Nackenband, der von der hellblauen Kopfplatte durch einen weißen Streifen abgegrenzt ist. Die ebenfalls weißen Wangen sind vorn durch einen schwarzen Kehlfleck und brustwärts durch einen schwarzblauen Halsring begrenzt.

Rücken und Schultern sind dumpf grünlich, wobei der Farbton zwischen einzelnen Populationen variiert. Der Bürzel ist graublau und geht fließend in die Oberschwanzdecken über. Die hellblauen Steuerfedern sind am Kiel in der Regel sehr dunkel und haben teilweise einen weißen Saum oder Rand. Brust, Flanken und Bauchseiten sind leuchtend gelb, die Intensität der Färbung kann individuell sehr stark variieren. In der Mitte der Unterseite des Rumpfes befindet sich ein schwarzer Längsstrich, der jedoch teilweise auch von den umliegenden Federn verdeckt sein kann. Die Flügel sind oberseits blau mit einer weißen Flügelbinde, die einzelnen Schwungfedern sind mehrfarbig. Andersfarbige Blaumeisen sind äußerst selten.[2]

Daneben weist das Gefieder eine sehr ausgeprägte, für das menschliche Auge nicht sichtbare Musterung im ultravioletten Bereich auf. Diese Farbvariationen spielen bei der Partnerwahl offensichtlich eine Rolle. Mittlerweile wurde auch bei vielen anderen Vogelarten nachgewiesen, dass ultraviolettes Licht wahrgenommen werden kann und bei solchen Arten auch das Gefieder ein Reflexionsmaximum im ultravioletten Bereich aufweist. Dabei hat sich aber als Besonderheit herausgestellt, dass die Blaumeisen eine Art „chiffrierten“ Sexualdimorphismus zeigen, denn im ultravioletten Spektrum des Lichts sind die Geschlechter im Gegensatz zum sichtbaren Bereich deutlich zu unterscheiden.[3]
Jungvögel sind bis in den Herbst ihres ersten Kalenderjahres an der blassgelben Färbung im Kopfbereich zu erkennen, da der Wechsel des Kopfgefieders erst am Ende der Jugendmauser einsetzt, die von Mitte Juli bis Ende Oktober des Schlupfjahres stattfindet. Auch nach der Jugendmauser sind sie am deutlichen Farbunterschied zwischen den in der Mauser erneuerten Arm- und den erhalten bleibenden Handdecken von den Altvögeln zu unterschieden. Die neuen Armdecken zeigen dabei die typische Blaufärbung, die Handdecken sind mehr grünlich.[1][4]
Die Jahresmauser der Altvögel ist eine postnuptiale („nach der Hochzeit stattfindende“) Vollmauser und setzt im Mittel sechs Wochen vor der Mauser der Jungvögel ein. Der Anfang der Mauser fällt meist noch in die Phase der Jungenaufzucht. Der gesamte Wechsel nimmt 115 bis 120 Tage in Anspruch, was für einen Vogel dieser Größe ungewöhnlich lange ist. Das Mauserschema gleicht dem der meisten anderen Sperlingsvögel.[5]
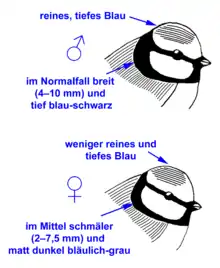
Geschlechtsbestimmung
Ein geringer Geschlechtsdimorphismus ist in einigen Merkmalen vorhanden, dadurch lassen sich jedoch nicht alle Individuen eindeutig zuordnen. Die hilfreichsten Gefiedermerkmale zur Geschlechtsunterscheidung sind die Breite und Färbung des Halsbandes und die Farbintensität der blauen Kopfplatte (siehe nebenstehende Abbildung). Zudem hat das Männchen mehr Weiß an Stirn, Flügelbinde und Steuerfedern.
Bei den Unterarten der teneriffae-Gruppe (siehe Systematik) sind die Unterschiede zwischen Männchen und Weibchen deutlich geringer und die Geschlechter äußerlich kaum zu unterscheiden.[1][2]
Maße und Gewicht
Im Mittel sind Männchen größer als Weibchen, es gibt jedoch einen Überlappungsbereich. Zwischen den verschiedenen Unterarten bestehen teilweise beträchtliche Größenunterschiede, was sich beim Vergleich der Flügellängen zeigt. Die Vögel aus West-, Mittel- und Nordeuropa sind im Mittel größer als ihre mediterranen Verwandten. Auch innerhalb der Nominatform nimmt die Flügellänge von Nordosten nach Südwesten ab. In Richtung Südosten besteht wiederum eine Tendenz zu längeren Flügeln, vor allem bei den Unterarten im Mittleren Osten. Bei der Nominatform liegt die Flügellänge der Männchen zwischen 65 und 71 Millimetern, die der Weibchen zwischen 62 und 67 Millimetern. Die Schwanzlänge beträgt im Mittel 51,5 Millimeter beim Männchen, beim Weibchen 49,6 Millimeter.[2]
Im Durchschnitt sind Männchen schwerer als Weibchen. Das Gewicht der Blaumeisen unterliegt dabei starken jahreszeitlichen Schwankungen, sein Maximum erreicht es im Frühwinter, bei Weibchen kurz vor der Eiablage, nur zu dieser Zeit sind sie schwerer als Männchen. Bei ausreichendem Nahrungsangebot ist das Gewicht in strengen Wintern am höchsten. Tiere aus Skandinavien wiegen mehr als mitteleuropäische, in Finnland wurden im Mittel 12,1 Gramm für Männchen und 11,4 Gramm für Weibchen gemessen, in Ostdeutschland waren es 11,5 bzw. 11,0 Gramm.[1][2]
Stimme
Der typische Reviergesang der Blaumeise beginnt mit zwei bis drei hohen, bei einer Frequenz von etwa 8 kHz liegenden, sehr ähnlichen Lauten, die meist mit „zizi“ oder „zizizi“ transkribiert werden. Diesen folgt ein Triller in etwas tieferer Tonlage, der aus 5 bis 15, in Ausnahmefällen sogar bis zu 25 kürzeren Elementen besteht. Diese Strophenteile sind im Vergleich zu denen anderer Meisen ziemlich gleichförmig. Allerdings existiert auch eine Strophenform, die mit dem Gesang der Kohlmeise verwechselt werden kann. Zwischen der Einleitung und dem Triller wird gelegentlich noch ein aus wenigen, aber sehr variablen Elementen bestehender Mittelteil eingeschaltet. Manchmal werden diese aus zwei oder drei Phrasen bestehenden Strophen unmittelbar aneinandergereiht, die abschließende Lautreihe wird dann oft verkürzt.
Ein Männchen verfügt über drei bis acht verschiedene derartige Strophentypen. Auch bei Weibchen tritt gelegentlich Reviergesang auf, etwa wenn sie in territoriale Auseinandersetzungen verwickelt werden. Der typische Triller am Ende der Strophe kommt bei den Vögeln im Mittelmeerraum seltener vor. Dies hängt offensichtlich damit zusammen, dass dort im Gegensatz zu Nord- und Mitteleuropa keine so starke Konkurrenz mit der Kohlmeise besteht. Bei den nördlicheren Blaumeisen scheint der Triller erforderlich, um den Gesang von der Kohlmeise abzugrenzen, denn es konnte experimentell gezeigt werden, dass Kohlmeisen auf Blaumeisengesang ohne Triller gleich stark reagieren wie auf arteigenen Gesang.[6] Der Reviergesang der afrikanischen Blaumeisen unterscheidet sich weiterhin sehr stark von der Nominatform. Er enthält keine phrasierten Strophen, dafür aber mehr variable Elemente. Der Gesang weicht so stark ab, dass mitteleuropäische Blaumeisen auf Strophen der Vertreter aus Teneriffa nicht reagieren.
Bei den Rufen der Blaumeise sind zwei verschiedene Typen von Alarmrufen sehr bedeutend, die klar unterschieden werden können. Der Alarm bei fliegenden Beutegreifern ist ein sehr hohes, lang gezogenes „ii“. Dieser Alarmruf ist dem in einer vergleichbaren Situation von anderen Singvögeln geäußerten Warnruf sehr ähnlich und wird auch artübergreifend verstanden. Ein anderer wichtiger Ruf der Blaumeisen, die so genannte Zeterstrophe, ist bei starker Erregung, bei territorialen Auseinandersetzungen, beim Annähern von Bodenfeinden und beim Hassen auf sitzende Greifvögel zu hören. Dieser zweite Alarmlaut zeigt keine so starke interspezifische Übereinstimmung, wird jedoch vermutlich auch von anderen Arten richtig gedeutet.[2][7]
Verbreitung, Lebensraum und Wanderungen
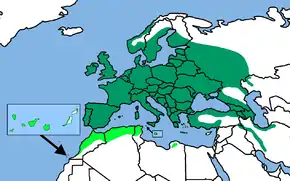
dunkelgrün: caeruleus-Gruppe
hellgrün: teneriffae-Gruppe
Verbreitung
Das Verbreitungsgebiet der Blaumeise ist bis auf zwei kleine Bereiche im Norden und Süden des Iran auf die Westpaläarktis beschränkt. Europa ist außer im Norden weitgehend flächendeckend besiedelt. Verbreitungslücken bestehen in den Hochlagen der Alpen und vermutlich auch mancher Gebirge auf dem Balkan, wobei für Letztere vielerorts nur unzureichende Daten vorliegen.[8]
Die Blaumeise fehlt in Island sowie im nördlichen Teil Schottlands und auf vielen der vorgelagerten Inseln. Die Äußeren Hebriden wurden erst 1963 besiedelt. In Skandinavien beschränkt sich die Verbreitung auf die südlichen Landesteile und die Flachlandregionen, die Fjällhochlagen sind nicht besiedelt. Die Nordgrenze des Verbreitungsgebiets liegt in Norwegen ungefähr bei 67° nördlicher Breite, in Schweden reicht das geschlossene Brutgebiet in den Mischwäldern bis etwa 61°, im Küstengebiet in einem schmäler werdenden Streifen bis 65° nördlicher Breite. In Finnland reicht die Verbreitung nordwärts ebenfalls ungefähr bis zum 65. Breitengrad, im Verlauf des 20. Jahrhunderts hat die Blaumeise ihr Areal dort deutlich nach Norden erweitert. Von Südfinnland zieht sich die Nordgrenze des Areals südostwärts über Baschkirien bis zu den südlichen Ausläufern des Ural. Die Ostgrenze des Areals ist komplex und wahrscheinlich ständigen Änderungen unterworfen. Es ist denkbar, dass es zu einer wechselseitigen Abhängigkeit mit der Grenze des Verbreitungsgebiets der Lasurmeise kommt, die immer wieder nach Westen vorstößt.[8][9]
Im Süden besiedelt die Blaumeise neben dem Iran auch Kleinasien und Nordwestafrika einschließlich der Kanarischen Inseln. In Marokko reicht das Verbreitungsgebiet südlich bis zu den südlichen Ausläufern des Hohen Atlas, in Algerien bis zum Sahara-Atlas und in Tunesien bis auf die Höhe von Sfax. In Libyen existiert ein isoliertes Vorkommen in der nordwestlichen Kyrenaika. Ein Einbürgerungsversuch 1871 in Neuseeland blieb erfolglos.[10][11]
Lebensraum

Ihrer weiten Verbreitung entsprechend besiedeln Blaumeisen verschiedene Lebensräume. In Mitteleuropa werden in eichenreichen Laub- und Laubmischwäldern die höchsten Siedlungsdichten und Bruterfolge erreicht. Dabei sind die in Mitteleuropa sehr seltenen reinen Eichenwälder trotz ihrer geringen Flächenausdehnung sehr attraktiv. Wesentlich häufiger sind verschiedene Typen der Eichen-Hainbuchenmischwälder, die der Art ebenfalls sehr gute Lebensbedingungen bieten, wie auch Hartholzauen mit hohem Eichenanteil. Etwas ungünstiger sind Buchen- und Buchenmischwälder, die aber auch noch recht dicht besiedelt sind. In Nadelmischwäldern hängt die Anzahl der Blaumeisenreviere stark vom Vorhandensein einzelner Laubbäume ab. In reinen Nadelwäldern fehlt die Blaumeise oder besiedelt allenfalls die Waldränder. Sowohl in den Alpen ab der montanen Höhenstufe als auch an der Nordgrenze des Verbreitungsgebiets in Skandinavien werden Mischwälder mit vergleichsweise hohem Laubholzanteil weitgehend gemieden. Die Siedlungsdichte, für die ein Maximalwert von 1,85 Brutpaaren pro Hektar ermittelt wurde, ist weitgehend unabhängig von der Reviergröße, die zwischen 0,16 und 0,84 Hektar liegt. Bei hohen Siedlungsdichten grenzen die Reviere direkt aneinander.
Neben den Wäldern kommt die Blaumeise ebenfalls in der Nähe des Menschen vor, dabei werden unterschiedliche, auch stärker anthropogen beeinflusste Lebensräume besiedelt. Dazu zählen halboffene Kulturlandschaften mit eingestreuten Bäumen und Hecken, Streuobstwiesen sowie Grünanlagen. Vermutlich durch die Konkurrenz der Kohlmeise sind die Populationsdichten im Siedlungsraum aber weit geringer als in den Wäldern. Die Blaumeise benötigt dabei eine höhere Anzahl alter Bäume als die Kohlmeise, kann jedoch unregelmäßig verbreitete Beute effizienter nutzen.
Generell ist die Blaumeise ein Vogel des Flachlands, im Gebirge konzentrieren sich die Vorkommen weitgehend auf die Täler. Die Höhengrenze der Verbreitung ist dabei in isolierten Höhenzügen wesentlich tiefer als in geschlossenen Massiven: Im Harz liegt die Grenze bei 550 Metern, in den Alpen bei zwischen 1.300 und 1.700 Metern und in den Pyrenäen bei ungefähr 1.800 Metern, im Kaukasus bei 3.500 Metern. Beim Vergleich langzeitlicher Beobachtungsdaten zeigt sich vielfach eine Verschiebung der Höhengrenze nach oben, was auf die globale Erwärmung und die Lebensraumveränderungen durch das Waldsterben zurückzuführen sein dürfte.
Im Süden Europas sind die Lebensraumansprüche geringer. Ebenso in den tiefen Lagen des Verbreitungsgebiets im Mittleren Osten, wo die Blaumeisen auch in Nadelwäldern zu finden sind. Die Lebensräume der Populationen in Nordafrika unterscheiden sich größtenteils erheblich von denen mitteleuropäischer Vertreter. Besiedelt werden hier auch montane Nadelwälder, in denen Wacholder, Zypressen und Kiefern dominieren, zudem auch sehr trockene Habitate wie Palmenoasen am Nordrand der Sahara.
Die Kanarischen Inseln stellen einen weiteren Sonderfall dar, da die stark bevorzugten Eichen dort überhaupt nicht vorkommen. Dort profitiert die Blaumeise davon, dass keine andere Meisenart diesen atlantischen Archipel besiedelt hat. Diese fehlende Konkurrenz zeigt sich im Verhalten und in der Habitatwahl, dort zeigen Blaumeisen eine deutliche Nischenaufweitung. Zu den Lebensräumen zählen Palmenhaine, von Tamarisken gebildete Gehölze, montane Wälder der Kanarenkiefer und die immergrünen Lorbeerwälder der Inselnordseiten. Bruthöhlen finden sich im äußerst ariden Trockenbusch im Süden Teneriffas außerdem in den stammsukkulenten Sprossen der Kandelaber-Wolfsmilch.
Außerhalb der Fortpflanzungsperiode ist die Habitatspezifität generell deutlich herabgesetzt. Wenn günstige Nahrungsquellen vorhanden sind, suchen die Vögel sogar baumfreies Gelände wie Schilfröhricht, Weideflächen oder exponierte Küstenklippen auf.[12][13]
Wanderungen
Die Blaumeise ist innerhalb des Verbreitungsgebiets Standvogel oder auch Teilzieher, wobei die Dismigration recht stark ausgeprägt ist, vor allem bei Jungvögeln. Das Wander- und Zugverhalten kann innerhalb weniger Generationen wechseln. Auch zeigen die Individuen einer Population oft eine sehr unterschiedliche Zugbereitschaft.
Die Geburtsorttreue scheint relativ gering ausgeprägt, allerdings ist umstritten, ob die äußerst geringe Fangrate nestjung beringter Vögel am Geburtsort auf Dismigration oder hoher Mortalität beruht. Die Vögel dismigrieren ungerichtet, Weibchen entfernen sich durchschnittlich weiter vom Geburtsort als Männchen. Bei einer Untersuchung in Braunschweig wurde festgestellt, dass sich über 90 Prozent der Vögel in einer Entfernung von weniger als drei Kilometern von der Geburtsstätte ansiedeln, weiter als zehn Kilometer vom Geburtsort wurden 2,9 Prozent der Weibchen und 0,7 Prozent der Männchen angetroffen.[14]
In Mittel-, Ost- und Nordeuropa existieren sowohl Individuen, die langfristig im angestammten Brutgebiet verbleiben, als auch solche, die einige typische Merkmale von Zugvögeln zeigen; in Großbritannien sind die Vögel dagegen durchweg Standvögel. In den anderen Gebieten verläuft der schwach ausgeprägte Zug in Richtung Südwesten, er beginnt Ende August, wenn das Großgefieder weitestgehend vermausert ist, und erreicht ungefähr Ende September seinen Höhepunkt. Ein sehr schwach ausgeprägter Heimzug findet zwischen März und April statt. Die größten festgestellten Entfernungen bei den eigentlichen Zugbewegungen liegen bei 1500 Kilometern. Weibchen beteiligen sich häufiger am Zug, zudem vorwiegend jüngere und sozial niedrig stehende Vögel.
Invasionsartige Wanderungen, wie sie bei der Tannenmeise regelmäßig auftreten, kommen bei der Blaumeise wesentlich seltener und weniger ausgeprägt vor. Manchmal treten solche Wanderbewegungen mehrere Jahre hintereinander auf, andererseits können auch fast 20 Jahre zwischen derartigen Einflügen liegen. Als Ursache werden milde Winter mit sich anschließendem überdurchschnittlichen Bruterfolg vermutet.
Weiterhin finden auch räumlich enger begrenzte Vertikalwanderungen statt; die Vögel des Gebirges sind im Frühherbst teilweise in deutlich höheren Lagen anzutreffen als während der Brutzeit. Grund hierfür ist vermutlich das günstige herbstliche Nahrungsangebot dieses Lebensraums. Im Hochwinter lässt sich eine deutliche Talwanderung beobachten, allgemein sind die Blaumeisen im Winter häufiger im menschlichen Siedlungsraum anzutreffen, der durch künstliche Nahrungsquellen attraktiv zu sein scheint; inwieweit das für das Überleben der Vögel günstig ist, ist ungeklärt.
In Südeuropa und zudem bei allen Unterarten außer der Nominatform scheint das Wanderverhalten zumindest teilweise wesentlich geringer ausgeprägt zu sein.[15][16][17]
Nahrung und Nahrungserwerb

Die Ernährungsweise der Blaumeise gleicht prinzipiell der ihrer nahen Verwandten; in der Fortpflanzungsperiode und insbesondere während der Jungenaufzucht dominiert tierische Nahrung, vor allem verschiedene Insekten und Spinnen. Im Herbst- und Winterhalbjahr nimmt die Bedeutung der pflanzlichen Kost zu. Bei der Nahrungssuche ist die Blaumeise geschickter als alle näher verwandten Meisen, kann sich dabei an die äußersten Blätter und Zweige klammern, hängt häufiger kopfüber und setzt die Füße auf vielfältige Weise als Werkzeug ein. Der kurze Schnabel eignet sich besonders zum Hämmern und Spalten sowie zum Hervorholen kleiner Objekte[18][19] und Tiere.
Nahrungsspektrum der Altvögel
.jpg.webp)
Im gesamten Jahresverlauf macht der Anteil der tierischen Nahrung ungefähr 80 Prozent der Gesamtnahrung aus. Dabei überwiegen sehr kleine Beutetiere unter zwei Millimetern Länge. Neben den Schmetterlingen und deren Entwicklungsstadien sind Hemipteren – dabei insbesondere Blattläuse – eine ganzjährig wichtige Beute. Weiter finden sich in Nahrungsproben sehr regelmäßig verschiedene Vertreter der Hautflügler und Käfer. Für einen kurzen Zeitraum im Spätwinter spielen ebenfalls Larven von Fliegen und Mücken eine wichtige Rolle. Neben Insekten werden auch Spinnen regelmäßig gefressen.

Bei der pflanzlichen Nahrung spielen in Buchenwäldern die in manchen Jahren reichlich vorhandenen Bucheckern die Hauptrolle und können die Wintersterblichkeit entscheidend beeinflussen. Ansonsten werden andere Sämereien wie Eicheln und Edelkastanien verwertet, zudem Samen verschiedener Laub- und Nadelgehölze sowie einiger krautiger Pflanzen. Im Herbst tragen verschiedene Beeren und Obstsorten zum Erreichen des Höchstgewichts bis zum Frühwinter bei. Im Frühling fressen die Vögel häufig Blatt- und Blütenknospen, bevorzugen auch Pollen und Nektar, bei manchen Pflanzen kommen die Blaumeisen sogar als Bestäuber in Frage, wie beispielsweise bei der Kaiserkrone. Der im späteren Frühling häufige Besuch von Ahornblüten dürfte aber den ersten Stadien der zahlreichen Raupen verschiedener Blattwespen dienen. Wiederholt wurde beobachtet, dass Blaumeisen austretende Baumsäfte an Bruchstellen sowie an Ringelbäumen von Spechten lecken.

Außerdem fressen Blaumeisen insbesondere im Winterhalbjahr regelmäßig an künstlichen Futterstellen. Wenn vorhanden, werden diese auch in der Brutsaison genutzt. Auf besonderes Interesse stieß das Öffnen von Milchflaschen, das in den späten 1940er und den 1950er Jahren in England beobachtet wurde. Die Vögel hatten gelernt, die zu dieser Zeit dort üblichen Stanniolverschlüsse der Flaschen zu öffnen. Dies wird heute als echte Verhaltenstradition gewertet und leitet sich wohl vom Auswickeln in Blättern eingerollter Larven her. Die schnelle Ausbreitung dieser Fähigkeit unter den dortigen Artgenossen ist darauf zurückzuführen, dass Blaumeisen durch Beobachtung lernen können.
Das Nahrungsspektrum korreliert eng mit den jahreszeitlichen und zufälligen Schwankungen des Nahrungsangebots. Der Energiebedarf adulter Blaumeisen ist von der Umgebungstemperatur abhängig. Im Winter wurde bei Versuchen in Freivolieren ein winterlicher Tagesbedarf von 45,2 kJ festgestellt, unter Freilandbedingungen dürfte der Energieverbrauch höher sein. Der höchste Energieverbrauch tritt bei Eier produzierenden und brütenden Weibchen auf.[18][19][20]
Nestlingsnahrung
Die an die Nestlinge verfütterte Nahrung ist weit weniger variabel als die der Altvögel. Schmetterlinge und insbesondere deren Raupen bilden den Hauptbestandteil. Je nach Lebensraum und Verfügbarkeit dieser Insekten schwankt der Anteil zwischen 45 und 91 Prozent. Ist diese Nahrung wenig verfügbar, spielen Spinnen, Hautflügler und Käfer eine wichtige Rolle. In stark vom Menschen beeinflussten Lebensräumen werden auch bis zu 15 Prozent an künstlicher Nahrung bei der Aufzucht verwendet. Dabei werden allerdings nicht nur geeignete Nahrungsmittel, sondern auch die wegen der fehlenden Proteine und Vitamine schädlichen Bestandteile, wie etwa Brot und Pommes frites, von den Altvögeln verfüttert.[18][20]
Habitatwahl

Für die Nahrungssuche spielt unter den Gehölzen die Eiche ganzjährig eine wichtige Rolle, andere Laubbäume wie etwa Ulmen und Ahorne unterliegen stärkeren jahreszeitlichen Schwankungen in ihrer Bedeutung. Die interspezifische Beeinflussung der Habitatwahl wurde bei der Blaumeise intensiv untersucht, da mehrere andere Vogelarten in den Laubbäumen syntop vorkommen, das heißt im selben Biotop anzutreffen sind und eine ähnliche Ernährungsweise haben. Die geringe Körpermasse bestimmt dabei die ökologische Nische der Blaumeise, denn diese bevorzugt dünne Ästchen und Zweige, auch hoch oben im Baum. Die Präferenz dieses Mikrohabitats dürfte im Laufe der gemeinsamen Evolution mit ihren Konkurrenten entstanden sein, mittlerweile ist die körperliche Anpassung jedoch so weit fortgeschritten, dass eine direkte Konkurrenz zur Aufrechterhaltung dieser Einnischung nicht mehr zwingend erforderlich ist. Die Blaumeise besetzt in den Laubbäumen eine ähnliche ökologische Nische wie Tannenmeise und Wintergoldhähnchen in den Nadelbäumen und scheint dadurch wie diese einem höheren Risiko ausgesetzt zu sein, Beute von Greifvögeln zu werden. Generell ist die artspezifische Einnischung im Sommerhalbjahr deutlicher ausgeprägt als im Winter.
In einem Experiment wurde gezeigt, dass auch von Hand aufgezogene unerfahrene Blaumeisen Laubbäume Nadelgehölzen vorziehen, die Verhaltensweise scheint somit angeboren zu sein. Bei neueren Untersuchungen mit Jungmeisen, die eine Fehlprägung auf einen atypischen Lebensraum aufwiesen, wurde jedoch gezeigt, dass ebenso erfahrungsbedingte Komponenten bei der Habitatwahl eine wichtige Rolle spielten. Damit ist auch zu erklären, warum in Mischwäldern gelegentlich Blaumeisen anzutreffen sind, die in Nadelgehölzen intensiv nach Beute suchen.
Die Habitatwahl weicht bei denjenigen Blaumeisen ab, die in anderen als den in Mittel- und Westeuropa vorzufindenden Lebensräumen anzutreffen sind. In der Forschung haben die Vertreter der Kanarischen Inseln besondere Beachtung erfahren. Es konnte nachgewiesen werden, dass die Vögel aus Teneriffa anatomische Anpassungen insbesondere der Füße zeigen, die an die Nahrungssuche in Koniferen gut angepasst ist – beispielsweise ein längeres Laufbein.[18][19]
Fortpflanzung

Die Brutbiologie ist der am besten untersuchte Aspekt der allgemein sehr gut erforschten Art. Dabei ist zu beachten, dass meistens nistkastenbrütende Populationen untersucht wurden. Es ist umstritten, inwieweit so gewonnene Daten auf in Naturhöhlen brütende Vögel übertragbar sind. Während einige der auf diese Weise ermittelten Befunde sicherlich von der Art der Bruthöhle unabhängig sind, dürfte der Bruterfolg in den Nistkästen über dem in den Naturhöhlen liegen.[21]
Balz und Paarbildung
Wie die meisten Kleinvögel erreichen Blaumeisen die Geschlechtsreife noch vor Vollendung des ersten Lebensjahres. Einerseits wird berichtet, dass aus Spätbruten stammende Weibchen schon im Alter von zehn Monaten ihre ersten Eier legen, andererseits brüten zumindest in manchen Untersuchungsgebieten rund 30 Prozent der Einjährigen nicht.
Bereits ab Mitte Januar beginnt mit der Auflösung der gemischten Winterschwärme das Revierverhalten, und einige Männchen verdrängen schon potentielle Konkurrenten aus der Nähe eines von ihnen begleiteten Weibchens. Der zu dieser Zeit bereits einsetzende Reviergesang des Männchens richtet sich nicht nur an Konkurrenten, sondern auch an die Partnerin. Manche der Weibchen, die bei der Partnerwahl allgemein die aktiveren sind, sind noch bis in den März hinein unverpaart, wählen aber bis zum eigentlichen Brutbeginn noch einen Partner. Durch die gemeinsame Verteidigung des Brutreviers, bei der gelegentlich auch vom Weibchen Reviergesang zu hören ist, nimmt die Intensität der Paarbindung zu.
Das sich anschließende auffällige Ritual des „Höhlenzeigens“ dient der weiteren Verstärkung der Paarbindung und der sexuellen Stimulation. Eine praktische Bedeutung hat es vermutlich nicht, da das Weibchen sich ebenfalls schon länger im Revier aufhält und die Bruthöhlen ebenso kennt. Anders verhält es sich vermutlich beim in einer späteren Phase auftretenden Balzfüttern, dessen Intensität mitunter sehr hoch sein kann. Es ist anzunehmen, dass dies nicht nur der Paarbindung und der Überwindung der Individualdistanz dient, sondern auch für das Weibchen große energetische Bedeutung hat, da der Energiebedarf zur Zeit der Eibildung der höchste in seinem Lebenszyklus ist.
Bei den einige Tage vor der Ablage des ersten Eies beginnenden Kopulationen nähern sich die Partner allmählich mit zitternden Flügeln einander an. Dabei ist die Haltung der einer drohenden Blaumeise nicht unähnlich, Körper und Schwanz sind waagrecht, die Handschwingen leicht gespreizt. Vermutlich zur Beschwichtigung lassen die Vögel leise Kontaktlaute hören. Zur eigentlichen Kopulation fliegt das Männchen auf den Rücken des Weibchens und verweilt dort wenige Sekunden, ohne sich am Nacken festzuhalten. Nach der Trennung plustert sich das Weibchen auf und führt Putzbewegungen aus, das Männchen kann eine kurze Strophe des Reviergesangs von sich geben. Die Kopulationen können sich mehrfach wiederholen, wobei die ritualisierte Annäherung entfällt. Während der Eiablage und auch während der frühen Bebrütung finden weitere Kopulationen statt.
Nachdem man ursprünglich bei den meisten Meisenarten von saisonaler Monogamie ausgegangen war, konnte bei einer genetischen Untersuchung nachgewiesen werden, dass 20 Prozent der Männchen polygyn waren und 35 Prozent der Weibchen in derartigen Partnerschaften lebten. Daneben traten auch außerpartnerschaftliche Kopulationen auf. Trotz der Bewachung des Weibchens durch das revierhaltende Männchen waren rund 6 Prozent der Nestlinge auf Paarungen mit einem anderen als den revierhaltenden Partner zurückzuführen. In keinem Fall stammten aber alle Nestlinge einer Brut von einem fremden Partner.[21][22][23]
Neststandort und Nestbau

Blaumeisen bauen – wie alle Meisen – im Vergleich zu anderen Höhlenbrütern vergleichsweise aufwendige Nester, investieren beträchtliche Zeit in den Nestbau und begnügen sich nicht mit der Reinigung oder Auspolsterung. Bei der Wahl der Höhle sind die Blaumeisen recht flexibel, verwenden aber fast ausschließlich bereits vorhandene Höhlen, nur in sehr seltenen Fällen werden Fäulnishöhlen erweitert. Neben diesem vor allem verwendeten Höhlentyp werden auch Spechthöhlen unverändert übernommen. Eine Bevorzugung bestimmter Baumarten ist nicht erwiesen, obwohl dies in der Literatur häufig so dargestellt wird, aber bei den bisherigen Untersuchungen zu diesem Thema wurde die Verteilung der gewählten Höhlen nicht ausreichend dem Angebot eines bestimmten Lebensraums gegenübergestellt.[23]
Eine typische Blaumeisenhöhle liegt höher am Baum, hat eine kleinere Einflugöffnung und eine geringere Innentiefe als jene anderer Meisen. Dies wird auf interspezifische Konkurrenz zurückgeführt, insbesondere der Kohlmeise. Allerdings gibt es bei den verwendeten Bruthöhlen zwischen den Arten einen Überlappungsbereich, auch mit „Nicht-Meisen“ wie Trauerschnäpper, Kleiber, Star oder Feldsperling. Sehr selten kommen Nester in Bodenlöchern vor, es gibt auch einzelne Berichte über den Bau oder die Verwendung von freistehenden Nestern anderer Arten.

In stark vom Menschen beeinflussten Lebensräumen brüten viele Blaumeisen in künstlichen Nisthilfen. Die Präferenz bei den Nistkästen ist analog der bei den Naturhöhlen, es werden jene mit einer Einflugöffnung von 26 bis 28 Millimetern Durchmesser bevorzugt, die den Hauptkonkurrenten Kohlmeise ausschließen. Nicht so häufig wie Kohlmeisen, aber dennoch regelmäßig, nutzen Blaumeisen auch ungewöhnliche Plätze im Siedlungsraum zum Brüten, beispielsweise Spalten im Mauerwerk oder im Freien stehende Briefkästen.
Das allein das Nest bauende Weibchen beginnt mit der Außenschicht, für die vor allem Moos, aber auch charakteristisch zerbissene und geknickte einzelne Grashalme verwendet werden. Ist die Bruthöhle größer, steigt der zeitliche Aufwand für diese Phase. Im Mittel ab dem dritten Tag beginnt das Weibchen, Polsterstoffe einzutragen. Hierbei werden vor allem Tierhaare und Federn verwendet. Die Dauer des Nestbaus ist unterschiedlich und wird vor allem vom aktuellen Wettergeschehen beeinflusst. Die Gesamtbauzeit kann zwischen 2 Tagen bei einer Ersatzbrut und 14 Tagen liegen.
Bei der Bautätigkeit werden verschiedene Techniken unterschieden. In der ersten Phase überwiegt das sogenannte „Einzittern“, bei dem das in der Mulde sitzende Weibchen das eingetragene Nistmaterial mit raschen seitlichen Schnabelausschlägen zwischen bereits vorhandene Nestbestandteile steckt und hineinschüttelt. Beim anschließenden Feinbau des Nests werden drei Techniken unterschieden: das „Strampeln“, „Stopfen“ und „Zupfen“. Beim „Strampeln“ versucht das Weibchen mit entsprechenden Bewegungen, alle Nistmaterialien aus der Mulde heraus an die Seite zu befördern. Beim späteren „Stopfen“ werden mit dem Schnabel Niststoffe gegriffen und unter weit ausholenden, langsamen Bewegungen an anderer Stelle wieder hineingestopft, wodurch das Material zu verfilzen beginnt. Während der Lege- und Bebrütungsphase tritt das „Zupfen“ auf, das sich bei der Blaumeise nur dadurch vom „Stopfen“ unterscheidet, dass das Material von weiter her geholt und weniger hin und her bewegt wird. Für den eigentlichen Nestbau ist das „Zupfen“ wahrscheinlich kaum von Bedeutung, eher wohl ist es ein Vorläufer des Bewegungsablaufs, mit dem später vor Verlassen der Bruthöhle die Eier bedeckt werden.[22][23]
Gelege



Die Eier der Blaumeise sind denen anderer Kleinmeisen sehr ähnlich und optisch kaum von ihnen zu unterscheiden. Sie weisen eine weiße Grundfärbung und eine für Meisen typische Spindelform auf, zudem eine glatte, schwach glänzende Oberfläche. Weiterhin zeigen sie ein uneinheitliches Muster aus hellen oder dunkleren rötlich bis braunen Punkten und Klecksen, die sich häufig am stumpfen Pol konzentrieren.
Die Eigröße scheint zu einem beträchtlichen Teil vom jeweiligen Weibchen abzuhängen und genetisch bestimmt zu sein. Die Länge liegt zwischen 14 und 18, die Breite zwischen 10,7 und 13,5 Millimetern. Die geografische Variation ist recht gering. Im Gegensatz zur Kohlmeise nimmt die Eigröße mit der Höhe nicht zu, sondern sogar eher ab, was auf die geringere Anpassung der Blaumeise auf montane Lebensräume zurückzuführen sein dürfte. Die Masse der Eier der Nominatform schwankt zwischen 0,87 und 1,16 Gramm, das Gewicht des gesamten Geleges kann das 1,5fache des Weibchengewichts betragen.
Der Legebeginn fällt in Mitteleuropa auf Mitte April, der wichtigste Zeitgeber ist die Tageslänge, daneben spielen Umweltfaktoren und dabei vor allem die Temperatur eine Rolle. Neuere Untersuchungen deuten an, dass sich der Legebeginn im Laufe der letzten Jahrzehnte deutlich verfrüht hat. Diese Aussage stützt sich auf die seit den 1950er Jahren einigermaßen standardisiert erhobenen Vergleichsdaten. Blaumeisen stellen damit gute Bioindikatoren dar, und ihr verändertes Verhalten spiegelt die globale Erwärmung wider.
Die mittlere Gelegegröße liegt zwischen 6 und 12 Eiern, im Extremfall wurden bis zu 17 Eiern gezählt; dies stellt einen Höchstwert für die Erstbrut bei den Meisenarten der Westpaläarktis dar. Der Lebensraum scheint der entscheidende Faktor für die Gelegegröße zu sein, was auf die unterschiedliche Verfügbarkeit von Beutetieren zurückzuführen ist. Höchste Eizahlen sind in sommergrünen Eichenwäldern anzutreffen, geringere Gelegegrößen treten in Nadelwäldern und immergrünen Laubwäldern auf. Die geringsten Gelegegrößen wurden in Mitteleuropa in Gärten, Parks und anderen Biotopen des Siedlungsgebiets festgestellt. Dies wird vor allem auf den hohen Anteil fremdländischer Gehölze und die dadurch verursachte Insektenarmut zurückgeführt. Neben der Abhängigkeit vom Lebensraum hängt die Gelegegröße auch mit der geografischen Breite zusammen; bei vergleichbaren Habitaten sind die Gelege im Norden größer als im Süden. Einen deutlich über dieses Nord-Süd-Gefälle hinausgehenden Sonderfall stellen die kanarischen Blaumeisen dar. Bei ihnen beträgt die mittlere Gelegegröße weniger als 4 Eier.
In den meisten Lebensräumen treten nur in Ausnahmefällen Zweitbruten auf, die Häufigkeit liegt in der Regel deutlich unter 10 Prozent. Auch Ersatzbruten sind vergleichsweise selten. Ein verstärktes Auftreten von Zweit- und Ersatzbruten gibt es nur in bestimmten Lebensräumen und bei speziellen witterungsbedingten Konstellationen. Dies ist ein deutlicher Unterschied zur in der Größe vergleichbaren Tannenmeise; bei dieser ist die Gelegegröße der Erstbrut geringer, dafür treten Zweitbruten wesentlich häufiger auf. Dass die Erstbrut für die Blaumeisenweibchen einen erheblichen energetischen Aufwand darstellt, zeigt sich auch daran, dass Unterbrechungen bei der Eiablage mit 37 Prozent sehr häufig auftreten, was einen Höchstwert bei Höhlenbrütern darstellt.[22][24]
Bebrütung und Schlupf
Wie bei den anderen verwandten Meisenarten bebrütet bei der Blaumeise ausschließlich das Weibchen das Gelege, das Männchen verteidigt das Revier und setzt das Balzfüttern fort. Die Brut beginnt im Regelfall nach Ablage des letzten Eies und dauert zwischen 12 und 17 Tagen, wobei die Extremwerte nur in Einzelfällen beobachtet wurden. Die Bebrütung größerer Gelege beansprucht etwas mehr Zeit.

An den letzten Bebrütungstagen wurde als mittlere Aufenthaltszeit auf den Eiern 26 Minuten festgestellt, die sich mit einer im Durchschnitt zehnminütigen Periode außerhalb der Bruthöhle abwechselt. Bei tiefen Temperaturen verlängern sich die Brutintervalle zu Gunsten des Aufenthalts auf den Eiern.[25]
Bei Blaumeisen ist das bei Singvogelarten mit großen Gelegen typische asynchrone Schlüpfen besonders deutlich ausgeprägt. In der Regel zieht sich der Schlupf über zwei bis drei Tage hin, nur in seltenen Fällen schlüpfen die Jungen am selben Tag. Dies wird unter anderem darauf zurückgeführt, dass das bereits vor Beginn der eigentlichen Brut in der Höhle übernachtende Weibchen das relativ kleine Luftvolumen in der Höhle erwärmt.
David Lack vermutete bereits 1954, dass das asynchrone Schlüpfen neben der Gelegegröße der Regulation der Nachkommenzahl entsprechend den aktuellen Nahrungsbedingungen dient. Bei dieser als „nichtaggressive Brutreduktion“ bezeichneten Verhaltensweise werden in Nahrungsmangelsituationen die deutlich kleineren Nesthäkchen nicht mehr gefüttert, was die Überlebenschancen der restlichen Jungen erhöht. Diese Vermutung konnte bei der Blaumeise experimentell weitgehend bestätigt werden.

In der Literatur wird angegeben, dass aus 82 bis 92 Prozent der Eier Junge schlüpfen. Dabei wurden die geringsten Schlüpfraten in städtischen Lebensräumen festgestellt. Neuere Untersuchungen deuten aber an, dass die Schlüpfrate durch die früheren Untersuchungen selbst negativ beeinflusst wurde und die tatsächliche Schlüpfrate höher ist. Ursache können zum einen minimale Beschädigungen der Eier sein, die bei Messung der Eigröße entstehen und zum Austrocknen des Eies führen können. Zum anderen führen auch Störungen im Nistplatzbereich zu geringeren Schlüpfraten.[22][26]
Entwicklung der Jungvögel
Die Angaben für die Nestlingszeit liegen zwischen 16 und 22 Tagen. In der Anfangsphase sind die Weibchen vorwiegend mit dem Hudern beschäftigt, und die Männchen leisten den überwiegenden Teil der Fütterarbeit, wobei die Nahrung häufig nicht durch die Männchen selbst verfüttert, sondern an das wartende Weibchen übergeben wird. Ungefähr ab dem 8. Nestlingstag sind die Anteile der Fütterungen zwischen Männchen und Weibchen gleich verteilt. Dies gilt allerdings nicht für polygyn verpaarte Männchen; deren Anteil liegt in dieser Phase nur bei 20 bis 30 Prozent. In den beobachteten Fällen war festzustellen, dass die Bruten derartiger Männchen zeitlich so versetzt waren, dass die Anfangsphasen der Nestlingszeiten sich nicht überschnitten.
.jpg.webp)
Die Fütterfrequenz weist zwischen dem 11. und dem 15. Tag ihr Maximum auf, fällt anschließend leicht ab und bleibt bis zum Ausfliegen auf einem etwas niedrigeren Niveau. Kurzfristige Veränderungen im Nahrungsbedarf der Jungvögel werden jedoch nicht nur über die Fütterfrequenz, sondern auch durch die Wahl unterschiedlicher Beute reguliert; da Blaumeisen selbst kleinere Beutetiere kaum bündeln, wird der erhöhte Futterbedarf auch durch die Auswahl größerer Tiere befriedigt.
Die Gewichtszunahme der Nestlinge ist zwischen dem 5. und 12. Nestlingstag am deutlichsten. Kurz vor dem Ausfliegen erreichen sie fast das Gewicht der Altvögel. Beim Vergleich der Gewichtsentwicklung der Blaumeisen mit sympatrisch lebenden Tannenmeisen zeigt sich, dass die Gewichtsunterschiede von Blaumeisennestlingen derselben Brut mit der Zeit zunehmen, während die Unterschiede bei der Tannenmeise abnehmen; zudem kann das Gewicht der Nestlinge der Tannenmeise das der Altvögel übersteigen.
Die Gefiederentwicklung verläuft im Gegensatz zur Gewichtszunahme weitgehend unabhängig von den Einflüssen der Umwelt. Die ersten durchbrechenden Kiele sind die von Hand- und Armschwingen, ungefähr am 5. Tag. Die Entwicklung des Kopfgefieders dauert am längsten. Ein großer Teil der Federn ist schon vor dem Ausfliegen fertig entwickelt, Schwingen und Steuerfedern wachsen anschließend noch weiter.[27][28][29]
.jpg.webp) Nestling am Einflugloch |
 Jungvogel |
Ältere Nestlinge klettern häufig an der Höhlenwand zur Einflugöffnung und nehmen die Nahrung dort in Empfang. Dabei lernen sie bereits die nähere Umgebung der Höhle kennen, was beispielsweise für ihre spätere Habitatwahl von Bedeutung sein dürfte. Das Ausfliegen scheint an keine bestimmte Tageszeit gebunden zu sein, eine Tendenz zu den Stunden des Vormittags wurde aber beobachtet. Die Jungvögel fliegen meist recht zügig hintereinander aus, in Richtung nahe gelegener, dichter Vegetation. Auch außerhalb der Bruthöhle werden die Jungvögel weiter gefüttert. Es wird angenommen, dass die Mortalität im ersten Lebensabschnitt sehr hoch ist, derartige Untersuchungen sind jedoch schwierig, da die selbstständigen Jungvögel meist vom unmittelbaren Brutort abwandern.[30]
Bruterfolg
Den größten Einfluss auf den Bruterfolg haben Witterungseinflüsse; dabei ist bemerkenswert, dass neben Wintereinbrüchen auch überdurchschnittlich hohe Temperaturen einen verminderten Bruterfolg zur Folge haben. Dies ist darauf zurückzuführen, dass bei solcher Witterung die Entwicklung der wichtigsten Beutetiere deutlich beschleunigt und die zeitliche Abstimmung des Brutgeschehens gestört wird, die die Blaumeisen ab der Eiablage nicht mehr beeinflussen können.[31]
Der relative Bruterfolg, der Anteil flügger Jungvögel bezogen auf die Gelegegröße, ist in Eichenwäldern am größten und liegt dort über 80 Prozent. In reinen Nadel- und immergrünen Laubwäldern ist er am geringsten, in einem Fichtenwald in Süddeutschland wurden 31 Prozent ermittelt. Noch deutlicher wirkt sich der Lebensraum bei den Unterschieden des absoluten Bruterfolgs aus, da auch die Gelegegröße einen Zusammenhang mit der Habitatqualität aufweist. Die Zahl der Jungvögel, die eine einzelne Blaumeise im Laufe ihres Lebens zum Ausfliegen bringt, ist individuell sehr unterschiedlich. Bei einer ausführlichen Untersuchung in Belgien brachten wenige sehr erfolgreiche Blaumeisen 40 und mehr Nestlinge zum Ausfliegen. Ein Großteil der Schlüpflinge brütet jedoch niemals selbst erfolgreich; nach Schätzungen bringen 35 Prozent der erfolgreichen Brüter keine Enkel hervor.[32][33]
Sonstiges Verhalten
Blaumeisen beginnen den Tag früher als Kohlmeisen und bleiben auch am Abend länger aktiv. Sowohl in der Brutsaison als auch im Winter verbringen Blaumeisen einen Großteil ihrer Zeit mit der Nahrungssuche, im Mittwinter sind es ungefähr 85 Prozent der aktiven Zeit.[34]

Ruhe und Komfortverhalten
Blaumeisen übernachten im Regelfall einzeln, vom Spätsommer bis zum Frühjahr in Baumhöhlen, sonstigen Nischen und auch Nistkästen. Im Sommer wird vermutlich außerdem auf Zweigen im Freien übernachtet. Auch bei den Schlafplätzen ist der Hauptkonkurrent wie bei der Nahrungssuche die Kohlmeise. Der für die Gefiederpflege aufgewendete Zeitanteil wird auf 6 Prozent der Gesamtaktivität geschätzt. Blaumeisen baden häufig und intensiv, neben Wasserbädern sind auch Bäder im Schnee zu beobachten.[35]
Bewegung
Blaumeisen legen fliegend meist nur kurze Strecken zurück, zwischen Bäumen oder von Zweig zu Zweig. Beim Flug über längere Distanzen meiden sie wenn möglich das Überfliegen von Freiflächen, der Flug ist bogenförmig und relativ langsam. Die Blaumeise kann sich mit ihren kurzen, kräftigen Zehen viel besser hängend an Zweige und Blätter klammern als alle anderen Meisenarten.[36]
Soziales und antagonistisches Verhalten

Nach der Brutsaison lösen sich Paar- und Familienverbände allmählich auf. Im Herbst und Winter schließen sich Blaumeisen größeren, meist gemischten Trupps an, denen neben anderen Meisen auch Kleiber, Baumläufer oder Goldhähnchen angehören können. An günstigen Nahrungsquellen, insbesondere an Futterstellen, kann es dabei zu interspezifischen Auseinandersetzungen kommen, dabei ist die Blaumeise häufig auch gegenüber größeren Vögeln dominant – im Gegensatz zur Auseinandersetzung um Bruthöhlen.
Überhaupt verfügen Blaumeisen über ein sehr großes Aggressionspotential im Verhältnis zu ihrer Größe. Innerhalb der Blaumeisen besteht eine ausgeprägte Hierarchie, in der einzelne Männchen dominieren. Die Rangpositionen werden von Artgenossen dabei augenblicklich erkannt. In einem Revier ansässige Vögel dominieren über Zuwanderer und Durchzügler.[37][38]
Verlustursachen und Lebenserwartung
Neben der Nestlingsmortalität ist insbesondere die hohe Sterberate im ersten Lebensjahr von großer Bedeutung. Nur etwa ein Viertel der ausgeflogenen Jungvögel brütet im Folgejahr.

Beutegreifer
Trotz der vergleichsweise geschützten Brut in Höhlen spielt Prädation bei den Nestlingen eine nicht unerhebliche Rolle, in Naturhöhlen sind die Verluste dabei deutlich höher als in Nistkästen. Unter den Säugetieren sind besonders Arten aus der Familie der Marder von Bedeutung, vor allem Wiesel (Mustela spp.) können lokal einen erheblichen Einfluss haben. Bei den Vögeln ist der Buntspecht der bedeutendste Nestfeind. Er erweitert das Einflugloch oder hackt sich anderweitig einen Zugang zur potentiellen Bruthöhle und sucht diese gezielt nach Eiern und Jungvögeln ab. Es kommt auch vor, dass sperrende Jungvögel durch das Einflugloch herausgezogen werden.[31]
Der wichtigste Feind adulter Blaumeisen ist der Sperber. Der Anteil der von ihm erlegten Brutvögel kann ungefähr bis zu 17 Prozent betragen, schwankt aber zwischen verschiedenen Beobachtungsjahren. Trotz dieses deutlich spürbaren Einflusses auf den Bruterfolg scheint die Bedeutung für die Populationsdynamik der Blaumeisen insgesamt eher gering zu sein. In ihrem Verhalten zeigen Blaumeisen deutliche Anpassungen an ihren Hauptfeind, so ist etwa der Warnruf aufgrund der hohen Frequenz für den Sperber kaum hörbar und nur äußerst schwer lokalisierbar. Neben dem Sperber können auch andere Greifvögel gelegentlich Blaumeisen erbeuten, etwa der Turmfalke in städtischen Lebensräumen. Die Bedrohung durch Säugetiere ist für adulte Blaumeisen deutlich geringer als für Nestlinge, allerdings werden besonders brütende Weibchen immer wieder von Nesträubern miterbeutet.[39]
Andere Verlustursachen
Das Wetter spielt bei der Nestlingsmortalität eine wichtige Rolle, Altvögel hingegen überstehen Schlechtwetterperioden während der Brutzeit recht gut. Im Winterhalbjahr spielt jedoch neben der Verfügbarkeit von Nahrung die Witterung eine erhebliche Rolle bei der Sterblichkeit, da mit sinkenden Temperaturen der Energiebedarf der Kleinvögel sehr stark ansteigt. Für den Einfluss von Krankheiten und Parasiten auf die Sterblichkeit von Blaumeisen gibt es keine verlässlichen Hinweise.[39]
Seit März 2020 sind Blaumeisen in Deutschland von einer anscheinend ansteckenden Krankheit betroffen. Die ersten Fälle wurden in Rheinhessen beobachtet, mittlerweile gibt es Berichte aus einem Gebiet zwischen Westerwald in Rheinland-Pfalz über Mittelhessen bis ins westliche Thüringen. Die betroffenen Vögel wirken apathisch und aufgeplustert, die Augen verklebt. Teilweise sind auch Kohlmeisen und andere kleine Singvögel betroffen. Einige Symptome deuten auf eine bakterielle Infektion hin, die in der Vergangenheit vor allem in Großbritannien zu Lungenentzündungen bei Meisenarten geführt hat. In England und Wales war diese Vogelepidemie erstmals 1996 flächig beschrieben worden, in Nordrhein-Westfalen war im März 2018 Ähnliches aufgetreten.[40] Für die weitere Erfassung und Bewertung dieses neueren Phänomens und dessen Ausbreitung bat der NABU um Meldung derartiger Beobachtungen.[41] So konnte der NABU durch die Stunde der Gartenvögel im Jahr 2020, bei der die Blaumeise im Fokus stand und an der sich mehr Menschen als jemals zuvor beteiligten, mehr Informationen über die Ausbreitung der Krankheit gewinnen.[42] Tote Vögel konnten auch – nach vorheriger Rücksprache und unter Beachtung einschlägiger Sicherheitsmaßnahmen – zur Untersuchung an das Bernhard-Nocht-Institut für Tropenmedizin oder an das zuständige Kreisveterinäramt geschickt werden.[43] Ende April 2020 wurde das Bakterium Suttonella ornithocola als Ursache ermittelt. Die betroffenen Tiere sterben demnach an einer Lungenentzündung.[44] Für Menschen und Haustiere ist das Bakterium nach Behördenangaben unschädlich.[45]
Lebenserwartung
Bei einer intensiv untersuchten Population von 2400 nestjung beringten Individuen bei Braunschweig wurde eine Lebenserwartung von 2,0 Jahren für Männchen und 1,7 Jahren für Weibchen festgestellt. Die Altersstruktur war in guter Näherung geometrisch verteilt, sodass also die Überlebenswahrscheinlichkeit für ein Jahr vom Alter relativ unabhängig 50 % für Männchen und 42 % für Weibchen beträgt. Die ältesten Vögel waren 8¾ Jahre alt.[46] Auf den britischen Inseln erreichen Blaumeisen ein höheres Alter, vermutlich aufgrund der geringeren Wintersterblichkeit; die beiden dortigen „Rekordhalter“ waren 11,4 und 12,3 Jahre alt.[39]
Bestand und Bestandsentwicklung
| Land | Anzahl Brutpaare | Jahr |
|---|---|---|
| Deutschland | 2.600.000–3.300.000 | 2008[47] |
| Österreich | 200.000–500.000 | 1993[48] |
| Schweiz | 150.000–250.000 | 1998[48] |
Großflächige Bestandsdaten sind für die Blaumeise wie für alle anderen Kleinvögel schwer zu ermitteln. Eine Schätzung von 1997 geht in Europa von 16 bis 21 Millionen Brutpaaren aus. Für andere Teile des Verbreitungsgebiets – wie beispielsweise Nordafrika – liegen keine verlässlichen Angaben vor. Die nebenstehende Tabelle zeigt die Bestandsschätzungen einiger ausgewählter Länder Mitteleuropas.
Seit dem 20. Jahrhundert scheint es so, als würden sich in Mitteleuropa die positiven und negativen Einflüsse des Menschen auf den Lebensraum der Blaumeisen in etwa aufheben. Die markanteste Veränderung im vergangenen Jahrhundert war die Arealausweitung in Skandinavien, bei der sich etwa in Finnland der Bestand seit den 1950er Jahren versechsfacht hat. Blaumeisenbestände schwanken stärker als die Bestände der Kohlmeise und scheinen einen durchschnittlichen Zyklus von vier Jahren aufzuweisen. In Mitteleuropa ist die größere Schwesterart in den meisten Lebensräumen häufiger, in Großbritannien ist eine Verschiebung der Anteile zu Gunsten der Blaumeise zu erkennen.[48][49]
Systematik
Verwandtschaftsbeziehungen innerhalb der Meisen
Die traditionelle Untergliederung der etwa 50 Arten umfassenden Familie der Meisen war sehr unausgewogen, denn alle Arten – mit Ausnahme zweier atypischer orientalischer Arten – wurden in einer einzigen Gattung zusammengefasst, der Gattung Parus. Diese Einteilung war schon lange umstritten, doch jeder Versuch einer etwas differenzierteren Gliederung verstrickte sich in Widersprüche. Morphologische sowie verhaltensbiologische Unterschiede und später auch molekularbiologische Befunde legten eine Aufteilung der Gattung nahe. Eine 2005 durchgeführte molekulargenetische Untersuchung der Verwandtschaftsbeziehungen der Meisen, die die mitochondriale Gen-Sequenz des Cytochrom-b-Gens analysierte[50], führte zur Anerkennung einer Aufteilung der Gattung Parus durch die British Ornithologists’ Union. Eine solche Aufteilung auf die Gattungen Cyanistes, Poecile, Periparus, Lophophanes, Baeolophus, mit einem verbleibenden Rest von etwa 23 Arten in Parus, war bereits 1903 vom österreichischen Ornithologen Carl Eduard Hellmayr auf Basis von Gefiedermerkmalen vorgeschlagen worden.
Die Blaumeise bildet zusammen mit der Lasurmeise die Gattung Cyanistes. Dass diese beiden Arten nahe verwandt sind, war und ist unumstritten. Oben erwähnte molekulargenetische Untersuchung zeigt auch, dass diese Schwesterarten sich als erstes von den restlichen „ehemaligen“ Parus-Arten abgespalten haben. Dies ist insofern überraschend, da die Cyanistes-Arten und die nunmehr in der Gattung Parus verbliebenen Arten – vor allem die Kohlmeise – demnach nicht direkt verwandt sind, aber die einzigen Meisenarten zu sein scheinen, die keine Nahrung verstecken.[51][52]
Unterarten
Die Blaumeise weist eine große Variabilität in vergleichsweise begrenztem Verbreitungsgebiet auf. Die 14 bis 16 unterschiedenen Unterarten werden dabei in zwei Gruppen eingeteilt, die größere davon ist in Europa und Asien heimisch und wird als caeruleus-Gruppe bezeichnet. Die andere Gruppe bilden die Blaumeisen der Kanaren und Nordafrikas, traditionell als teneriffae-Gruppe bezeichnet.[11]
Schon seit längerem wird diskutiert, die Blaumeisen der Kanaren als eigenständige Art anzusehen (Cyanistes teneriffae). Das Hauptargument ist neben genetischen Unterschieden und Unterschieden im Verhalten der stark abweichende Reviergesang – mitteleuropäische Blaumeisen reagieren nicht auf Strophen der Artgenossen aus Teneriffa.[2] Umstritten ist allerdings, wie die beiden nordafrikanischen Unterarten dann zuzuordnen sind, insbesondere die Zuordnung der nordwestafrikanischen Unterart Cyanistes caeruleus ultramarinus stellt ein Problem dar, diese steht offensichtlich zwischen der kanarischen und der eigentlichen, eurasischen Blaumeise. Tendenziell werden die nordafrikanischen Unterarten der eigentlichen Blaumeise zugerechnet. Ein etwas anderes Ergebnis wiederum lieferten im Jahr 2007 veröffentlichte Untersuchungen: Danach ist mit Cyanistes caeruleus degener eine der auf den Kanaren beheimateten Unterarten nicht von der nordwestafrikanischen Subspezies zu unterscheiden, zudem steht mit Cyanistes caeruleus palmensis eine weitere kanarische Unterart offensichtlich näher bei der eigentlichen Blaumeise als bei der kanarischen.[51][53]
Die folgende Darstellung der Unterarten entspricht der 1996 von Harrap und Quinn vorgestellten Gliederung.[54]
Die caeruleus-Gruppe
Dieser Unterartengruppe gehören alle Blaumeisen außer denen im afrikanischen Teil des Verbreitungsgebiets an. Zur Gruppe zählen alle typischen, mitteleuropäischen Blaumeisen und alle Vertreter dieser Gruppe ähneln mehr oder weniger stark der mitteleuropäischen Form. Innerhalb der Gruppe bestehen die hauptsächlichen Unterschiede in der Intensität der Blau- und Gelbfärbung des Gefieders.[11]
- Cyanistes caeruleus caeruleus (Linnaeus, 1758): Kontinentaleuropa wird mit Ausnahme der Iberischen Halbinsel fast ausschließlich von der Nominatform besiedelt. Weiterhin findet sich diese Unterart in Kleinasien sowie im nördlichen Teil des Nahen Ostens. Das Aussehen entspricht obiger Beschreibung.[9]
- Cyanistes caeruleus obscurus (Pražák 1894): Die Unterart tritt auf den Britischen Inseln und den Kanalinseln auf, in Westfrankreich kommt es zur Vermischung mit der Nominatform, was den Status als Unterart in Verbindung mit den geringen Unterschieden gelegentlich zweifelhaft erscheinen lässt. Die Kopfplatte ist etwas dunkler blau, der Mantel ist ebenfalls dunkler und geht mehr ins Grünliche. C. c. obscurus ist im Durchschnitt etwas kleiner als die Nominatform.
- Cyanistes caeruleus balearicus (Von Jordans 1930): Das Vorkommen dieser sich ebenfalls nur geringfügig unterscheidenden Unterart beschränkt sich auf Mallorca. Das Gefieder erscheint insgesamt dumpfer, der Bauchstreifen ist deutlich reduziert.
- Cyanistes caeruleus ogliastrae (Hartert 1905): Diese Unterart kommt in Portugal, Südspanien, Korsika und Sardinien vor. In einigen spanischen Provinzen treten Mischformen mit der Nominatform auf. C. c. ogliastrae ist der Rasse der Britischen Inseln sehr ähnlich. Der Mantel tendiert jedoch mehr ins Blaue oder Graue, die Flügeldecken sind im Regelfall dunkler und leuchtender blau. Auffallend ist der reduzierte Geschlechtsdimorphismus, die Färbung der Weibchen ist mitunter genauso leuchtend wie die der Männchen.
- Cyanistes caeruleus calamensis (Parrot 1908): Die Vertreter der Peloponnes, der Kykladen, sowie von Kreta und Rhodos sind im Vergleich zur Nominatform häufig kleiner, unterscheiden sich aber in den Gefiedermerkmalen kaum von der Nominatform. Es erscheint fraglich, ob der Status dieser Unterart einer kritischen Prüfung standhalten könnte.
- Cyanistes caeruleus orientalis (Zarudny & Loudon 1905): Die Unterart tritt in Gebieten in der Nähe der Wolga bis in den südlichen und zentralen Ural auf. Die Unterschiede zur Nominatform bestehen hauptsächlich in der dumpfer gefärbten, mehr ins Grau-Gelbliche gehenden Oberseite und in der heller gelberen Bauchseite. Im Mittel sind die Vertreter dieser Rasse etwas größer, die Unterschiede werden von manchen Autoren dennoch nicht als ausreichend für eine Abtrennung von der Nominatform angesehen.
- Cyanistes caeruleus satunini (Zarudny 1908): Das im Südosten an das Verbreitungsgebiet der Nominatform anschließende Areal umfasst die Halbinsel Krim, den Kaukasus und Transkaukasien, den nordwestlichen Iran, die östliche und südliche Türkei sowie Teile Turkmenistans. Die Unterart zeigt einen allmählichen Übergang zur Nominatform, es gibt eine ausgedehnte Mischzone, nur die Vögel des östlichsten Teils des Verbreitungsgebiets unterscheiden sich deutlich. Auf der Oberseite sind Oliv- und Grautöne dominierend, die Bauchseite ist einheitlicher und dumpfer gelb.
- Cyanistes caeruleus raddei (Zarudny 1908): Diese Unterart ist in einem schmalen Streifen im Nordiran beheimatet und somit zusammen mit C. c. persicus der einzige Vertreter außerhalb der paläarktischen Region. Sie zeigt sowohl Ähnlichkeiten mit der Nominatform als auch mit C. c. satunini. Der Mantel ist im Mittel dunkler und mehr bläulich, die Unterseite klarer und kräftiger gelb.
- Cyanistes caeruleus persicus (Blanford 1873): Diese Vögel sind im Zagrosgebirge des südlichen und südwestlichen Iran anzutreffen. Am Nordrand des Verbreitungsgebiets gibt es Mischformen mit C. c. raddei. Vertreter dieser Unterart sind im Mittel kleiner als die Nominatform und generell blass gefärbt, die Oberseite ist bläulich grüngrau, die Unterseite vergleichsweise variabel.
Die teneriffae-Gruppe

Die Unterarten dieser Gruppe sind im Gegensatz zur caeruleus-Gruppe klarer voneinander abzutrennen. Dies beruht darauf, dass alle sechs Unterarten allopatrisch vorkommen und demnach keine Mischzonen bestehen. Allen gemeinsam sind die im Vergleich dunklere Färbung und die von denen der anderen Unterartengruppe stark abweichenden Lautäußerungen.[11][55] Insbesondere die vier auf den Kanaren vorkommenden Unterarten dieser Gruppe werden heute oft als eigene Art angesehen, die Zuordnung der beiden nordwestafrikanischen Unterarten ist bei dieser Einteilung jedoch umstritten.
- Cyanistes caeruleus ultramarinus (Bonaparte, 1841): Diese Unterart ist in Nordwestafrika relativ weit verbreitet. Weiterhin siedelt sie auf der italienischen Mittelmeerinsel Pantelleria, etwa 70 Kilometer vor dem tunesischen Festland. Zu unterscheiden sind diese Vögel vor allem an der schieferblauen Oberseite.
- Cyanistes caeruleus cyrenaicae (Hartert, 1922): Hierbei handelt es sich um einen isoliert vorkommenden Endemit der nordwestlichen Kyrenaika in Libyen. Ob das Vorkommen schon immer derart abgetrennt war, wird allerdings bezweifelt. Die Isolation könnte auf die massiven Lebensraumveränderungen im nördlichen Afrika zurückzuführen sein. Diese Unterart ähnelt C. c. ultramarinus stark, das weiße Band am Vorderkopf ist allerdings schmaler, der Mantel dunkler und dumpfer blau, das Gelb der Unterseite ist dunkler. Zudem sind die Vögel etwas kleiner, haben aber einen dickeren Schnabel, was als Anpassung an die Nahrungssuche in Wacholder gewertet werden kann.
- Cyanistes caeruleus degener (Hartert, 1901): Die Unterart besiedelt die wüstenartigen Inseln Lanzarote und Fuerteventura. Sie erinnert an C. c. ultramarinus, ist aber auf der Oberseite matter und stärker grau, die dunklen Bänder an Kehle und Nacken sind breiter. Der längere und dickere Schnabel dürfte auch hier eine Anpassung an den Lebensraum sein. Neuere molekulargenetische Untersuchungen lassen allerdings keinen Unterschied zwischen dieser Subspezies und C. c. ultramarinus erkennen.[53]

- Cyanistes caeruleus teneriffae (Lesson, 1831): Diese Vögel findet man nicht nur auf Teneriffa, sondern auch auf den Nachbarinseln Gran Canaria und La Gomera. Der Rücken erscheint noch dunkler als bei C. c. degener, die Unterseite ist dunkelgelb und der schwarze Bauchstreifen fehlt fast vollständig. Der Schnabel ist wie auch bei den noch folgenden Unterarten recht fein und wird als Anpassung für die Nahrungssuche an Kanarenkiefern gedeutet.
- Cyanistes caeruleus palmensis (Meade-Waldo, 1889): Bei diesem Endemit der Insel La Palma ist die Kopfplatte sehr düster gefärbt, eher schwarz als blau. Mantel und Deckfedern sind dumpf und gräulich.
- Cyanistes caeruleus ombriosus (Meade-Waldo, 1890): Diese Unterart ist auf der Insel El Hierro endemisch und ähnelt C. c. teneriffae. Die Oberseite tendiert mehr ins Grünliche, die Unterseite ist kräftiger gelb.
Die Inselblaumeisen der Kanaren sind ein hervorragendes Beispiel für die Radiation unter isolierten Bedingungen eines ozeanischen Archipels, wenngleich ihre Vielfalt nicht ganz an die der Inselgattungen und -familien – wie beispielsweise der Darwinfinken – heranreicht.[11]
Blaumeise und Mensch
Allgemein wird die Blaumeise als putziger kleiner Vogel eingeschätzt; ihre Bekanntheit ist sehr hoch, da sie sich oft in der Nähe des Menschen aufhält und auch sehr leicht zu bestimmen ist.
Etymologie und Benennung
Sowohl der deutsche Trivialname als auch der wissenschaftliche Name weisen auf die Grundfärbung des Gefieders hin, „caeruleus“ ist das lateinische Wort für „blau“. Lokale deutsche und auch ausländische Bezeichnungen enthalten ebenfalls häufig diese Farbbezeichnung, beispielsweise „Blue tit“ im Englischen und „Mésange bleue“ im Französischen. In manchen Sprachen geht der Name aber auch auf die Stimme des Vogels zurück, so im Italienischen, dort nennt man die Blaumeise „Cinciarella“. Der niederländische Name „Pimpelmees“ wiederum bezieht sich auf ihr Verhalten, bei der Nahrungssuche oft von Zweigspitzen herabzuhängen. Die Art der Nahrungsbearbeitung mit dem Schnabel spiegelt sich im Spanischen wider, dort wird die Blaumeise als „Herrerillo común“ bezeichnet, „Herrerillo“ ist die Verkleinerungsform von „Herrero“, zu Deutsch „Schmied“.[56]
Kunst und Kultur
Bereits in frühen Buchdrucken kann man die Blaumeise finden, meist ist sie in den Buchmalereien jedoch nur Bestandteil der floralen Verzierungen. Ein berühmtes Beispiel ist die Koberger-Bibel, die im 15. Jahrhundert entstand, im Buch Genesis ist am unteren Ende in den Ranken eine Blaumeise zu entdecken.
 Blaumeise aus Porzellan |
_1979%252C_MiNr_2392.jpg.webp) Briefmarke in der DDR |
Auch in Gedichten ist die Blaumeise regelmäßig vertreten, Wilhelm Busch beschreibt beispielsweise ihre Nahrungssuche:
Hell flötet sie und klettert munter
Am Strauch kopfüber und kopfunter
Das härt’ste Korn verschmäht sie nicht,
Sie hämmert bis die Schale bricht.
Der zeitgenössische Berliner Künstler Wolfgang Müller widmet einen guten Teil seines Schaffens der Blaumeise, hierzu zählt auch die zusammen mit Nan Goldin veranstaltete Ausstellung Blue Tit.
Das Kunsthandwerk nimmt sich in unterschiedlicher Weise der Blaumeise an, beispielsweise in Form von Porzellanfiguren, Ziertellern und auch Schmuck. Aufgrund der attraktiven Optik des Vogels dient er immer wieder als Verzierung alltäglicher Gebrauchsgegenstände. Ein besonderer Fall sind die Darstellungen auf zahlreichen Briefmarken, die teilweise weit ins Detail gehen und sogar Unterarten darstellen.[57]
Forschungsgeschichte
Vor mehr als 400 Jahren hat Conrad Gessner in seiner Historia animalium die Blaumeise beschrieben und von anderen Arten abgegrenzt – insbesondere von der Schwanzmeise. Im Jahre 1853 widmete sich die erste Ausgabe des Journals für Ornithologie der Blaumeise mit einem Beitrag zu ihrer Oologie. Seit dieser Zeit wurden immer wieder verschiedenste Fragen der Biologie der Blaumeise umfassend untersucht, einen besonderen Schwerpunkt bildeten Arbeiten über die Wechselbeziehungen zwischen Gelegegröße, Habitat und anderen Umweltfaktoren sowie Fragen der Populationsdynamik. Aus diesem Problemkreis ergaben sich weitere Fragestellungen zur Reproduktion, Fortpflanzungserfolg und damit der elterlichen Fitness. In jüngerer Zeit hat sich vor allem der Mittelmeerraum zu einer Art „Freilandlabor“ für diesen Interessenkomplex entwickelt.[57]
Auch heute noch ist die Blaumeise ein bevorzugtes Forschungsobjekt, nicht zuletzt, da ihre brutbiologischen Variablen in Nistkästen gut zu kontrollieren sind, und die Art menschliche Nähe nicht scheut. Aufbauend auf viele bereits vorhandene Untersuchungsergebnisse können die geeigneten Fragen gestellt und ein erfolgversprechender Versuchsaufbau gewählt werden.[58] Damit bietet sich die Blaumeise als Modellorganismus auch für Fragestellungen an, die über die Art selbst hinausgehen und allgemeinere, die Ökologie betreffende Erkenntnisse ermöglichen.[59]
Literatur
- Urs N. Glutz von Blotzheim, K. M. Bauer: Handbuch der Vögel Mitteleuropas (HBV). Band 13/I: Muscicapidae – Paridae. AULA-Verlag, ISBN 3-923527-00-4.
- Manfred Föger, Karin Pegoraro: Die Blaumeise. Neue Brehm Bücherei, Hohenwarsleben 2004, ISBN 3-89432-862-2.
- Josep del Hoyo et al.: Handbook of the Birds of the World. (HBW) Band 12: Picathartes to Tits and Chickadees. Lynx Edicions, Barcelona 2007, ISBN 84-96553-42-6.
- Jochen Hölzinger: Die Vögel Baden-Württembergs. Band 3/2, Singvögel/Sperlingsvögel, Eugen Ulmer Verlag, Stuttgart 1997, ISBN 3-8001-3483-7.
Weblinks
- Blaumeise bei Vögel der Schweiz
- Bilder eines Blaumeisennests an einer Sumpfzypresse
- Bauanleitung für einen Blaumeisennistkasten
- Videos, Fotos und Tonaufnahmen zu Cyanistes caeruleus in der Internet Bird Collection
- Cyanistes caeruleus in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: BirdLife International, 2008. Abgerufen am 12. November 2008.
- Alters- und Geschlechtsmerkmale (PDF; 2,3 MB) von Javier Blasco-Zumeta und Gerd-Michael Heinze (englisch)
- Federn der Blaumeise
Einzelnachweise
- HBV Band 13/I, P. c. caeruleus, Feldkennzeichen, Beschreibung, S. 581–587.
- Föger, Pegoraro: Die Blaumeise, Allgemeine Charakterisierung, Altvögel, S. 20–26.
- P. Mullen, G. Pohland: Studies on UV reflection in feathers of some 1000 bird species: are UV peaks in feathers correlated with violet-sensitive and ultraviolet-sensitive cones?. In: Ibis 105:59–68, 2008. doi:10.1111/j.1474-919X.2007.00736.x.
- Föger, Pegoraro: Die Blaumeise, Allgemeine Charakterisierung, Jungvögel, S. 26 ff.
- Föger, Pegoraro: Die Blaumeise, Mauser, S. 96 ff.
- Doutrelant et al. (2000): Effect of blue tit song syntax on great tit territorial responsiveness an experimental test of the character shift hypothesis. In: Behavioral Ecology and Sociobiology. 48: 119–124 (Zusammenfassung)
- HBV Band 13/I, P. c. caeruleus, Stimme, S. 589–596.
- Föger, Pegoraro: Die Blaumeise, Verbreitung, S. 12 f.
- HBV Band 13/I, P. c. caeruleus, Brutgebiet, S. 596 ff.
- HBV Band 13/I, P. caeruleus, Verbreitung, S. 579.
- Föger, Pegoraro: Die Blaumeise, Systematik, Unterarten, S. 13–16.
- Föger, Pegoraro: Die Blaumeise, Lebensraum und Siedlungsbiologie, S. 29–33.
- HBV Band 13/I, P. c. caeruleus, Biotop, S. 608–610.
- W. Winkel, M. Frantzen (1991): Zur Populationsdynamik der Blaumeise: Langfristige Studien bei Braunschweig. Journal für Ornithologie 132:81–96
- Föger, Pegoraro: Die Blaumeise, Wanderungen, S. 97 ff.
- HBV Band 13/I, P. c. caeruleus, Wanderungen, S. 600–608.
- Föger, Pegoraro: Die Blaumeise, Überwinterung, S. 99–102.
- Föger, Pegoraro: Die Blaumeise, Ernährung, S. 36–47.
- HBV Band 13/I, P. c. caeruleus, Verhalten: Nahrungserwerb, S. 638–641.
- HBV Band 13/I, P. c. caeruleus, Nahrung, S. 651–656.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Revier- und Paarverhalten, S. 48–54.
- HBV Band 13/I, P. c. caeruleus, Fortpflanzung, S. 614–629.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Neststandort und Nestbau, S. 54–63.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Gelege, S. 64–72.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Bebrütung, S. 72–77.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Schlupf, S. 78–81.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Nestlingszeit, S. 81–86.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Entwicklung der Jungvögel, S. 86–89.
- HBV Band 13/I, P. c. caeruleus, Verhalten; Brutpflege, Aufzucht und Verhalten der Jungen; S. 647–651.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Ausfliegen der Jungvögel, S. 95.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Nestlingsverluste, S. 89–92.
- Föger, Pegoraro: Die Blaumeise, Brutbiologie: Bruterfolg und Liefetime Reproduction, S. 92–95.
- HBV Band 13/I, P. c. caeruleus, Bruterfolg, Sterblichkeit, Alter, S. 629–634.
- HBV Band 13/I, P. c. caeruleus, Verhalten; Aktivität; S. 634 ff.
- HBV Band 13/I, P. c. caeruleus, Verhalten; Ruhe, Putzen; S. 637 f.
- HBV Band 13/I, P. c. caeruleus, Verhalten; Bewegung; S. 636.
- HBV Band 13/I, P. c. caeruleus, Verhalten; Antagonistisches Verhalten; S. 645 f.
- Föger, Pegoraro: Die Blaumeise, Sozialverhalten, S. 101.
- Föger, Pegoraro: Die Blaumeise, Mortalität, S. 105–110.
- Lungenentzündung: Mysteriöses Meisensterben geklärt, tagesschau.de vom 22. April 2020, abgerufen 23. April 2020
- Mysteriöses Meisensterben, nabu.de, abgerufen am 18. April 2020.
- Zwischenergebnisse der Vogelzählung 2020 - NABU. Abgerufen am 12. Mai 2020.
- Nadja Podbregar: Mysteriöses Blaumeisen-Sterben in Deutschland. In: scinexx. 14. April 2020, abgerufen am 14. April 2020.
- dpa-Meldung: Auslöser für mysteriöses Meisensterben identifiziert, Die Welt vom 22. April 2020
- Untersuchungen bestätigen NABU-Verdacht, Naturschutzbund Deutschland (NABU) vom 22. April 2020, abgerufen 23. April 2020
- Wolfgang Winkel, Margrit Frantzen: Zur Populationsdynamik der Blaumeise (Parus caeruleus): Langfristige Studien bei Braunschweig. In: Journal für Ornithologie. Band 132, Nr. 1, Januar 1991, S. 81, doi:10.1007/BF01640527.
- vgl. C. Sudfeldt, R. Dröschmeister, C. Grüneberg, S. Jaehne, A. Mitschke, J. Wahl (2008): Vögel in Deutschland – 2008. DDA, BfN, LAG VSW, Münster, S. 7 (PDF).
- Föger, Pegoraro: Die Blaumeise, Bestandsgröße und Schwankungen in verschiedenen Gebieten, S. 103 f.
- HBV Band 13/I, P. c. caeruleus, Bestand, Bestandsentwicklung; S. 598 ff.
- Gill et al.: Phylogeny of titmice (Paridae): II. Species relationships based on sequences of the mitochondrial cytochrome-b gene. In: The Auk. 122, 2005, S. 121, doi:10.1642/0004-8038(2005)122[0121:POTPIS]2.0.CO;2.
- del Hoyo et al.: HBW Band 12, Family Paridae, Systematic, S. 662–669.
- Föger, Pegoraro: Die Blaumeise, Systematik, Verwandtschaftsbeziehungen innerhalb der Meisen, S. 16–19.
- Dietzen, Garcia-del-Rey, Castro, Wink: Phylogeography of the blue tit (Parus teneriffae-group) on the Canary Islands based on mitochondrial DNA sequence data and morphometrics. Journal of Ornithology 149:1–12, 2008
- Simon Harrap, David Quinn: Tits, nuthatches & treecreepers. Helm Identification Guides. A & C Black, London 1996
- HBV Band 13/I, P. caeruleus, Geographische Variation, S. 579 ff.
- Föger, Pegoraro: Die Blaumeise, Name, S. 11.
- Föger, Pegoraro: Die Blaumeise, Beziehung Mensch – Blaumeise, S. 111 ff.
- Sonja Kübler: Nahrungsökologie stadtlebender Vogelarten entlang eines Urbangradienten. Berlin 2005
- Föger, Pegoraro: Die Blaumeise, Die Blaumeise – ein Modellorganismus, S. 9 f.