Kohlmeise
Die Kohlmeise (Parus major) ist eine Vogelart aus der Familie der Meisen (Paridae). Sie ist die größte und am weitesten verbreitete Meisenart in Europa. Darüber hinaus erstreckt sich ihr Verbreitungsgebiet über den Nahen Osten und durch die gemäßigte Zone Asiens bis nach Fernost.
| Kohlmeise | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Männchen der Kohlmeise (Parus major) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Parus major | ||||||||||||
| Linnaeus, 1758 |
Der ursprüngliche Lebensraum der Kohlmeise sind Laub- und Mischwälder mit alten Bäumen; aufgrund ihrer Anpassungsfähigkeit kommt sie jedoch in fast allen Lebensräumen vor, in denen sie Höhlen zum Nisten findet. Sie zählt meist zu den häufigsten Vogelarten. Die Nahrung ist sehr vielfältig, jedoch werden hauptsächlich Insekten und deren Larven sowie pflanzliche Nahrung wie beispielsweise Samen oder Nussfrüchte gefressen. Nester werden in Baumhöhlen, Nistkästen oder anderen Hohlräumen gebaut und meist zwischen sechs und zwölf Eier hineingelegt. Die meisten Kohlmeisen bleiben im Winter in ihren Brutgebieten, wo sie teilweise in kleinen Trupps umherstreifen und sich auch mit anderen Meisen vergesellschaften. Vögel nördlicherer Regionen wandern zum Teil auch in südlichere Gegenden ab.
Ab dem zeitigen Frühjahr und teilweise auch schon im Winter ist der recht auffällige, metallisch-helle Gesang zu vernehmen, der ein zweisilbiges tsi-da … tsi-da … tsi-da oder beispielsweise als tsi-da-tsit … auch dreisilbig sein kann. Daneben verfügt die Kohlmeise über ein sehr breites Repertoire an Rufen wie beispielsweise ein hohes pink und ein warnendes dädädä.
Früher wurden über 30 Unterarten zur Kohlmeise gezählt. Aufgrund genetischer Untersuchungen wurden die ost- und südasiatischen Populationen jedoch als eigene Arten (Parus minor und Parus cinereus) abgegliedert, die derzeit noch keine deutschen Namen haben. Der Kohlmeise werden danach nur noch 15 Unterarten zugerechnet.
Beschreibung
Die Kohlmeise zählt mit 13–15 cm[1] Körperlänge zu den größeren Meisenarten und ist die größte Meise in Europa. Die Flügellänge beträgt bei Männchen etwa zwischen 71 und 82 mm, bei Weibchen etwa zwischen 69 und 81 mm. Die Schwanzlänge des Männchens liegt bei 59–66, die des Weibchens bei 55–63 mm. Das Gewicht liegt zwischen 14 und 22 g. Der 11,5–13,5 mm lange Schnabel ist verhältnismäßig kräftig und schwärzlich hornfarben mit etwas helleren Kanten. Die Iris ist lebhaft rötlichbraun bis schwarzbraun. Die Beine und Füße sind blaugrau bis schiefergrau.[2] Die Geschlechter sind sich sehr ähnlich, lassen sich aber unter anderem aufgrund der Ausprägung des schwarzen Brustbands unterscheiden.
Adulte Vögel

Bei adulten Männchen der Nominatform sind der Oberkopf, der obere Nacken, die Halsseiten, die Kehle und ein Band auf der Brustmitte glänzend blauschwarz. Wangen und Ohrdecken sind rein weiß und werden von den schwarzen Partien sauber eingefasst. Die Brust- und Bauchseiten sind schwefel- bis zitronengelb. Das schwarze Band in der Mitte erweitert sich zwischen den Beinen zu einem tiefschwarzen Fleck. Ein weißliches Band im Nacken trennt das Schwarz des Hinterkopfs vom Rücken und läuft nach hinten hin in ein grünliches Gelb aus. Rücken- und Schulterfedern sind sonst olivgrün mit gräulichem Anflug. Unterer Rücken, Bürzel und Oberschwanzdecken sind blaugrau mit grünlicher Tönung auf dem Bürzel. Längere Oberschwanzdecken und Steuerfedern sind dunkel blaugrau. Das mittlere Paar Steuerfedern trägt einen dunklen Schaftstrich, die übrigen schwarze Innenfahnen, das vorletzte zudem eine weiße Spitze und das äußere eine weiße Außenfahne, deren Weißfärbung sich im distalen Teil bis zur Mitte der Innenfahne ausdehnt. Die Schwanzaußenseiten erscheinen daher weiß. Die Oberflügeldecken sind graublau, wobei die Kleinen und Mittleren Armdecken etwas matter gefärbte Zentren, die Innenfahnen der Großen Armdecken und die Handdecken verdeckte schwarzgraue Zentren aufweisen. Die Großen Armdecken zeigen zudem weiße Spitzen, die eine weiße Flügelbinde bilden. Die Federn der Alula sind schwarz mit feinen weißen Säumen. Die Hand- und Armschwingen und die Schirmfedern sind überwiegend schwarzgrau. Die Schirmfedern sind zudem breit und hell grünlich gelb gesäumt mit weißem Spitzensaum. Die Schwingen sind mit Ausnahme der beiden äußeren Handschwingen schmal graublau gesäumt und weiß bespitzt, wobei die Spitzen auf den Handschwingen nur schwach ausgeprägt sind.[2][3]

Das Weibchen ähnelt stark dem Männchen, ist jedoch matter und oberseits dunkler gefärbt. Die Kopfplatte glänzt weniger stark bläulich und der Kehlfleck ist matter. Das schwarze Band, das auf den Halsseiten die Wangen einrahmt ist schmaler und manchmal unterbrochen. Das vertikale Brustband ist schmaler und matter gefärbt. Es wirkt oft an den Rändern unordentlicher und kann zum Bauch hin mit Weiß durchsetzt sein. Der dunkle Bauchfleck ist kleiner und an den Unterschwanzdecken ist oft mehr Weiß vorhanden. Die graublauen Säume der Armschwingen sind weniger auffällig.[2][3]
Jugendkleid
Das Jugendkleid ähnelt dem adulten Jahreskleid, ist jedoch sehr viel weniger ausgefärbt. Die Kopfseiten, das helle Band im Nacken und die Flügelbinde sind gelblich oder schmutzig weiß getönt. Die Kopfplatte und die Nackenseiten sind dunkel olivbraun bis dunkelgrau und ohne Glanz. Das dunkelgraue Brustband läuft auf der hinteren Brust aus. Das Großgefieder ist anstatt schwärzlich eher dunkelbraun. Die Säume der Oberflügeldecken und der Oberschwanzdecken sind matt olivgrün statt graublau. Die Unterschwanzdecken sind weißlich.[2][3] Der Schnabel ist im Unterschied zu adulten Vögeln eher hornfarben mit gelben Kanten und Schnabelwinkel, die Iris grauer.[2]
Die Geschlechter sind im Jugendkleid nicht leicht zu unterscheiden, die Unterschiede, die im Adultkleid vorhanden sind, deuten sich jedoch bereits an. So ist das dunkle Band an den Kopfseiten unterhalb des Wangenfelds beim Weibchen nicht vorhanden, das Band auf der Brustmitte nur sehr schwach oder fehlend. Das Großgefieder wirkt matter oder bräunlicher als beim Männchen. Bestes Unterscheidungsmerkmal sind aber die Säume der Handdecken, die beim Männchen bereits bläulich und deutlich abgesetzt sind, beim Weibchen jedoch diffus bräunlich, grünlich oder blassgrau sind.[4]
Mauser
Die Jugendmauser ist eine Teilmauser, bei der große Teile des Kleingefieders sowie Schirm- und Steuerfedern zu unterschiedlichen Anteilen vermausert werden. Der Umfang der Mauser bei Daumenfittich, Handdecken und Großen Armdecken variiert ebenso wie der von Schirm- und Steuerfedern je nach geografischer Lage, wobei er bei skandinavischen Vögeln sehr gering, bei nordosteuropäischen gering und bei west- und mitteleuropäischen meist vollständig ausfällt. Auch Vögel aus Zweitbruten mausern weniger vollständig. Südliche und westliche Populationen haben die Mauser vor dem Zug abgeschlossen, nordöstliche mausern teils noch auf dem Wegzug.[5]
Die jährliche Vollmauser adulter Vögel beginnt meist kurze Zeit nach der Nestlingsaufzucht, dauert etwa 70–100 Tage und liegt zwischen Mai und Oktober[2], beginnt aber in Mitteleuropa meist im Juni. Der individuelle Mauserbeginn kann sich innerhalb einer Population über zwei Monate erstrecken. Vögel mit Zweitbruten mausern meist später. Bei Weibchen ist der Mauserzeitraum oft kürzer als bei Männchen. In Fennoskandien setzt die Mauser wegen der verkürzten Brutsaison teils schon während der Jungenaufzucht ein und erfolgt wesentlich schneller.[5]
Stimme

Die Kohlmeise verfügt über ein außerordentlich reiches, variables und differenziertes Repertoire an Lautäußerungen, das sehr gut untersucht ist.[6]
Gesang
Der Reviergesang der Männchen ist eine Reihe metallisch reiner, hoher und lauter Motive aus typischerweise zwei, manchmal aber bis zu vier Silben verschiedener Tonhöhe,[6] die beispielsweise als tsi-da … tsi-da … tsi-da[7] oder zi-da-tit … zi-da-tit … zi-da-tit[8] wiedergegeben werden kann. Selten sind Mischstrophen aus z. B. abwechselnd zwei- und dreisilbigen Motiven oder unterschiedlichen Rhythmen.[9] Die Motive werden jeweils bis zu zehnmal wiederholt.[10] Mit längeren Pausen dazwischen wird die ganze Reihe mehrfach, bei intensivem Reviergesang im Frühjahr auch dauerhaft und nahezu ununterbrochen vorgetragen.[6] Nach mehreren Wiederholungen folgt oft ein Wechsel in ein anderes Motiv, wobei jedes Männchen ein Repertoire von 3–7, seltener von bis zu 18 verschiedenen Strophentypen hat.[10] Neben der Anzahl der Silben variieren Tempo, Lautstärke, Rhythmus und Betonung, Tonhöhe oder -folge sowie Anzahl und Abstand der Wiederholungen. Weitere Variationen sind für das menschliche Ohr kaum oder nur als „Unreinheiten“ wahrnehmbar, könnten aber die individuellen Haupterkennungsmerkmale sein.[9] Unterzieht man das Sonagramm einer feineren Analyse, lässt sich erkennen, dass eine scheinbar simple Strophe oft recht komplex aufgebaut ist und eigentlich aus bis zu sechs oder seltener bis zu zehn zusammengezogenen Silben bestehen kann.[10]
Der Reviergesang ist in seiner Ausprägung und Wirkung sehr gut untersucht. So können reviersuchende Männchen anhand des Gesangs die Populationsdichte eines Gebietes und auch – aufgrund von Strophenlänge und Umfang des Repertoires – die Kompetenz eines Rivalen bei der Revierverteidigung abschätzen. Männchen mit großem Gesangsrepertoire sind durchschnittlich dominanter und erfolgreicher. Revierinhaber reagieren kaum auf Gesang, der dem eigenen ähnlich ist, eher geringfügig auf den Gesang ihrer Nachbarn, wohl aber auf den fremder Eindringlinge. Weibchen suchen sich meist Männchen, deren Gesang dem des Vaters am wenigsten ähnelt.[11]
Rufe
Einer der häufigsten Rufe, der meist vom Männchen und vor allem außerhalb der Brutzeit zu hören ist, ist ein metallisches pink, das für sich allein kaum vom ähnlichen Ruf des Buchfinken zu unterscheiden ist. Es wird aber oft mehrfach wiederholt oder beispielsweise als zi-pink-pink-pink[12] mit anderen typischen Lauten verbunden und ist dann einfacher der Kohlmeise zuzuordnen. Dieser Ruf kann als Alarm-, Warn- oder Lockruf vorgebracht werden. Auch im Revierverhalten scheint er eine bedeutende Rolle als Ersatz des Reviergesangs außerhalb der Brutzeit zu spielen.[10][13]
Ein Ruf der Verärgerung oder Erregung bei herannahenden Bodenfeinden ist ein unmelodischer Laut, der zwischen einem schnarrenden trrrr oder einem gereihten dädädä liegen kann[14]. Er wird oft mit dem metallischen pink kombiniert.[13]
Als Kontaktruf zwischen Partnern kommen auf kurze Distanz ein leises, oft mehrfaches sit oder ein weiches dü zum Einsatz, auf größere Entfernung ein hohes, weich flötendes di düi,[15] das oft zum Ende hin stark in die Höhe gezogen wird. Sind Partner weiter voneinander entfernt, wird oft mit einzelnen Gesangsmotiven (z. B. idä) gelockt, haben sie den Sichtkontakt verloren, wird bisweilen eine ganze Reihe wie etwa didedidedi vorgebracht. Ein weiterer bei sozialen Kontakten zu hörender Laut ist ein hohes, kurzes i,[16] das in der Akzentuierung dem oben genannten pink nahekommt, jedoch weniger laut ist. Dem Gruppenzusammenhalt (beispielsweise bei einem Altvogel mit mehreren Jungen im Gefolge) dient ein si – wüwüwü.[17]
Namensgebung
Der Name Kohlmeise bezieht sich auf die „kohlschwarzen“ Partien am Kopf und ist bereits für das 15. Jahrhundert belegbar.[18] In der Bedeutung ähnlich sind früher ebenfalls gebräuchliche Namen wie „Brandmeise“, das eher unspezifische „Schwarzmeise“[18] oder der französische Name „Mésange charbonnière“.
Den Bezug auf die Körpergröße – wie beim englischen Great Tit – gab es auch im deutschen Sprachraum als „Große Kohlmeise“, „Großmeise“, „Große Waldmeise“ oder „Große schwarze Meise“. Im Unterschied dazu wurde die ähnliche Tannenmeise dann beispielsweise als „Kleine Kohlmeise“ oder „Kleine Waldmeise“ angesprochen.[18] Auch Linné wählte entsprechend den Namen Parus major (lateinisch maior, Komparativ von magnus = groß) in seiner Erstbeschreibung von 1758.[19]
Namen wie „Finkmeise“, „Meisenfink“ oder „Pinkmeise“ beschrieben eine der häufigen Lautäußerungen, die vom pink des Buchfinken kaum zu unterscheiden ist (siehe oben). Als „Speckmeise“, „Schinkenmeise“ oder „Talgmeise“ (preußisch „Talgmöske'“ oder „Talghacker“) wurde sie lokal bezeichnet, weil sie durchaus auch Fett, Speck oder Fleisch frisst, im Winter darum bei Hausschlachtungen beobachtet werden konnte oder Speck aus Speisekammern stibitzte. Die Verhaltensweise, Nahrung mit den Füßen festzuhalten und pickend aufzubereiten, prägte die Bezeichnung „Pickmeise“. Der früher in Sachsen gebräuchliche Name „Spiegelmeise“ bezieht sich hingegen auf die weißen Wangenfelder, der eher ungebräuchliche Name „Grasmeise“ wohl auf die Farbe.[18]
Verbreitung
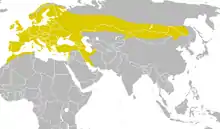
Das transpaläarktische Verbreitungsgebiet der Kohlmeise reicht über große Teile der gemäßigten Zone und Teile der Subtropen Eurasiens – von Portugal und den Britischen Inseln im Westen bis zum Dschagdy- und Burejagebirge im Osten Asiens. Es umfasst ganz Europa mit Ausnahme von Island, Orkney und Shetland, dem äußersten Norden und einigen Hochgebirgen Fennoskandiens sowie dem Norden Russlands. Die Nordgrenze der Verbreitung folgt im Westen Russlands noch dem Nordrand der mittleren Taiga, fällt aber nach Osten hin relativ kontinuierlich nach Süden ab, so dass sie im Bereich des Stanowoigebirges entlang des Nordrands der südlichen Taiga verläuft. In Nordwestafrika reicht das Areal durch die Atlasregion, im Mittelmeer schließt das Vorkommen südwärts noch die Balearen, Sardinien, Sizilien, Kreta und Zypern ein. Im Bereich der östlichen Mittelmeerküste reicht die Verbreitung im Süden bis an den Sinai und nach Jordanien. In Asien verläuft die Südgrenze etwa durch den Süden Anatoliens, durch Aserbaidschan, zur südlichen Küste des Kaspischen Meeres und durch das Elburs-Gebirge, ein Ausläufer erstreckt sich über das Zagrosgebirge.[20] Unter Auslassung der mittelasiatischen Trockengebiete reicht das Areal über die Oasen, Wälder und Gebirge Mittelasiens bis in den Norden Afghanistans und zum Tian Shan.[21] Die dort lebenden Populationen wurden lange als eigene Art (Turkestanmeise, siehe unten) abgegliedert. Weiter östlich reicht die südliche Verbreitungsgrenze durch den Altai und südlich vom Changai- und Chentii- bis zum Großen Hinggan-Gebirge sowie von dort bis in die Region von Chabarowsk.[20]
Systematik und geographische Variation
Bislang wurden der Kohlmeise meist 33 Unterarten zugerechnet, die in drei Subspeziesgruppen unterteilt wurden.[22] Drei weitere Unterarten wurden als eigene Art namens Turkestanmeise (Parus bokharensis) oder auch als vierte Subspeziesgruppe behandelt.[23] Untersuchungen der mitochondrialen DNA zufolge bildet die bokharensis-Gruppe (bokharensis, ferghanensis und turkestanicus) jedoch zusammen mit der major-Gruppe ein Monophylum, das sich von den beiden anderen Subspeziesgruppen deutlich abhebt. Dies wird auch durch Merkmale des Gesangs gestützt.[24] Heute werden die beiden ostpaläarktisch und indomalaiisch verbreiteten Gruppen daher als eigene Arten Parus minor und Parus cinereus anerkannt, die zusammen mit Parus major (inklusive bokharensis) eine Superspezies bilden.[25]

Bei den geographisch variierenden Merkmalen der Kohlmeise handelt es sich um die Pigmentierung der gelben Gefiederpartien und der Oberseite, die Ausdehnung der weißen Keile an Schwanzaußenseiten sowie Schnabel- und Körpergröße. Bei der letzteren ist eine leichte Größenabnahme von Nord nach Süd festzustellen, die aber bezüglich der durchschnittlichen Flügellänge nur einen maximalen Unterschied von 7 mm ausmacht und von alters- und geschlechtsbedingter Variation überlagert wird.[22] In Europa und Nordafrika nimmt von Nord nach Süd auch die Ausdehnung der weißen Schwanzaußenseiten ab, die bei tunesischen Vögeln auf ein Minimum reduziert sind. Von Kleinasien nimmt die Größe derselben dann ostwärts bis in den Südiran wieder zu, vom Nordwesten bis in den Nordosten des Irans jedoch wieder ab.[26]
Bezüglich der Intensität der Gelbfärbung sind – mit Ausnahme der nordafrikanischen Unterart excelsus, die lebhafter gefärbt ist – die südeuropäischen Unterarten blasser als die Nominatform und die sehr ähnliche Unterart newtoni. Zudem ist eine klinale (allmähliche) Abnahme der Intensität ostwärts über die Länder des nahen Ostens zu verzeichnen.[26]
Bei der bokharensis-Unterartengruppe Zentralasiens fehlt eine Pigmentierung mit gelben Lipochromen ganz – die Vögel sind unterseits nahezu weiß bis hellgrau. Der weiße Keilfleck der Schwanzaußenseiten dehnt sich mindestens über die beiden äußeren Steuerfederpaare aus. Der Schwanz ist proportional etwa um ein Viertel länger als bei den Formen der major-Gruppe und gestuft, der Handflügel stumpf. Die Vögel dieser Gruppe werden von West nach Ost größer, die Schnäbel kräftiger.[27][28]
Major-Gruppe
- P. m. aphrodite Madarász, 1901 – südliches Italien und südliches Griechenland, Ägäis und Zypern
- P. m. blanfordi Pražák, 1894 – südöstliches Aserbaidschan sowie nördliche Mitte und Südwesten des Irans
- P. m. corsus O. Kleinschmidt, 1903 – Portugal, Südspanien und Korsika
- P. m. ecki von Jordans, 1970 – Sardinien
- P. m. excelsus Buvry, 1857 – von Marokko ostwärts bis in den Norden Tunesiens
- P. m. kapustini Portenko, 1954 – südöstliches Kasachstan, äußerster Nordwesten der Volksrepublik Chinas und nordwestliche Mongolei, ostwärts bis nach Transbaikalien, zur Amurregion und zum Ochotskischen Meer
- P. m. karelini Zarudny, 1910 – südöstliches Aserbaidschan und nördlicher Iran
- P. m. major Linnaeus, 1758 – von Skandinavien südwärts bis zur nördlichen und mittleren Iberischen Halbinsel, Mittelitalien und Balkanhalbinsel, Kleinasien, Kaukasus, größter Teil Aserbaidschans sowie südliches Mittel- und Westsibirien
- P. m. mallorcae von Jordans, 1913 – Balearen
- P. m. newtoni Pražák, 1894 – Britische Inseln, Niederlande, Belgien und nordwestliches Frankreich
- P. m. niethammeri von Jordans, 1970 – Kreta
- P. m. terraesanctae Hartert, 1910 – Libanon, Syrien, Israel, Jordanien und nordöstliches Ägypten
Bokharensis-Gruppe (Turkestanmeise)
- P. m. bokharensis Lichtenstein, 1823 – südliche Mitte Kasachstans, Usbekistan, Turkmenistan und äußerster Nordosten des Irans, ostwärts bis in den Norden Afghanistans
- P. m. ferghanensis Buturlin, 1912 – Gebirge Tadschikistans und Kirgisistans, ostwärts bis in den westlichen Tian Shan
- P. m. turkestanicus Zarudny & Loudon, 1905 – vom südöstlichen Kasachstan ostwärts bis in den äußersten Nordwesten Chinas, möglicherweise südwestliche Mongolei
Wanderungen
Die Kohlmeise ist ein Teilzieher, dessen Zugverhalten insgesamt recht unüberschaubar ist und lokal, regional, großräumig und von Jahr zu Jahr stark variiert.[29] Die meisten Populationen südlicher und gemäßigter Breiten sind zum größten Teil Standvögel, die sich zudem nur selten weit von ihren Brutrevieren entfernen. So lagen etwa 80 % der Wiederfunde britischer Ringvögel innerhalb eines Radius von 10 km.[30] In Europa harren sogar nördlich des Polarkreises noch viele Kohlmeisen in den Brutgebieten aus. Oft sind Überwinterer dann an menschliche Siedlungen gebunden, jedoch scheint ohnehin das Zugverhalten vielerorts stark durch Winterfütterungen und andere anthropogene Nahrungsquellen beeinflusst zu sein. Im europäischen Teil Russlands und in Belarus deckt sich die Winterverbreitung mit der Verteilung größerer Siedlungen.[29]
Neben Brutvögeln höherer Lagen ziehen vor allem Teile nördlicher und östlicher Populationen regelmäßig, um extremer Kälte, heftigen Schneefällen oder der verkürzten Tageslichtspanne zu entkommen. Die Populationen des Urals ziehen beispielsweise vermutlich alljährlich, und an den Küsten des Schwarzen und des Kaspischen Meeres sind offenbar regelmäßig Wintergäste festzustellen. Meist werden die Wanderbewegungen kaum wahrgenommen, da nur ein Teil der Population wandert[29], in manchen Jahren kann es jedoch bei nordosteuropäischen und sibirischen Populationen zu ausgeprägten Evasionen kommen, die offenbar zum Teil mit Fehlmastjahren der Bucheckern korrelieren. Die Zugrichtung liegt dabei meist zwischen West und Südwest, die meisten der Invasionsvögel sind einjährige Vögel mit einem hohen Anteil an Weibchen. Einige verbleiben als Brutvögel in den Winterquartieren, es scheinen aber auch viele in die angestammten Brutgebiete zurückzukehren.[30]
Lebensraum
Die Kohlmeise brütet primär in Laub- und Mischwäldern, deren Baumbestand mit 60 oder mehr Jahren alt genug ist, um ein genügendes Angebot an Nisthöhlen zu gewährleisten, wobei sie auffallend häufiger in morschen Baumstubben als in Spechthöhlen nistet. In jüngeren Waldbeständen kommt sie nur vereinzelt vor,[31] in geschlossenen Waldgebieten besiedelt sie nur die Randbereiche,[32] Tallagen werden Bergwäldern vorgezogen. Die bevorzugte Waldzusammensetzung kann regional variieren, so finden sich in westlichen Mitteleuropa die höchsten Bestandsdichten in Eichenwäldern, weiter östlich hingegen in Nadelmischwäldern. Relativ niedrige Bestandsdichten werden in reinen Buchenwäldern erreicht; Kiefern- und Fichtenforste sind im Allgemeinen nur sehr dünn besiedelt.[31] In Sibirien zieht die Art Birken-, Weiden- und Mischwälder den reinen Nadelwäldern aus Fichten und Tannen vor. In Zentralasien besiedelt sie vor allem flussnahe Wälder.[32]
Aufgrund ihrer großen Anpassungsfähigkeit ist die Kohlmeise aber auch in zahlreichen anderen Habitaten mit altem Baumbestand oder künstlichen Nisthöhlen zu finden. Sie besiedelt neben Feldgehölzen, Baumgruppen, Hecken mit eingestreuten Bäumen, Parks, Friedhöfen, Olivenhainen und Obstgärten auch Gärten oder Grünflächen mit Einzelbäumen inmitten von Städten. In höheren Berglagen, in ausgeräumten Kulturlandschaften oder Trockengebieten ist sie in besonderer Weise an menschliche Siedlungen gebunden.[31][32]
Die Höhenverbreitung variiert je nach geografischer Lage. So kommt die Art in Schottland nur bis 500 m, im Alpenraum meist bis 1400, seltener aber bis 1950 m, im Mittelmeerraum bis etwa 1800 m und in den Gebirgen Asiens teils bis in 3000 m Höhe vor. Bisweilen kann man sie auch noch oberhalb der Baumgrenze finden.[32]
Außerhalb der Brutzeit tritt die Kohlmeise in allen erdenklichen Habitaten auf und wurde beispielsweise auch in baumlosen Steppengebieten festgestellt.[32]
Aufgrund des vom Menschen verursachten Klimawandels setzt die Rückkehr der Trauerschnäpper nach Europa im Frühling tendenziell immer früher ein; dadurch kommt es zu Konflikten mit der Kohlmeise, was die Trauerschnäpper wegen der Nahrungsmittel- und Nistplatzkonkurrenz zunehmend in Bedrängnis bringt, wobei der Vorteil der Kohlmeise darin besteht, sich ganzjährig in Europa aufzuhalten und dadurch Brutplätze vor dem Trauerschnäpper zu besetzen; in der Vergangenheit konnten beide Arten die Brutplätze nacheinander nutzen.[33]
Ernährung
(js)03.jpg.webp)
Die Kohlmeise ist in ihrer Ernährung wenig spezialisiert. Das Nahrungsspektrum ist daher sehr umfangreich, jedoch liegt der Schwerpunkt deutlich auf Insekten sowie deren Larven und Eiern. Ergänzend kommen regelmäßig andere Arthropoden – vor allem Spinnen und Weberknechte – hinzu. Je nach Verfügbarkeit, geografischer Lage und Jahreszeit werden aber auch teils ausgiebig andere Nahrungsquellen genutzt wie Sämereien, Nussfrüchte, Obst, vom Menschen zur Verfügung gestelltes Vogelfutter, Abfälle oder gelegentlich auch Aas.[34] Vor allem in den nördlichen Teilen des Verbreitungsgebiets können Sämereien, Bucheckern und Haselnüsse im Winter eine wichtige Nahrungsgrundlage bilden.[35] Um den Calciumbedarf zu decken, werden Teile von Schneckenhäusern und Eierschalen gefressen und auch an Nestlinge verfüttert.[36][37]
Die tierische Nahrung besteht zur Brutzeit vorwiegend aus Raupen von Eulenfaltern und Spannern. In Mitteleuropa sind dies beispielsweise je nach Lebensraum insbesondere die häufigen Arten Eichenwickler, Kleiner Frostspanner oder Kieferneule. An die Jungen werden meist besonders große Raupen verfüttert. Bei geringem Angebot an Raupen können Spinnentiere eine größere Rolle als Nestlingsnahrung einnehmen. Bedeutend sind zudem auch Imagines und Larven von Zweiflüglern, Käfern und Hautflüglern. Außerhalb der Brutzeit stellen Larven von Blattwespen und Buschhornblattwespen sowie Imagines von Schlupfwespen, manchmal aber auch Hummeln, Bienen oder Wachsmotten einen bedeutenden Teil der Beute. An anderen Wirbellosen werden neben Spinnentieren vor allem auch Doppelfüßer, Pseudoskorpione oder Asseln gefressen. Andere Insektengruppen oder Wirbellose werden nur gelegentlich als Nahrung angenommen. Zeitweise kann auch sehr kleine Nahrung wie Blattläuse, Hornmilben oder verschiedene Insekteneier an Bedeutung gewinnen. Unter den Sämereien werden vor allem Veilchen- und Sauerkleesamen gefressen, im Winter gelegentlich Birken- und nur selten auch Fichtensamen. Bei Beeren oder Obst sind offenbar eher die Samen als das Fruchtfleisch von Bedeutung.[34]
Im Unterschied zu anderen Meisen sucht die Kohlmeise ihre Nahrung seltener in den äußeren, feinen Zweigen im Kronendach von Bäumen oder in Sträuchern, sondern bewegt sich eher auf den unteren, kräftigeren Ästen und Zweigen, im Stammbereich oder am Boden. Die Gewohnheiten können jedoch je nach Jahreszeit stark wechseln. So werden zur Brutzeit häufig die Raupen blattfressender Schmetterlingsarten auch von feineren, hoch gelegenen Zweigen abgelesen und vor allem im Winter ist die Art bei der Nahrungssuche viel am Boden anzutreffen.[38] Wenn nötig, wird die Nahrung vor dem Fressen aufbereitet und dabei wie bei vielen Meisenarten auf einen Zweig gebracht und mit den Füßen festgehalten. Gelegentlich wird sie dazu auch in Ritzen oder Zweiggabelungen geklemmt. Größere Raupen werden getötet und ungenießbare oder schädliche Teile entfernt. Bienen werden beispielsweise entstachelt und manche Raupen enthaart. Die Kohlmeise vermag auch, Haselnüsse aufzuhacken, was etwa zehn Minuten dauern kann.[39]
Die Kohlmeise ist im Notfall sehr erfindungsreich im Erschließen neuer Nahrungsquellen und dabei auch sehr lernfähig. Ein bekanntes Beispiel dafür ist das Öffnen der Folienverschlüsse von Milchflaschen in Großbritannien – ein Verhalten, das sich schnell über einige Landesteile ausbreitete.[40] Neben menschlichen Vorräten werden teils auch die anderer Meisenarten genutzt. Die Bedeutung von Winterfütterungen kann lokal sehr unterschiedlich ausfallen. Während sie besonders in kalten Regionen, höheren Lagen oder ausgeräumten Landschaften eine essentielle Rolle für das Überleben spielen kann, stellt sie in den gemäßigten Breiten eher eine Ergänzung dar und trägt im Notfall offenbar nur teilweise zum Überleben einer Population bei.[37] In extremen Ausnahmefällen wie beispielsweise besonderen Kältewintern tötet die Kohlmeise auch kleinere Vögel[38] oder andere Wirbeltiere wie überwinternde Fledermäuse.[41] Es werden dann meist nur kleinere Teile wie das Gehirn oder ein Teil der Flugmuskulatur verspeist.[38]
Verhalten
Die Kohlmeise verhält sich meist recht auffällig und ist wenig scheu. Sie bewegt sich überwiegend hüpfend und kletternd im Geäst oder auf dem Boden. Oft wird dies durch Flügelschläge oder kurze Gleitphasen unterstützt. Seltener als andere Meisen hängt sie kurzzeitig kopfüber an Zweigen. Sie ist auch in der Lage, wie ein Kleiber kopfüber an einem Stamm abwärts zu klettern. Aufgrund der relativ kurzen, runden Flügel und der langen Steuerfedern fliegt sie wendig und schnell durch das Geäst von Bäumen oder Unterholz. Freies Gelände wird meist nur zögerlich in recht langsamem, bogenförmigem Flug überflogen.[42]
Die Kohlmeise ist tagaktiv und zeigt ganzjährig in den frühen Morgenstunden die höchste Aktivität. Außerhalb der Brutzeit gibt es zudem abends ein zweites Aktivitätsmaximum. Der Gesang setzt kurz nach der bürgerlichen Dämmerung ein und erreicht seine höchste Intensität etwa eine Viertel- bis halbe Stunde später. Im Winterhalbjahr, teils auch schon vermehrt nach der Mauser, nächtigen Kohlmeisen in Höhlen. Der Schlaf ist sehr fest, wobei der Vogel an den Höhlenboden gekauert oder an eine Nistkastenwand angeschmiegt ist und den Kopf bei eingezogenem Hals schräg in die Höhe richtet.[43] Sehr kalte Nächte überstehen Kohlmeisen, indem sie ihre Körpertemperatur von üblicherweise 41,8 °C auf 32 °C absenken und so wenig Energie verbrauchen.[35] Ab dem Frühjahr nimmt die Neigung, in Nistkästen zu schlafen, ab.[43]
Sozialverhalten
.jpg.webp)
Bald nach dem Flüggewerden schließen sich junge Kohlmeisen mit diesjährigen Vögeln aus anderen Bruten zu Schwärmen von für gewöhnlich unter 30 Exemplaren[44] zusammen, zu denen sich bisweilen auch Altvögel gesellen. Zunächst ist die Zusammensetzung und Größe solcher Trupps noch sehr variabel. Innerhalb des Trupps werden viele Rangstreitigkeiten ausgetragen und die jungen Männchen versuchen zum Herbst hin, eigene Reviere zu etablieren. Es bilden sich ausgeprägte hierarchische Strukturen aus, bei denen unter anderem Männchen über Weibchen, ältere über jüngere, territoriale über nicht territoriale Vögel oder Reviereigner über „Gäste“ dominieren. Die Sterblichkeit unter den diesjährigen Vögeln ist sehr hoch und dauerhaft unterlegene Individuen verlassen den Schwarm, um abzuwandern, so dass sich die Anzahl der Vögel zum Winter hin halbieren kann.[45][46]
Der verbliebene Trupp durchstreift den Winter über ein Gebiet, dessen Grenzen nicht näher definiert sind und das sich mit denen anderer Trupps überschneiden kann.[47] Zudem umfasst ein solches Gebiet meist mehrere Reviere territorialer Männchen, von denen die Trupps aber geduldet werden. Häufig schließen sie und ihre Weibchen sich auch den Schwärmen an. Dieses Verhalten kann regional sehr unterschiedlich ausgeprägt sein. In südlichen Gebieten, wo die meisten Paare sehr standorttreu sind, ist der Anschluss an Schwärme seltener, als im nördlichen Teil des Verbreitungsgebiets, wo Wanderverhalten und Schwarmbildung ausgeprägter sind. Hier bietet die Nahrungssuche im Schwarm mehr Effizienz und damit oft größere Vorteile, als die ständige Behauptung eines Reviers.[45][46]
Der Zusammenhalt der Wintertrupps ist am Vormittag am stärksten; gegen Nachmittag können sie sich teilweise oder ganz zerstreuen.[45] Oft mischen sich die Trupps auch mit anderen Meisen, Schwanzmeisen, Kleibern, Baumläufern, Buchfinken oder Wintergoldhähnchen. Der Zusammenhalt mit diesen ist aber nur lose und basiert meist auf der Nutzung gleicher Nahrungsquellen. Innerhalb gemischter Meisentrupps ist die Kohlmeise dominanter als die kleineren Arten.[47]
Antagonistisches Verhalten
.jpg.webp)
Vor allem vor dem Winter und zu Beginn der Brutzeit treten zwischen Kohlmeisen häufig Auseinandersetzungen auf. Im Herbst dienen diese der Festlegung der Hierarchie im Winterschwarm, zum Teil aber auch dem Erwerb oder der Verteidigung eines Territoriums. Festigt sich die Rangordnung im Laufe der Zeit, nimmt die Häufigkeit von Konflikten ab. Territoriales Verhalten gewinnt nach einer ruhigeren Zeit im Winter dann vermehrt wieder im Frühjahr an Bedeutung.[45] Oft reicht das Drohen dominanter Vögel, um einen Artgenossen in die Schranken zu weisen. Teils kommt es aber auch zu erbitterten Kämpfen, die bei der Kohlmeise besonders heftig ausfallen können.[48]
Außerhalb der Brutzeit wird Aggressivität durch flaches Anlegen des Kopfgefieders ausgedrückt, wohingegen aufgestelltes Kopfgefieder das Gegenteil – Erschrecken oder Unterlegenheit – bekundet. Bei intensiverem Drohen wird zudem der Körper in eine leichte Schrägstellung gebracht und der Kopf gesenkt (head-down). Beim „Vorwärtsdrohen“ (head-forward, horizontal posture) nimmt der Vogel eine horizontale Stellung ein und streckt den Schnabel vor. Bisweilen werden auch Angriffe gegen Konkurrenten geflogen.[49]
Zur Brutzeit ist unter Rivalen die „Kopf-hoch-Stellung“ (head-up posture) zu beobachten, bei der sich der imponierende Vogel mit senkrecht gehaltenem Kopf hoch aufrichtet und das schwarze Brustband zeigt. Zudem werden unter Drehen des Kopfes die weißen Wangenfelder präsentiert. Auch beim „Steilflug“ wird das schwarze Brustband präsentiert, während der Angreifer in vertikaler Haltung auf den Rivalen zufliegt. Das Imponierverhalten kann zu einem Rückzug des Rivalen, seltener aber auch zu Kämpfen führen. Dabei gehen zwei Rivalen flügelschlagend und hoch aufgerichtet aufeinander los. Teils wird vorab oder zwischendurch imponierend auf Zweige oder Pflanzenteile in der Umgebung eingehackt. Oft beginnen Kämpfe in der Luft bis die Vögel auf den Boden fallen, sich mit den Füßen ineinander verkrallen und aufeinander einhacken. Die Schnabelhiebe zielen dabei auf den Kopf des Rivalen. Kämpfe sind meist kurz und dauern allenfalls 30–50 Sekunden.[50]
Fortpflanzung
Kohlmeisen werden gegen Ende des ersten Lebensjahres geschlechtsreif; es schreiten jedoch nicht alle Einjährigen zur Brut. Da der Anteil an Männchen in den meisten Populationen überwiegt, finden insbesondere junge Männchen oft keine Partnerin. Es gibt jedoch auch einen zunehmenden Anteil an Nichtbrütern unter mehrjährigen Vögeln.[51]
Kohlmeisen führen eine monogame Saisonehe. In Fällen, in denen bei einer zweiten Jahresbrut der Partner ein anderer ist, ist dies meist auf den Verlust des vorigen Partners zurückzuführen. Aufgrund der hohen Ortstreue kommt es in mehreren aufeinanderfolgenden Jahren oft zu Wiederverpaarungen und langjährige Dauerehen wurden nachgewiesen. Außerhalb der Brutzeit besteht jedoch kaum Zusammenhalt zwischen Partnern.[52]
Zwei Jahresbruten sind nicht selten.[53] In Südengland finden eher in Nadel- und Mischwäldern Zweitbruten statt. In Eichenwäldern, in denen früh im Jahr ein Überangebot an Insektennahrung, später jedoch ein Mangel herrscht, brütet die Art jedoch meist nur einmal.[54] Drittbruten kommen vor, sind aber selten. Ausnahmsweise kommt es in Israel zu Bruten im Winterhalbjahr.[53]
Die Brutzeit liegt zwischen März und Juli. In Israel wurden teils bereits ab Ende Januar Gelege festgestellt.[53] In Frankreich, Tschechien, den Beneluxländern und Süddeutschland fällt die Hauptlegezeit in die zweite Aprilhälfte, in England, Mittel- und Norddeutschland zwischen die dritte April- und erste Maidekade und in Fennoskandien und Russland liegt sie zwischen Ende April und Mitte Mai. Drittgelege findet man teils noch um Anfang August. Herbst- oder sogar Winterbruten kommen vor, sind aber sehr seltene Ausnahmen.[55]
Paarbildung und Balz
Paarbildung und Balz können in Mitteleuropa ab Februar oder März stattfinden, bei schlechter Witterung aber auch erst im April.[56] Mit zunehmendem Revierverhalten der Männchen brechen nun die Winterschwärme auseinander. Anfänglich verhalten sich Männchen auch gegen Weibchen noch aggressiv; dies lässt aber nach, wenn die Weibchen nicht nach Art der Männchen darauf reagieren. Bestandteil des Paarverhaltens ist die Inspektion von potentiellen Nisthöhlen, die auch bereits im Verlauf des Winters stattfinden kann. Dabei fliegt das Männchen auffällig zum Schlupfloch und pickt auf dem Rand herum. Sitzt es außen, ist das weißliche Nackenband sehr auffällig; schaut es heraus, fällt die schwarz-weiße Gesichtszeichnung auf.[57]
Zur Paarungszeit ist der Paarzusammenhalt recht eng. Das Männchen wird morgens sehr früh aktiv und holt das Weibchen vom Schlafplatz ab – unter anderem, um Fremdkopulationen zu verhindern.[57] Diese scheinen jedoch nicht selten vorzukommen, da sich in bis zu 34 % der Bruten Nachkommen fremder Väter finden.[58] Kopulationen finden meist in den frühen Morgenstunden in dichterem Gezweig in der Nähe der Bruthöhle statt. Sie können von beiden Partnern eingeleitet werden. Dazu nehmen die Vögel eine geduckte Haltung mit zurückgelegtem Kopf und erhobenem Schwanz ein, zittern mit leicht abgespreizten Flügeln und geben typische Rufe von sich. Mit kurzen Pausen steigt die Erregung an, bis der Paarungsakt erfolgt ist, nach dem die Partner meist ein Stück weit voneinander weg fliegen. Kurz vor der Ablage der ersten Eier setzt das Balzfüttern ein, bei dem das Weibchen vom Männchen mit Nahrung versorgt wird. Dieses Verhalten nimmt in der Zeit der Eiablage stark an Häufigkeit zu.[57]
Nistplatz und Nestbau

Der Nistplatz wird vom Weibchen aus einer Vorauswahl des Männchens bestimmt.[53] Es handelt sich dabei oft um Baumhöhlen wie Buntspecht- oder Fäulnishöhlen, manchmal aber auch tiefe Rindenspalten, die im unteren Stammbereich zwischen 3 und 6 m liegen. Bei starker Konkurrenz durch überlegene Arten wie beispielsweise Stare weicht die Kohlmeise oft in Höhen von unter 3,5 m aus. Fehlt die Konkurrenz, werden auch Höhlen bis in etwa 15 m Höhe oder mehr gewählt. In morsches Holz kann die Kohlmeise auch selber eine Bruthöhle hacken oder diese erweitern. Ist ein gutes Angebot an Nistkästen vorhanden, werden diese oft bevorzugt. Bisweilen werden auch Nester anderer Vögel, Erdhöhlen, Mauernischen oder zahlreiche Arten von anderen Hohlräumen oder Halbhöhlen an menschlichen Strukturen als Brutplatz angenommen.[59]
Das Nest wird fast ausschließlich vom Weibchen gebaut. Die Bauzeit kann sehr unterschiedlich sein. Bei frühen Erstbruten kann sie sich über einen Monat hinziehen, bei späteren reduziert sie sich auf etwa ein bis zwei Wochen; bei Ersatz- oder Zweitbruten werden manchmal nur 1–2 Tage benötigt. Die Größe des Nestes variiert je nach Größe der Höhle. Besonders tiefe Höhlen werden mit einer dicken Schicht aus Moos aufgefüllt. Zudem kann der kunstlose, ungeordnete Unterbau aus Würzelchen, Grashalmen, Kiefernnadeln oder Flechten bestehen. Dort hinein wird eine Mulde von 4,5–7,5 cm Durchmesser und 3,5–7 cm Tiefe gebaut und mit Tierhaaren, Federn, Basthalmen oder anderem feinen Material ausgekleidet.[60]
Gelege und Bebrütung

Das Gelege besteht meist aus 6–12, manchmal aus 3–15 rundovalen Eiern von 17,5 ×13,5 mm Größe und schwach glänzenden Eiern, die auf weißem Grund sehr variabel ziegelrot bis rotbraun gefleckt, bekleckst oder gesprenkelt sind. Die Zeichnung kann regelmäßig verteilt, am stumpfen Pol konzentriert oder kranzähnlich, grob oder fein, reichlich oder spärlich sein und selten auch ganz fehlen. Die Eier werden meist früh morgens im Abstand von 24 Stunden gelegt. Bei langanhaltenden Kälteperioden kann die Eiablage zeitweilig unterbrochen werden. Das Gelege wird ausschließlich vom Weibchen bebrütet, das in dieser Zeit vom Männchen gefüttert wird.[51]
Ab Beginn der Eiablage nächtigt das Weibchen auf dem Nest. Um ein möglichst gleichzeitiges Schlüpfen der Jungen herbeizuführen, wird das unvollständige Gelege anfangs lediglich zu Beginn der Nacht angewärmt, was ein allzu starkes Auskühlen verhindert. Danach verbringt das Weibchen die Nacht stehend über den Eiern, so dass die für die Embryonalentwicklung erforderliche Minimaltemperatur von 25 °C unterschritten wird. Später steigt dann die Dauer der Bebrütung pro Nacht, jedoch wird das Gelege meist erst mit der Ablage der letzten Eier permanent bebrütet.[61] Die Brutdauer kann zwischen 10 und 17 Tagen liegen. Sie variiert je nach geografischer Lage und liegt in Mitteleuropa meist zwischen 12 und 15 Tagen. Bei Zweitbruten ist die Brutdauer meist kürzer.[56][62]
Wird das Weibchen auf dem Nest gestört, nimmt es eine charakteristische Abwehrhaltung ein, bei der der Schwanz aufgespreizt und die Flügel flatternd gegen die Höhlenwand geschlagen werden. Dabei macht es einen zischenden Laut und stellt das Gefieder der weißen Wangenflecken auf. Am Ende des Zischlauts folgt ein Schnabelknappen und mit einem Flügelschlag wird ein dumpfes Geräusch erzeugt. Vermutlich dient dieses Verhalten der Abschreckung von Prädatoren und soll die Anwesenheit einer Schlange vortäuschen. Es kann auch bei Individuen, die in Höhlen übernachten, sowie in ähnlicher Form bei einigen anderen Meisenarten beobachtet werden.[53]
Aufzucht der Jungen

Die Jungen schlüpfen meist über 1 bis 5 Tage verteilt. Bei den ersten Eiern kann die Schlüpfreihenfolge von der der Eiablage abweichen, bei den mittleren bis letzten ist sie fast immer entsprechend.[62] Die Nestlinge werden nur vom Weibchen gehudert – meist zwischen 5 und 7 Tage lang. Beide Partner füttern, jedoch steigt der Anteil des Weibchens nach dem Hudern stark an – manchmal auf bis zu 90 %. Es werden fast nur einzelne Beutestücke verfüttert, die aber meist recht groß sind. Sie werden den Jungen oft mehrfach in den Schlund gesteckt und herausgeholt bis gewährleistet ist, dass die Position optimal ist und das Junge schlucken kann. Nach der Fütterung warten die Altvögel einen Moment auf die Kotabgabe. In den ersten Tagen wird der Kot von den Eltern gefressen, später davongetragen.[61] Die Nestlingszeit liegt meist zwischen 16 und 22 Tagen[53], in Mitteleuropa meist zwischen 17 und 20 Tagen.[56]
Nach dem Ausfliegen werden die Jungen meist noch etwa 6 bis 10 Tage gefüttert, manchmal aber auch bis zu 25 Tage lang. Bei Zweitbruten beträgt dieser Zeitraum meist 14 bis 22 Tage oder länger.[53][61]
 Frisch geschlüpfte Kohlmeisen
Frisch geschlüpfte Kohlmeisen Jungtiere, wenige Stunden vor dem Verlassen des Nestes
Jungtiere, wenige Stunden vor dem Verlassen des Nestes Väterliche Fütterung eines Jungvogels
Väterliche Fütterung eines Jungvogels
Erkrankungen
Parasitäre Infektionen mit Haemosporidien, wie beispielsweise Haemoproteus, Plasmodium oder Leucocytozoon, sind bei Kohlmeisen ausgesprochen häufig. Bei einer in den Jahren 2009 bis 2011 durchgeführten Studie im Kanton Waadt lag die Prävalenz bei adulten Kohlmeisen bei über 90 %.[64]
Kohlmeisen können an Vogelpocken erkranken. In Südengland wurde diese Viruserkrankung erstmals im Jahr 2006 beobachtet. Die Zahl der Infektionsfälle nimmt Jahr für Jahr zu und die Erkrankung breitet sich weiter aus. Im Gegensatz zu Vogelpocken bei Nicht-Meisen sind die Pocken vergleichsweise groß, ulzerierend und haben einen käseartigen Kern.[63][65] Darüber hinaus gibt es Berichte von Vogelpocken bei Kohlmeisen unter anderem aus Österreich,[66] Ungarn[67] und Tschechien.[68] In Deutschland waren bis 2012 zwei Fälle beobachtet worden.[68] Auch in Südengland ist die Erkrankung vergleichsweise selten. Zwischen 2006 und 2010 wurden 211 Fälle bei Kohlmeisen berichtet. Im Vergleich dazu lag der Bestand an Kohlmeisen in Großbritannien im Jahr 2006 bei etwa 5,7 Millionen Exemplaren.[63]
Bestand
Mit 5,6 bis 7,0 Millionen Brutpaaren im Jahr 2016 wird die Kohlmeise als dritthäufigste Brutvogelart in Deutschland angesehen, ungefähr gleichauf mit der Mönchsgrasmücke.[69]
In ganz Europa wird die Anzahl der Brutpaare auf 65 bis 106 Millionen geschätzt.[70]
Mensch und Kohlmeise
Vogel des Jahres
Die Kohlmeise war Vogel des Jahres 2011 in Armenien und 2016 in Estland[71].
Literatur
- Urs N. Glutz von Blotzheim, Kurt M. Bauer (Hrsg.): Handbuch der Vögel Mitteleuropas. Band 13/1: Passeriformes (4. Teil): Muscicapidae – Paridae. AULA-Verlag, Wiesbaden 1993, ISBN 3-89104-022-9, S. 678–808, (Auch als: Handbuch der Vögel Mitteleuropas. Das größte elektronische Nachschlagewerk zur Vogelwelt Mitteleuropas auf CD-ROM für PC + MAC. Vogelzug-Verlag im Humanitas-Buchversand, Wiebelsheim 2001, ISBN 3-923527-00-4).
- Simon Harrap, David Quinn: Chickadees, Tits, Nuthatches and Treecreepers. Princeton University Press, Princeton NJ 1995, ISBN 0-691-01083-8.
- Hans-Günther Bauer, Einhard Bezzel, Wolfgang Fiedler (Hrsg.): Das Kompendium der Vögel Mitteleuropas. Einbändige Sonderausgabe der 2., vollständig überarbeiteten Auflage. Aula-Verlag, Wiebelsheim 2012, ISBN 978-3-89104-758-3.
Weblinks
- Parus major in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: BirdLife International, 2008. Abgerufen am 30. Januar 2009.
- Videos, Fotos und Tonaufnahmen zu Parus major in der Internet Bird Collection
- Tonaufnahmen zur Kohlmeise (Parus major) bei xeno-canto
- Javier Blasco-Zumeta, Gerd-Michael Heinze: Geschlechts- und Altersbestimmung bei Kohlmeisen (PDF; 4,4 MB) (englisch), abgerufen am 3. Dezember 2012.
- Federn der Kohlmeise, abgerufen am 12. Juli 2013.
- Zeitraffervideo eines Weibchens beim Nestbau und bei der Eiablage, abgerufen am 12. Juli 2013.
Einzelnachweise
- L. Svensson, P. J. Grant, K. Mularney, D. Zetterström: Der neue Kosmos-Vogelführer, Franckh-Kosmos Verlags-GmbH, Stuttgart 1999, ISBN 3-440-07720-9, S. 316
- Harrap/Quinn (1995), S. 361, siehe Literatur
- Glutz von Blotzheim, S. 685, siehe Literatur
- Harrap/Quinn (1995), S. 354, siehe Literatur
- Glutz von Blotzheim, S. 693f, siehe Literatur
- E. Tretzel in Glutz von Blotzheim, S. 696f
- Hörbeispiel
- Hörbeispiel
- E. Tretzel in Glutz von Blotzheim, S. 698
- Harrap/Quinn (1995), S. 354f
- E. Tretzel in Glutz von Blotzheim, S. 700f
- Hörbeispiel
- E. Tretzel in Glutz von Blotzheim, S. 701f
- Hörbeispiel
- Hörbeispiel
- Hörbeispiel
- E. Tretzel in Glutz von Blotzheim, S. 702f
- Peter Bertau: Die Bedeutung historischer Vogelnamen – Singvögel (Band 2), Springer Spektrum, Springer Verlag, Berlin/Heidelberg 2014, ISBN 978-3-642-41817-4
- J. A. Jobling: Key to Scientific Names in Ornithology (2015) in: J. del Hoyo, A. Elliott, J. Sargatal, A. D. Christie, E. de Juana (Hg.): Handbook of the Birds of the World Alive, Lynx Edicions, Barcelona 2015
- Glutz von Blotzheim, S. 678, 680 (Karte) und 714f
- Harrap/Quinn (1995), S. 88 und 367f, siehe Literatur
- Harrap/Qinn (1995), S. 361f, siehe Literatur
- Jürgen Haffer, Urs Glutz in Glutz von Blotzheim, S. 678f, siehe Literatur
- Martin Päckert, Jochen Martens: Taxonomic pitfalls in tits – comments on the Paridae chapter of the Handbook of the Birds of the World, Ibis 150, 2008, S. 829–831 (PDF, abgerufen am 3. Dezember 2012)
- IOC World Bird List, Version 6.1, 2016, doi:10.14344/IOC.ML.6.1, abgerufen am 31. Januar 2016
- Jürgen Haffer, Urs Glutz in Glutz von Blotzheim, S. 681 f., siehe Literatur.
- Harrap/Quinn (1995), S. 90–91 und 367–371, siehe Literatur
- Jürgen Haffer, Urs Glutz in Glutz von Blotzheim, S. 682, siehe Literatur.
- H. Hudde in Glutz von Blotzheim, S. 720f, siehe Literatur
- Harrap/Quinn (1995), siehe Literatur
- Glutz von Blotzheim, S. 737f, siehe Literatur
- Harrap/Quinn (1995), S. 357, siehe Literatur
- J.M. Samplonius and C. Both (2019). Climate Change May Affect Fatal Competition between Two Bird Species. Curr. Biol. 29.
- Glutz von Blotzheim, S. 791f, siehe Literatur
- Harrap/Quinn (1995), S. 360, siehe Literatur
- Glutz von Blotzheim, S. 792, siehe Literatur
- Glutz von Blotzheim, S. 795, siehe Literatur
- Glutz von Blotzheim, S. 774, siehe Literatur
- Glutz von Blotzheim, S. 775, siehe Literatur
- Glutz von Blotzheim, S. 640 und 775, siehe Literatur
- Péter Estók, Sándor Zsebők, Björn M. Siemers: Great tits search for, capture, kill and eat hibernating bats, Biology Letters, September 2009, doi:10.1098/rsbl.2009.0611
- Glutz von Blotzheim, S. 770f, siehe Literatur
- Glutz von Blotzheim, S. 772, siehe Literatur
- Glutz von Blotzheim, S. 779, siehe Literatur
- Harrap/Quinn (1995), S. 359
- Glutz von Blotzheim, S. 775f, siehe Literatur
- Glutz von Blotzheim, S. 778f, siehe Literatur
- Glutz von Blotzheim, S. 787, siehe Literatur
- Glutz von Blotzheim, S. 781f, siehe Literatur
- Glutz von Blotzheim, S. 784, siehe Literatur
- Glutz von Blotzheim, S. 740f, siehe Literatur
- Glutz von Blotzheim, S. 741, siehe Literatur
- Harrap/Quinn (1995), S. 360
- Glutz von Blotzheim, S. 755, siehe Literatur
- Glutz von Blotzheim, S. 753f, siehe Literatur
- Bauer et al. (2012), S. 107, siehe Literatur
- Glutz von Blotzheim, S. 780f, siehe Literatur
- Thomas Lubjuhn: Fremdgehen mit Folgen? Kosten und Nutzen von Fremdkopulationen bei Vögeln, Vogelwarte 43, 2005, S. 3–13
- Glutz von Blotzheim, S. 741f, siehe Literatur
- Glutz von Blotzheim, S. 743f, siehe Literatur
- Glutz von Blotzheim, S. 786f, siehe Literatur
- Glutz von Blotzheim, S. 758, siehe Literatur
- B. Lawson, S. Lachish u. a.: Emergence of a novel avian pox disease in British tit species. In: PloS one. Band 7, Nummer 11, 2012, S. e40176, ISSN 1932-6203. doi:10.1371/journal.pone.0040176. PMID 23185231. PMC 3504035 (freier Volltext).
- J. v. Rooyen, F. Lalubin u. a.: Altitudinal variation in haemosporidian parasite distribution in great tit populations. In: Parasites & vectors. Band 6, 2013, S. 139, ISSN 1756-3305. doi:10.1186/1756-3305-6-139. PMID 23648230. PMC 3658882 (freier Volltext).
- S. Lachish, M. B. Bonsall u. a.: Individual and population-level impacts of an emerging poxvirus disease in a wild population of great tits. In: PloS one. Band 7, Nummer 11, 2012, S. e48545, ISSN 1932-6203. doi:10.1371/journal.pone.0048545. PMID 23185263. PMC 3504048 (freier Volltext).
- A. Gruber, E. Grabensteiner u. a.: Poxvirus infection in a great tit (Parus major). In: Avian diseases. Band 51, Nummer 2, Juni 2007, S. 623–625, ISSN 0005-2086. PMID 17626497.
- E. A. Palade, N. Biro u. a.: Poxvirus infection in Hungarian great tits (Parus major): case report. In: Acta veterinaria Hungarica. Band 56, Nummer 4, Dezember 2008, S. 539–546, ISSN 0236-6290. doi:10.1556/AVet.56.2008.4.11. PMID 19149108.
- I. Literak, P. Kulich u. a.: Avipoxvirus in great tits (Parus major). In: European J Wildlife Res. Band 6, 2010, S. 529–534.
- C. Sudfeldt, R. Dröschmeister, C. Grüneberg, S. Jaehne, A. Mitschke, J. Wahl: Vögel in Deutschland 2008. (PDF; 8,4 MB) Herausgegeben von DDA, BfN und LAG VSW, Münster 2008, S. 7.
- BirdLife International (2017) European birds of conservation concern: populations, trends and national responsibilities Cambridge, UK: BirdLife International.
- Rasvatihane. Aasta lind 2016. In: www.eoy.ee. Eesti Ornitoloogiaühing, abgerufen am 11. Juli 2021 (estnisch).
