Chlorkohlenwasserstoffe
Chlorkohlenwasserstoffe bilden eine Stoffgruppe organischer Verbindungen und eine Untergruppe der Halogenkohlenwasserstoffe. Diese chemischen Stoffe besitzen ein Kohlenwasserstoff-Grundgerüst, bei dem eines oder mehrere Wasserstoff-Atome durch Chlor ersetzt sind. Ihre chemischen Eigenschaften machen sie für die Industrie fast unverzichtbar, andererseits besitzen sie zumeist ein großes umweltschädigendes Potential.
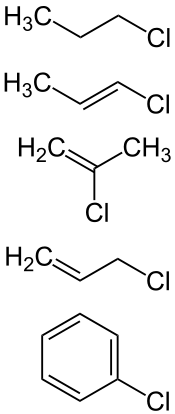
Chloralkan (1-Chlorpropan), Chloralkene (1-Chlorpropen, 2-Chlorpropen, 3-Chlorpropen),
Chloraromat (Chlorbenzol)
Viele Pflanzenschutzmittel, insbesondere Herbizide und Insektizide, enthalten chlororganische Verbindungen. Auch in der Kunststoffherstellung (etwa von PVC) oder als Flammschutzmittel spielen sie eine wichtige Rolle. Zahlreiche Stoffe wie PCB und Lindan, die man lange als äußerst nutzbringend ansah und breit anwendete, wurden wegen erwiesener Schädlichkeit für Mensch und Umwelt mittlerweile wieder verboten. Bei einigen Umweltskandalen der letzten Jahrzehnte spielten solche Verbindungen eine zentrale Rolle, etwa bei der PCB-Verschmutzung der Krupa.
Einteilung und Eigenschaften
Die vielen bekannten Chlorkohlenwasserstoffe können in die Aliphaten Chloralkane und Chloralkene sowie aromatische Chlorkohlenwasserstoffe eingeteilt werden. Mit zunehmendem Chlorierungsgrad wächst die Stabilität und die Lipophilie (Fettlöslichkeit) der Substanzen. Dadurch wird für abbauende Mikroorganismen die Aufnahme erschwert und die zum Abbau der Substanzen notwendige Aktivierungsenergie erhöht sich. Die erhöhte Hydrophobizität (Wasserunlöslichkeit) der Substanzen bewirkt außerdem eine Anreicherung in tierischem Fettgewebe.
Durch die hohe Elektronegativität von Chlor haben viele Chlorierte Kohlenwasserstoffe stark ausgeprägte Dipolmomente, wodurch sie oft hohe Dielektrizitätskonstanten ergeben.
- Chloralkane
- Methylchlorid
- Dichlormethan
- Trichlormethan (Trivialname Chloroform),
- Tetrachlormethan (Tetrachlorkohlenstoff),
- Lindan (γ-Hexachlorcyclohexan) ist ein cyclischer Vertreter der Chloralkane.
- Chloralkene
- Chloralkine
- Aromatische Chlorkohlenwasserstoffe
- Chlorbenzol,
- 1,4-Dichlorbenzol,
- DDT (Dichlordiphenyltrichlorethan).
- Sauerstoff- oder Stickstoffhaltige Derivate von Chlorkohlenwasserstoffen
- CS-Gas (2-Chlorbenzyliden-malonsäuredinitril),
- TCDD (der giftigste Vertreter aus der Stoffklasse der Dioxine).
- Carbonsäurechloride – z. B. Acetylchlorid, ein Derivat der Essigsäure
Diese sind strenggenommen keine Chlorkohlenwasserstoffe, da sie neben Kohlenstoff, Wasserstoff und Chlor weitere Elemente wie Stickstoff oder Sauerstoff enthalten.
Geschichte
Chlororganika werden seit den 1930er-Jahren zum Beispiel durch Photochlorierung synthetisch hergestellt. Die Einführung eines Chloratoms in das Kohlenstoffgerüst hat oft eine Verringerung der Brennbarkeit einer organischen Verbindung zur Folge. Chlororganika werden deshalb häufig als nicht brennbare organische Lösungsmittel, Hydrauliköle und Kältemittel eingesetzt. Sie finden auch als Synthesevorstufen oder Pflanzenschutzmittel Verwendung.
Natürliches Vorkommen
Lange Zeit wurde vermutet, es gäbe kaum natürliche Quellen für chlorierte organische Verbindungen. Durch leistungsfähige Analytik gelang allerdings in den letzten Jahren immer öfter der Nachweis von natürlichen Organohalogenen wie dem Bipyrrol Q1.
Eine wichtige Quelle von natürlich gebildeten, chlorierten aromatischen Verbindungen sind holzabbauende Pilze. Einige Pilze sind interessanterweise sogar zur De-novo-Synthese von Chloranisylen aus Glucose fähig.[1][2]
Inzwischen sind über 3.800 Organohalogene natürlichen Ursprungs bekannt. Mit Ausnahme des in den Meeren erzeugten Methylchlorids und des Bipyrrol Q1 liegen die Konzentrationen der meisten anderen Verbindungen aber weit unterhalb denen anthropogenen Ursprungs.[3][4] Die große Vielfalt der natürlich vorkommenden halogenierten organischen Verbindungen und ihre weite Verbreitung ist sicher ein Grund für die Abbaubarkeit der anthropogenen Schadstoffe.[5]
Siehe auch
Literatur
- Otto Hutzinger: Gott schuf 91 Elemente, der Mensch etwas mehr als ein Dutzend und der Teufel eines — das Chlor. In: Umweltwissenschaften und Schadstoff-Forschung, 1990, 2, 2, S. 61, doi:10.1007/BF02936893.
Einzelnachweise
- E. de Jong, A. E. Cazemier, J. A. Field and J. A. M. De Bont (1994). Physiological role of chlorinated aryl alcohols biosynthesized de novo by the white rot fungus Bjerkandera sp. strain BOS55. Appl Environ Microbiol 60(1): S. 271–277.
- E. de Jong, J. A. Field, H.-E. Spinnler, J. B. P. A. Wijnberg and J. A. M. De Bont (1994). Significant biogenesis of chlorinated aromatics by fungi in natural environments. Appl Environ Microbiol 60(1): S. 264–270.
- E. J. Hoekstra, E. W. B. De Leer (1995). Organohalogens: The natural alternatives. Chem Br February: S. 127–131.
- Gordon W. Gribble: The diversity of naturally produced organohalogens. In: Chemosphere. 52, 2003, S. 289–297, doi:10.1016/S0045-6535(03)00207-8.
- M. M. Häggblom, V. K. Knight, L. J. Kerkhof (2000). Anaerobic decomposition of halogenated aromatic compounds. Environmental Pollution 107: S. 199–207.