Tetrabrommethan
Tetrabrommethan (auch Tetrabromkohlenstoff) ist eine chemische Verbindung aus der Reihe der Bromkohlenwasserstoffe. Bei ihm sind alle Wasserstoffatome des Methans durch Bromatome substituiert. Beide Bezeichnungen sind nach der IUPAC-Nomenklatur korrekt, abhängig davon, ob die Verbindung als organische (Tetrabrommethan) oder anorganische (Tetrabromkohlenstoff) Verbindung angesehen wird. Die Verbindung ist der vierfachsubstituierte Vertreter der Reihe der Brommethane mit Brommethan, Dibrommethan, Tribrommethan und Tetrabrommethan.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
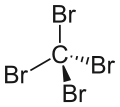 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetrabrommethan | |||||||||||||||
| Andere Namen |
Tetrabromkohlenstoff | |||||||||||||||
| Summenformel | CBr4 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle mit süßlichem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 331,63 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,9608 g·cm−3 (100 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
189,5 °C[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,5942 (100 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 1,4 mg·m−3[3] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
29,4 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Tetrabrommethan wird durch Bromierung von Methan mit elementarem Brom hergestellt. Ökonomischer ist der Halogenaustausch durch die Reaktion von Tetrachlormethan mit Aluminiumbromid bei 100 °C.[6]
Eigenschaften
Physikalische Eigenschaften
Tetrabrommethan ist ein farbloser, nicht brennbarer Feststoff mit einem Schmelzpunkt von 90,1 °C, der bei Raumtemperatur in Form von monoklinen Kristallen vorliegt. Der Siedepunkt liegt bei 189,5 °C. Tetrabrommethan ist in Wasser so gut wie nicht, in unpolaren Lösungsmitteln wie Chloroform oder Toluol sehr gut löslich.
Bedingt durch die kugelförmige Gestalt des CBr4-Moleküls, hat Tetrabrommethan eine ausgesprochen hohe kryoskopische Konstante von 80 K·kg·mol−1. Das heißt, dass in CBr4 gelöste Stoffe eine recht hohe Schmelzpunkterniedrigung bewirken. Es ist deshalb als Lösungsmittel für die Methode der Molmassenbestimmung nach Rast sehr gut geeignet.[7][8]
Tetrabrommethan ist polymorph, das heißt, es tritt in zwei Modifikationen (α-Modifikation und β-Modifikation) auf, die sich bei 46,9 °C ineinander umwandeln.[9][10]
Die Bindungsenergie der C–Br-Bindung beträgt 235 kJ·mol−1.[6]
Bedingt durch die hochsymmetrische tetraedrische Struktur liegt das Dipolmoment bei 0 Debye. Die kritische Temperatur beträgt 439 °C (712 K) bei einem kritischen Druck von 4,26 MPa.[9] Nach einer anderen Quelle beträgt die Kritische Temperatur 724,8 K (451,65 °C), und der Kritische Druck 96,3 bar, entsprechend 9,63 MPa.[11]
Chemische Eigenschaften
Tetrabrommethan ist deutlich weniger stabil als die beiden leichteren Tetrahalogenmethane Tetrafluormethan und Tetrachlormethan. Es gibt recht leicht ein Brom-Atom ab, weshalb es als mildes Bromierungsmittel verwendet werden kann.
Verwendung
In Kombination mit Triphenylphosphin wird CBr4 in der sogenannten Appel-Reaktion[12] verwendet, um Alkohole in Alkylbromide umzusetzen.
Tetrabromkohlenstoff kann zur p-Dotierung von Gallium-Arsenid mit Kohlenstoff (GaAs:C) mittels Molekularstrahlepitaxie (MBE) verwendet werden.[13]
Aufgrund seiner hohen Dichte im geschmolzenen Zustand kann Tetrabrommethan als Schwerflüssigkeit zum Trennen von Mineralien verwendet werden.
Literatur
- Wendan Cheng, Juan Shen, Dongsheng Wu, Xiaodong Li, Youzhao Lan, Feifei Li, Shuping Huang, Hao Zhang, Yajing Gong: Electronic Origin for Enhanced Nonlinear Optical Response of Complexes from Tetraalkylammonium Halide and Carbon Tetrabromide: Electrostatic Potentials of Intermolecular Donor-Acceptor Dyads, in: Chemistry – A European Journal, 2006, 12 (26), S. 6880–6887; doi:10.1002/chem.200501415.
Weblinks
Einzelnachweise
- Eintrag zu Tetrabrommethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-468.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 558-13-4 bzw. Tetrabromkohlenstoff), abgerufen am 17. Mai 2020.
- Datenblatt Tetrabrommethan (PDF) bei Merck, abgerufen am 2. Januar 2013.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 359.
- M. Brandstätter, L. Kofler: Molekulargewichtsbestimmung unter dem Mikroskop, in: Microchimica Acta, 1949, 34, S. 364–373.
- H. Keller, H. von Halban: Über eine Modifikation der mikro-kryoskopischen Molekulargewichts-Bestimmung nach Rast, in: Helvetica Chimica Acta, 1944, 27, S. 1439–1443.
- F. Brezina, J. Mollin, R. Pastorek, Z. Sindelar: Chemicke tabulky anorganickych sloucenin (Chemical tables of inorganic compounds). SNTL, 1986.
- A. Pavlovska, D. Nenow: Experimental study of the surface melting of tetrabrommethane, in: Journal of Crystal Growth, 1977, 39 (2), S. 346–352; doi:10.1016/0022-0248(77)90284-6.
- VDI-Wärmeatlas [Elektronische Ressource] / VDI-Gesellschaft Verfahrenstechnik und Chemieingenieurwesen (Hrsg.). Springer, 2006.
- R. Appel: Tertiary Phosphane/Tetrachloromethane, a Versatile Reagent for Chlorination, Dehydration, and P–N Linkage, in: Angew. Chem. Int. Ed. Engl., 1975, 14 (12), S. 801–811; doi:10.1002/anie.197508011.
- Q. F. Huang: Carbon doping in GaAs using carbon tetrabromide in solid source molecular beam epitaxy, in: Journal of Crystal Growth, 2003, 252 (1–3), S. 37–43; doi:10.1016/S0022-0248(02)02503-4.

