Radiumsulfat
Radiumsulfat (RaSO4) ist das Radium-Salz der Schwefelsäure.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
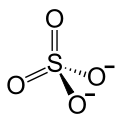 | ||||||||||
| Allgemeines | ||||||||||
| Name | Radiumsulfat | |||||||||
| Summenformel | RaSO4 | |||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 322,06 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Löslichkeit |
schwer löslich in Wasser (2,1 mg·l−1 bei 18 °C)[2] | |||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||

Radioaktiv | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Das Radiumsulfat kann durch längeres Kochen von radiumhaltigen Salzlösungen und festem Bariumsulfat durch Anreicherung gewonnen werden. Im Bariumsulfat werden dabei die Barium-Ionen bis zu einem Gleichgewicht durch Radium-Ionen ersetzt. Reines Radiumsulfat wird hergestellt, indem lösliche Radiumsalzlösungen, z. B. das Chlorid, mit einem löslichen Sulfat, z. B. Natriumsulfat, umsetzt.[1]
Eigenschaften
Radiumsulfat besteht in reinem Zustand aus weißen rhombischen Kristallen, die sich im Laufe der Zeit, verursacht durch Radiolyse, gelb verfärben.[4] Radiumsulfat ist in Wasser schwerlöslich. Es ist isomorph mit Bariumsulfat BaSO4 und das Sulfat mit der geringsten bekannten Löslichkeit überhaupt. In konzentrierter Schwefelsäure steigt die Löslichkeit merklich an.[1]
Einzelnachweise
- Gmelins Handbuch der Anorganischen Chemie. System Nummer 31: Radium. Achte Auflage. Verlag Chemie, Berlin 1927, S. 61–62.
- H. W. Kirby, Murrell L. Salutsky: The Radiochemistry of Radium. Subcommittee on Radiochemistry, National Academy of Sciences, 1964, abgerufen am 28. Februar 2017.
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Dale L. Perry, Sidney L. Phillips: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 0-8493-8671-3, S. 326–327.