Strontiumsulfat
Strontiumsulfat ist eine chemische Verbindung aus der Gruppe der Strontiumverbindungen und Sulfate.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
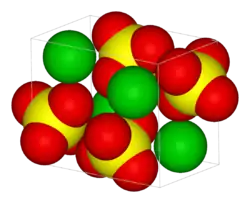 | |||||||||||||||||||
| _ Sr2+ _ S6+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Strontiumsulfat | ||||||||||||||||||
| Andere Namen |
Strontium(II)-sulfat | ||||||||||||||||||
| Verhältnisformel | SrSO4 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 183,68 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,96 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (0,11 g/l bei 30 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,622[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
Natürlich kommt Strontiumsulfat in Form des Minerals Coelestin und im Skelett der Strahlentierchen von Arten der Acantharia vor.
Gewinnung und Darstellung
Strontiumsulfat kann durch Fällung von Sulfaten (wie zum Beispiel Natriumsulfat, Calciumsulfat) in Strontiumhydroxid oder einer Strontiumchloridlösung hergestellt werden.
Eigenschaften
Strontiumsulfat ist ein weißer, nicht brennbarer Feststoff. Er zersetzt sich bei einer höheren Temperatur als 1580 °C.[1]
Es besitzt eine orthorhombische Kristallstruktur ähnlich der von Bariumsulfat (siehe dazu Coelestin).
Verwendung
Strontiumsulfat wird in der Pyrotechnik (rote Flammenfärbung), der Analytik und als Pigment (Strontiumweiß) verwendet.[1] Es dient weiterhin der Herstellung von Strontium (ausgehend vom Mineral) sowie anderer Strontiumverbindungen und wird als Bestandteil von Keramiken eingesetzt.
Einzelnachweise
- Eintrag zu Strontiumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2019. (JavaScript erforderlich)
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, 2003, ISBN 978-0-070-49439-8, S. 560–576 (eingeschränkte Vorschau in der Google-Buchsuche).