Borcarbid
Borcarbid (Summenformel B4C) ist ein sehr hartes Material mit einer Mohshärte von 9,3, welches als verschleißbeständiges Material genutzt wird. Borcarbid wird häufig als Metallcarbid klassifiziert, was aber sehr umstritten ist, da Bor keine metallischen Eigenschaften aufweist. Die Differenz der Elektronegativität zwischen Bor und Kohlenstoff ist deutlich kleiner als 1,5; somit sind im Unterschied zu den metallischen (Einlagerungs-)Carbiden wie Titancarbid (TiC) kovalente Nichtmetall-Nichtmetall-Bindungen vorhanden.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
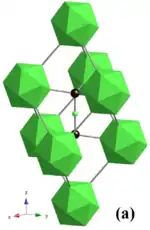 | |||||||||||||||||||
| Kristallstruktur von B4C. Grün: B12-Ikosaeder und Boratome. Schwarz: Kohlenstoffatome | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Borcarbid | ||||||||||||||||||
| Andere Namen |
Schwarzer Diamant | ||||||||||||||||||
| Verhältnisformel | B4C | ||||||||||||||||||
| Kurzbeschreibung |
glänzende schwarze Kristalle oder schwarzes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 55,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,51 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
>3500 °C[1] | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung

Je nach Herstellungsverfahren erhält man Borcarbid als feines schwarzes Pulver oder in Gestalt grober, schwarz glänzender Kristalle.
Das grobkristalline Borcarbid fällt bei der Herstellung aus Bortrioxid und Kohlenstoff im elektrischen Widerstandsofen bei 2400 °C an:
- Herstellung von grobkristallinem Borcarbid
Das feinkristalline Pulver entsteht bei der Reduktion von Bortrioxid mit Magnesium in Gegenwart von Kohlenstoff:
- Herstellung von pulverförmigem Borcarbid
Eigenschaften
Physikalische Eigenschaften
Borcarbid ist eine Nichtoxid-Keramik, die sich ähnlich wie Siliciumcarbid oder Siliciumnitrid durch besondere Härte und Zähigkeit auszeichnet. Borcarbid-Keramik ist sehr verschleißbeständig bei niedrigen Temperaturen. In ihrer Härte ist sie bei niedrigen Temperaturen verschleißbeständiger als Siliciumnitrid-Keramiken (siehe unten).
Borcarbid ist ein effektiver Neutronenabsorber und wurde z. B. bei der Katastrophe von Tschernobyl in den explodierten Reaktor abgeworfen, um die Kettenreaktion einzudämmen.
Verschleißmechanismus
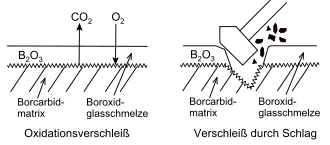
Borcarbid verschleißt ebenso wie andere Werkstoffe mechanisch, indem durch Krafteinwirkung (Schlag, Reibung) Teile des Gefüges herausgebrochen werden. Da aber Borcarbid ein sehr harter Werkstoff ist, unterliegt er diesem Verschleiß nur in geringem Maße. Ähnlich hart und verschleißbeständig sind Siliciumnitrid oder Siliciumcarbid.
Borcarbid widersteht der Oxidation durch Passivierung, indem die Oberfläche des Materials mit Sauerstoff reagiert:
- bzw.
Bei der Reaktion ist die Temperatur wesentlich, infolge des Boudouard-Gleichgewichts kann je nachdem Kohlenstoffmonoxid oder Kohlenstoffdioxid entstehen. Das gebildete Bortrioxid ist ein Festkörper, der in kristalliner Form bei 450 °C schmilzt, in amorpher oder glasiger schon bei niedrigerer Temperatur. Seine Schmelze hindert den Sauerstoffzutritt in die Borcarbid-Matrix, so dass deren weitere Oxidation behindert wird. Allerdings werden bei Verschleißanwendungen häufig Temperaturen deutlich über 450 °C erreicht, bei denen Bortrioxid sehr geringe Viskositäten besitzt. Dann kann Luftsauerstoff leichter durch die Bortrioxidschmelze diffundieren. Bei der Oxidation der konkurrierenden Werkstoffe Siliciumnitrid und Siliciumcarbid entsteht dagegen Siliciumdioxid, das wesentlich zähflüssiger ist als Bortrioxid und durch dessen Schmelze der Luftsauerstoff deshalb weniger diffundiert. Siliciumnitrid oder Siliciumcarbid widerstehen deshalb der Oxidation besser.
Chemische Eigenschaften
Borcarbid ist ein chemisch sehr inertes Material. Es wird erst oberhalb von 1000 °C von Chlor oder Sauerstoff merklich angegriffen. Gegen Fluorwasserstoff und heiße Salpetersäure ist es vollkommen beständig.
Verwendung
- Panzerungsmaterial
- Neutronenabsorber in Kernkraftwerken
- Werkstoff für Sandstrahldüsen
Einzelnachweise
- Eintrag zu Barcarbid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Dezember 2014.
- Datenblatt Borcarbid bei AlfaAesar, abgerufen am 9. Februar 2010 (PDF) (JavaScript erforderlich).
- Datenblatt Borcarbid bei Sigma-Aldrich, abgerufen am 14. März 2011 (PDF).
