Ölfleckversuch
Der Ölfleckversuch ist ein Versuch aus der Chemie und Physik, der es mit einfachen Mitteln möglich macht, sowohl die Größe eines Atoms als auch die Avogadrozahl näherungsweise zu bestimmen.

Historisches
Einen solchen Versuch führte Benjamin Franklin auf dem Mount Pond in Clapham Common aus und berichtete darüber 1774.[1][2] Ein Teelöffel Öl breitete sich auf dem glatten See auf einem halben Acre aus (mit einer Geschwindigkeit, die Franklin überraschte), was zu einer Dicke von rund 10−10 Metern schließen lässt (einen Schluss, den Franklin allerdings nicht vollzog). Franklin war damals noch nicht an Moleküldimensionen interessiert (sonst hätte er dadurch eine Abschätzung gehabt unter der Annahme, dass der Ölfilm die Dicke eines Moleküls hat), sondern wie andere Wissenschaftler seiner Zeit an Methoden mit Öl die Wasserwogen zu glätten. Auch seine Zeitgenossen, nicht einmal sein Freund Joseph Priestley, zogen diesen Schluss; die Idee von Moleküldimensionen war damals noch nicht im Interesse von Wissenschaftlern und Priestley selbst hielt es sogar für möglich, dass Moleküle unendlich klein seien. Der Beitrag von Franklin geriet bald darauf in Vergessenheit, in Großbritannien auch wegen seiner Beteiligung am Unabhängigkeitskrieg der USA. Interesse daran erwachte erst wieder Ende des 19. Jahrhunderts, als Lord Rayleigh (der Franklins Experiment kannte) ihn in öffentlichen Vorlesungen in der Royal Institution 1890 wiederholte (auch zur Demonstration der Glättung von Wellen) und in den Proceedings der Royal Society daraus Moleküldimensionen abschätzte. Weitere Wiederholungen veröffentlichten Agnes Pockels 1892 und Irving Langmuir 1917.[3]
Versuchsaufbau
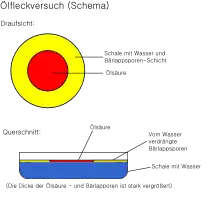

Auf eine mit Wasser gefüllte Schale wird eine feine Schicht Bärlappsporen – oder ein ähnliches Pulver – gepudert. Diese dienen dazu, die Wasseroberfläche besser sichtbar zu machen. Anschließend wird ein Tropfen eines Gemischs aus Ölsäure und Petrolether oder Leichtbenzin mit bekannter Konzentration und zuvor bestimmtem Volumen in die Mitte der Schale gegeben. Die chemische Formel der Ölsäure muss ebenfalls bekannt sein. Der Petrolether oder das Leichtbenzin dienen einer gleichmäßigen schnellen Verteilung der Ölsäure auf dem Wasser und der Verdünnung der Ölsäure, die sich so besser in sehr kleinen Mengen dosieren lässt. Der Petrolether oder das Leichtbenzin verdunstet schnell, ein Fleck aus reiner Ölsäure verbleibt auf der Wasseroberfläche. Dieser verdrängt die Bärlappsporen kreisförmig an den Rand der Schale, weshalb er deutlich sichtbar ist und mit einem Lineal vermessen werden kann. Im Idealfall entsteht ein perfekter Kreis; meist „zerfranst“ jedoch der Rand.
Auswertung
Von grundlegender Bedeutung ist die Annahme, dass es sich bei dem Ölfleck um eine monomolekulare Schicht handelt, das heißt, dass sich nicht mehrere Moleküle übereinander befinden. Dies kann man durch einfache Zusatzversuche belegen. Gibt man einen weiteren, gleich großen Öltropfen hinzu, verdoppelt sich der Flächeninhalt genau (d. h., der Radius vergrößert sich um den Faktor ). Zudem ist es nicht möglich, den Fleck z. B. durch Pusten zu vergrößern.
Berechnung der Molekülgröße
Einen möglichst runden Fleck kann man nun als Zylinder betrachten, wobei der Durchmesser eines Moleküls der Höhe des Zylinders entspricht.
Über das Volumen des Tropfens und die Konzentration der Petrolether(Benzin)-Ölsäure kann man nun das Volumen der reinen Ölsäure ausrechnen, das mit dem des Zylinders identisch ist. Mit dem abgemessenen Radius kann man nun die Höhe des Zylinders berechnen. Dadurch hat man bereits die Größe eines Ölsäuremoleküls.
Berechnung der Atomgröße

In der einfachsten Form der Berechnung geht man von würfelförmigen Molekülen und Atomen aus. Da man nun die Kantenlänge kennt, kann man wiederum das Volumen eines Moleküls berechnen.
Aus der chemischen Formel der Ölsäure kann man erkennen, aus wie vielen Atomen ein Molekül besteht. Man geht nun davon aus, dass alle Atome gleich groß sind und das Volumen des Moleküls vollständig ausfüllen. Teilt man also das Volumen eines Moleküls durch die Anzahl der Atome, erhält man das Volumen eines Atoms. Da man wieder eine Würfelform verwendet, kann man den Durchmesser eines Atoms berechnen. Je nach Genauigkeit der Durchführung erhält man einen Atomradius von etwa Metern, angesichts der Einfachheit des Versuchs ein sehr genauer Wert.
Berechnung der Avogadrozahl
Da man nun die Kantenlänge eines Moleküls kennt, kann man die Anzahl an Molekülen im Ölfleck ausrechnen, indem man das Volumen des Öls durch das Volumen eines Moleküls dividiert. Über die Definition der Avogadrozahl weiß man, dass sich die Anzahl der Moleküle des Ölflecks zur Avogadrozahl so verhält wie die Masse des Öls im Ölfleck zu der Masse eines Mols Öl (Molare Masse oder Molmasse), welche man aus der chemischen Formel und den Angaben des Periodensystems entnehmen kann. Auch das Ergebnis der Avogadrozahl liegt in der richtigen Größenordnung, je nach Versuch etwa zwischen 5·1023 und 7·1023, also nahe beim wirklichen Wert von 6,022·1023.[4]
Mathematischer Ansatz
Klärung der Formelzeichen
Bekannte oder gemessene Größen:
- = Radius des Ölflecks
- = Volumen eines Tropfens
- = Volumen des Öls in einem Tropfen
- = Dichte des Öls
- = Molare Masse des Öls
Zwischenergebnisse:
- = Höhe des zylinderförmigen Ölflecks und damit Durchmesser eines Ölsäuremoleküls, in der Modellvorstellung von würfelförmigen Molekülen die Kantenlänge eines Moleküls
- = Volumen eines Ölsäuremoleküls
- = Volumen eines Atoms
- = Durchmesser eines Atoms, in der Modellvorstellung von würfelförmigen Atomen die Kantenlänge eines Atoms
- = Anzahl der Ölmoleküle im Ölfleck
- = Masse des Öls
Gesuchte Größen:
- = Radius eines Atoms
Benötigte mathematische Formeln
- (Volumen eines Zylinders)
- (Aufgelöst nach )
- (Volumen eines Würfels)
- (Aufgelöst nach )
Berechnung der Molekülgröße
Berechnung der Atomgröße
Berechnung der Avogadrozahl
Zahlenbeispiel
Molare Masse der Ölsäure
Die Masse eines Kohlenstoffatoms beträgt 12 u, die eines Sauerstoffatoms 16 u und die eines Wasserstoffatoms 1 u. Aus der Formel der Ölsäure C17H33COOH erkennt man, dass ein Molekül aus 18 Kohlenstoff-, 2 Sauerstoff- und 34 Wasserstoffatomen besteht. Die Molekülmasse beträgt damit 282 u, womit die Molare Masse der Ölsäure 282 g/mol beträgt.
Rechnung
Weblinks
Einzelnachweise und Anmerkungen
- Franklin, Philosophical Transactions of the Royal Society, Band 64, 1774, S. 445
- Der Versuch von Franklin wurde am Originalort von Charles Giles wiederholt. Giles, Chem. Ind., 1969, S. 1616. Mit Fotos.
- Charles Tanford, Ben Franklin Stilled the Waves: An Informal History of Pouring Oil on Water with reflections on the up and downs of scientific life in general, Oxford UP 2004, S. 138f.
- Streng genommen misst man auf diese Weise das Verhältnis der Masseneinheit Gramm zur Atomaren Masseneinheit u. Seit der Reform der Maßeinheiten 2019 ist dieser Quotient nicht mehr definitionsgemäß die Avogadro-Zahl, sondern eine davon unabhängige, experimentell zu bestimmende Zahl. Aber der Unterschied beträgt deutlich weniger als ein Milliardstel und kann hier ignoriert werden.