Mastzelltumor des Hundes
Der Mastzelltumor des Hundes ist eine von Mastzellen ausgehende Neubildung (Neoplasie) beim Haushund, die vor allem in der Haut und Unterhaut auftritt. Mastzelltumore sind bei Hunden nicht nur außerordentlich häufig, sondern neigen bei ihnen auch wesentlich häufiger zu bösartigen Verläufen als bei anderen Tierarten. Die mittlere Überlebenszeit beträgt bei bösartigen Tumoren nur vier Monate, bei gutartigen dagegen über zwei Jahre.
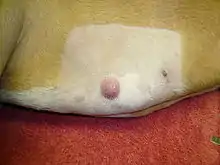

Mastzellen sind Zellen des Immunsystems, die eine Rolle bei der angeborenen Immunantwort spielen. Sie produzieren eine Reihe von biologisch aktiven Substanzen, darunter vor allem Histamin. Mastzelltumoren machen etwa ein Fünftel aller Hauttumoren des Hundes aus. Sie zeigen sich als Knoten oder erhabene Flecken, bei etwa einem Fünftel betroffener Tiere treten Geschwüre und Blutungen im Magen und Zwölffingerdarm auf. Tochtergeschwulste bei bösartigen Mastzelltumoren treten vor allem in Lymphknoten, Leber, Milz und im Knochenmark auf. Jeder Knoten in der Haut oder Unterhaut kann ein Mastzelltumor sein. Der Nachweis ist nur durch eine Gewebeentnahme mit einer feinen Kanüle (Feinnadelbiopsie) mit anschließender Färbung und mikroskopischer Untersuchung (Zytodiagnostik) möglich.
Obwohl die Einteilungen nach den klinischen Erscheinungen und dem Zellbild in der Zytodiagnostik Hinweise auf das biologische Verhalten (gut- oder bösartig) und damit die Heilungsaussicht geben, ist diese Tumorerkrankung unberechenbar und sollte frühzeitig behandelt werden. Mittel der Wahl ist die vollständige chirurgische Entfernung, die eventuell auch mit einer Strahlen- oder Chemotherapie kombiniert wird. Tumoren, bei denen eine chirurgische Entfernung nicht oder nur unvollständig möglich ist, können auch mit Tyrosinkinase-Inhibitoren behandelt werden.
Mastzelltumoren kommen auch bei Hauspferden, Frettchen und Hauskatzen häufiger vor, verhalten sich bei diesen Tierarten aber meist gutartig. Bei anderen Tierarten und beim Menschen sind Mastzelltumore sehr selten.
Mastzelle
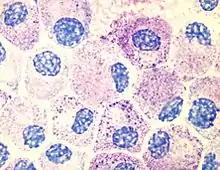
Mastzellen (Mastozyten) sind Zellen des Immunsystems und stellen ein wichtiges Bindeglied zwischen der angeborenen und erworbenen Immunantwort dar. Sie entstehen aus Vorläuferzellen im Knochenmark und wandern als unreife Zellen in viele Gewebe, vor allem in solche mit engem Kontakt zur Außenwelt, wo sie ausdifferenzieren.
Reife Mastzellen sind rundliche Zellen im Bindegewebe, deren Cytoplasma Granula mit abweichendem Färbeverhalten (Metachromasie) enthält. Die Granula sind gespeichertes Histamin, Heparin sowie Zytokine wie der Tumornekrosefaktor-α. Auf der Zelloberfläche tragen Mastzellen Bindungsstellen (Rezeptoren), von denen zwei funktionell die größte Bedeutung haben: Der Stammzellfaktor-Rezeptor (Tyrosinkinase KIT) reguliert über die Bindung des Stammzellfaktors die Differenzierung, Vermehrung, Aktivierung und Lebensdauer der Mastzellen. Der Immunglobulinrezeptor FcεRI (high-affinity IgE receptor) bindet Immunglobulin E (IgE) mit hoher Bindungsstärke (Affinität).[1] Nicht nur der Stammzellfaktor, sondern auch eine Reihe von Interleukinen[2] und Ultraviolettstrahlung[3] führen zu einer Aktivierung und Vermehrung von Mastzellen. Bei der Aktivierung von Mastzellen werden von ihnen Entzündungsmediatoren, Zytokine und Proteasen entweder aus den Granula freigesetzt oder in kurzer Zeit neu gebildet und abgegeben.[1]
Am besten ist die Funktion der Mastzellen bei Allergien erforscht, darüber hinaus sind sie auch an Autoimmunerkrankungen und an der Verstärkung der Entzündungsreaktionen bei bakteriellen Infektionen beteiligt. Anderseits können Mastzellen auch entzündungshemmend wirken, da sie vor schädigenden Faktoren wie Bakterien und Parasiten schützen.[4] Zudem können Mastzellen durch ihr großes Repertoire biologisch aktiver Substanzen zur Entstehung und zum Wachstum anderer Hauttumoren beitragen.[3]
Vorkommen und Entstehung
Mastzelltumoren kommen beim Hund vor allem in der Haut und Unterhaut vor. Sehr selten sind sie in inneren Organen wie dem Dünndarm[5], der Maulschleimhaut[6], der Nasenschleimhaut[7] oder der Bindehaut[8] anzutreffen. Etwa 20 % aller Hauttumoren[9] beziehungsweise 6 % aller Tumoren[10] beim Hund sind Mastzelltumoren. Gehäuft treten sie bei einigen Rassen auf: Deutscher Boxer und verwandte kurzköpfige Rassen, Golden Retriever, Beagle, Irish Setter, Dackel und Berner Sennenhund. Eine Abhängigkeit vom Geschlecht des Tieres besteht nicht.[9][11] Das mittlere Alter betroffener Hunde beträgt acht Jahre, ein Mastzelltumor kann aber bereits bei vier Monate alten Hunden oder erst in einem sehr hohen Alter entstehen.[10]
Beim Menschen sind eine Reihe von Mutationen und Chromosomenveränderungen bekannt, die zur krankhaften Vermehrung von Mastzellen (Mastozytosen) führen. Mutationen des Gens für den Stammzellfaktor-Rezeptor (c-KIT) führen zu einer verlängerten Zelllebensdauer und vermehrten Neubildung von Mastzellen. Die D816V-Mutation ist die häufigste dieser c-KIT-Mutationen und tritt bei 80 % der Patienten mit Mastozytose auf. Es gibt aber auch Mastozytose-Patienten ohne Veränderungen am Stammzellfaktor-Rezeptor. Insgesamt sind beim Menschen über 20 Chromosomenveränderungen bekannt, die zu Mastozytosen führen können, wobei am häufigsten die Chromosomen 2, 7, 12, 13, 14 und X betroffen sind.[12]
Auch beim Hund scheinen c-KIT-Veränderungen eine Rolle zu spielen. Dabei können sowohl eine gesteigerte Genexpression als auch eine Mutation mit Phosphorylierung des Stammzellfaktor-Rezeptors, die zu einer Aktivierung ohne Bindung des Stammzellfaktors (Liganden-unabhängig) führt, auftreten. Mittlerweile sind über 30 solcher Mutationen bekannt, von denen die häufigste eine Verdopplung (Tandemmutation) des Exon 11 ist, welches den direkt an der Innenseite der Zellmembran liegenden Anteil (Juxtamembrandomäne) des Stammzellfaktor-Rezeptors codiert.[11][13] Aber auch beim Hund kommen Mastzelltumoren ohne c-KIT-Mutation vor[14], im Gegensatz zu US-amerikanischen Studien wurden bei Mastzelltumoren deutscher Hunde sogar fast keine relevanten c-KIT-Mutationen nachgewiesen. Ob dies zufällig oder methodisch bedingt war oder genetische Unterschiede in den Zuchtlinien reflektiert, muss durch weitere Untersuchungen geklärt werden.[15] Die Ursachen für das gehäufte Auftreten von Mastzelltumoren beim Hund sind bislang ungeklärt, vermutlich gibt es mehrere Ursachen (multifaktorielles Geschehen).[16]
Klinisches Bild
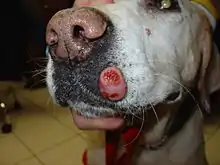

Mastzelltumoren der Haut zeigen sich als Knötchen (Papel), erhabene Flecken (Plaque) oder Knoten (Nodus), die oberflächlich geschwürig zerfallen können. Ihre Konsistenz reicht von weich bis derb-knotig. Lokal können Rötung und Juckreiz auftreten (Darier-Zeichen).[9] Gelegentlich treten Satellitenknoten auf, das heißt Absiedlungen des Tumors über Lymphgefäße in benachbarte Hautgebiete[17], in etwa 10 % der Fälle sind von Anfang an mehrere Mastzelltumoren ausgebildet (primäre Multiplizität).[18]
Mastzelltumoren können Tochtergeschwulste (Metastasen) in die für das Gebiet zuständigen (regionären) Lymphknoten sowie in andere Organen wie Leber, Milz und Knochenmark bilden, andere Lokalisationen sind sehr selten.[9] Bei gutartigen Mastzelltumoren liegt die Metastasierungsrate unter 10 %, bei bösartigen über 50 %.[18]
Auch ohne die Bildung von Tochtergeschwulsten kann ein Mastzelltumor schwere Allgemeinstörungen auslösen (paraneoplastisches Syndrom). Diese werden durch die Freisetzung von Entzündungsmediatoren und Zytokinen ausgelöst. Durch die Bildung von Heparin durch die Mastzellen kann es zu einer vermehrten Blutungsneigung kommen, infolge der Produktion Fibroblasten-hemmender Zytokine (vor allem FGF-2) zur Störung von Wundheilungsvorgängen.[18] Bei etwa einem Fünftel der Hunde mit einem Mastzelltumor treten Fressunlust, Erbrechen, Teerstuhl und Blutarmut infolge von Magen- oder Zwölffingerdarmgeschwüren auf[10], bei Obduktionen werden solche Geschwüre sogar bei über 80 % der Patienten nachgewiesen.[18] Etwa 80 % der Hunde mit solchen Geschwüren werden aufgrund des schlechten Allgemeinbefindens eingeschläfert.[19] In besonders schweren Fällen können diese Geschwüre zu einem lebensgefährlichen Magen- beziehungsweise Darmdurchbruch führen.[17] Darüber hinaus kann es auch zu einem Krankheitsbild kommen, das an eine bösartige Erkrankung des blutbildenden Systems erinnert. Diese systemische Mastozytose wird vor allem bei Tieren beobachtet, bei denen zuvor ein Mastzelltumor entfernt wurde. Dabei treten Abgeschlagenheit, Fressunlust, Erbrechen, Gewichtsverlust, Blässe, Leber- und Milzvergrößerung auf.[19]
Nach dem klinischen Bild werden Mastzelltumoren entsprechend den Kriterien der Weltgesundheitsorganisation in vier Stadien eingeteilt[20]:
| Stadium 1 | ein, auf die Haut beschränkter Tumor ohne Lymphknotenbeteiligung a) ohne Allgemeinstörungen |
| Stadium 2 | ein, auf die Haut beschränkter Tumor mit Lymphknotenmetastase a) ohne Allgemeinstörungen |
| Stadium 3 | mehrere Tumoren oder infiltrativ wachsende große Einzeltumoren mit oder ohne Lymphknotenbeteiligung a) ohne Allgemeinstörungen |
| Stadium 4 | Tumor mit Fernmetastase oder Rezidiv mit Metastase |
Diagnostik
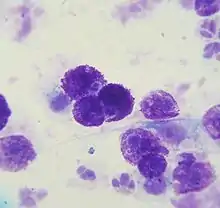
Eine Blick- oder Tastdiagnose ist nicht möglich, da weder Aussehen noch Konsistenz eine Abgrenzung zu anderen Hauttumoren ermöglichen.
Diagnostisches Mittel der Wahl ist die Feinnadelbiopsie, da aus Mastzelltumoren ausreichend Zellen gewonnen werden können. Im zytologischen Präparat lassen sich Mastzellen aufgrund ihrer Granula relativ einfach von anderen Zelltypen unterscheiden, wobei jedoch zu beachten ist, dass bestimmte Schnellfärbelösungen Mastzellgranula nur unzuverlässig anfärben und Zellen wenig differenzierter Mastzelltumoren sehr wenig Granula enthalten können.[21]
Im Blutbild werden nur selten Veränderungen beobachtet, gelegentlich kann eine Vermehrung einer Unterform der weißen Blutkörperchen (Eosinophilie) auftreten.[9] Bei einer systemischen Mastozytose tritt häufig eine Abnahme der weißen Blutkörperchen (Leukopenie) auf. Im Blut zirkulierende Mastzellen werden zumeist nicht beobachtet.[19]
Nach dem histopathologischen Zellbild werden Mastzelltumoren des Hundes in verschiedene Grade eingeteilt. Die am weitesten verbreitete Einteilung der Mastzelltumoren basiert auf dem Schema von Patnaik und Mitarbeitern aus dem Jahr 1984[22]:
| Tumorgrad 1 (gut differenziert) | |
| Tumorgrad 2 (mittelgradig differenziert) |
|
| Tumorgrad 3 (anaplastisch) |
|
Eine Studie aus dem Jahr 2011 stellt diese Einteilung jedoch in Frage. Dabei wurden identische Präparate von 95 Mastzelltumoren, von denen auch der Ausgang der Erkrankung bekannt war, an 28 Pathologen in 16 verschiedenen Einrichtungen verschickt. Während die Übereinstimmung zwischen den verschiedenen Untersuchern bei Grad-3-Tumoren 75 % betrug, lag sie bei den Graden 1 und 2 unter 63 % und auch die daraus abgeleiteten Prognosen zeigten nur wenig Übereinstimmung mit dem Ausgang der Erkrankung. Kiupel und Mitarbeiter schlugen daher ein neues System vor, das nur noch zwei Grade vorsieht: low-grade und high-grade. Als high-grade (hochgradig, bösartig) werden dabei Tumoren beurteilt, bei denen in zehn Gesichtsfeldern bei starker Vergrößerung (Objektiv 40fach) ein oder mehrere folgender Kriterien erfüllt sind[23]:
- mindestens sieben Mitosen
- mindestens drei mehrkernige Zellen (drei oder mehr Zellkerne)
- mindestens drei abnorme Zellkerne (Einziehungen, Segmentierung, unregelmäßige Form)
- Kernvergrößerung (Karyomegalie, die Zellkerndurchmesser von 10 % der Mastzellen variieren um mindestens das zweifache).
Die mittlere Überlebenszeit betrug bei Tieren mit high-grade-Mastzelltumor vier Monate, bei Tieren mit low-grade-Mastzelltumor dagegen über zwei Jahre. Zudem waren Rezidive und Metastasen bei high-grade-Mastzelltumoren deutlich häufiger.[23] Darüber hinaus scheint ein Zusammenhang zwischen der Art der c-KIT-Mutation einerseits und dem biologischen Verhalten bzw. dem Tumorgrad andererseits zu existieren.[11][24][25] Auch der immunhistochemische Nachweis von Zellteilungsmarkern wie Ki-67 oder der argyrophilen Nukleolusorganisatorregion (AgNOR) zeigt Korrelationen mit dem biologischen Verhalten von Mastzelltumoren.[26] Mehr als 23 Ki-67-positive Zellen pro cm2 bzw. mehr als vier AgNOR pro Zellkern gelten als prognostisch ungünstig.[15]
Das biologische Verhalten von Mastzelltumoren ist also bei Hunden sehr variabel und nur bedingt vorhersehbar, weshalb bei Hunden der Begriff Mastzelltumor den Begriffen Mastozytom (gutartig) und Mastosarkom (bösartig) vorzuziehen ist.[19] Das klinische Stadium, der histopathologische Grad, c-KIT-Expressionsmuster und Zellteilungsmarker geben Hinweise, lassen aber keine präzisen Aussagen zu. Offenbar handelt es sich bei den Mastzelltumoren des Hundes um molekular heterogene Neubildungen.[11] Mastzelltumoren beim Deutschen Boxer, eine der am häufigsten betroffenen Rassen, zeigen meist einen gutartigen Verlauf.[27] Die Lokalisation des Tumors scheint ebenfalls eine Rolle zu spielen. So neigen Mastzelltumoren der Zehen, des Damms, der Leiste und der Schleimhäute eher zu Metastasen als solche anderer Regionen.[19] Dagegen neigen Mastzelltumoren der Bindehaut kaum zu Rezidiven oder Metastasen, unabhängig vom Grad.[28] Offenbar können epigenetische Faktoren, die unmittelbaren Umgebungsbedingungen (microenvironment), die Gefäßneubildung und Wachstumsfaktoren das biologische Verhalten beeinflussen.[26]
Differentialdiagnostisch kommt jeder andere Hauttumor des Hundes in Betracht: In der Haut insbesondere Histiozytome, Basaliome, Melanome und T-Zell-Lymphome, in der Unterhaut vor allem Lipome, Hämangioperizytome und Hämangiosarkome. Die Abgrenzung dieser Tumoren bereitet aber in der Zytodiagnostik kaum Probleme.[20]
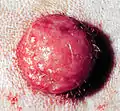 Histiozytom
Histiozytom Malignes Melanom
Malignes Melanom T-Zell-Lymphom
T-Zell-Lymphom Hämangiosarkom
Hämangiosarkom
Behandlung
Obwohl die Einteilungen nach den klinischen Erscheinungen und dem Zellbild in der Zytodiagnostik Hinweise auf das biologische Verhalten geben, bleibt ein Mastzelltumor unberechenbar und ist potentiell als bösartig einzuschätzen. Die Behandlungsmethode der ersten Wahl ist die frühestmögliche chirurgische Entfernung des Tumors. Begleitend können Chemotherapie und Bestrahlung notwendig sein, vor allem wenn die vollständige Entfernung aus anatomischen Gründen nicht möglich oder unsicher ist.[20] Bei inoperablen Tumoren kann ein Behandlungsversuch mit Tyrosinkinase-Inhibitoren unternommen werden. Generell gilt, dass die Aussicht auf Heilung bei gut differenzierten Mastzelltumoren (low-grade bzw. Grad 1) und bei Tieren ohne Allgemeinsymptome (Unterstadien a) am besten ist.[18] Bei jungen Hunden (< 1 Jahr) ist die Prognose ebenfalls besser als bei älteren.[29]
Chirurgie
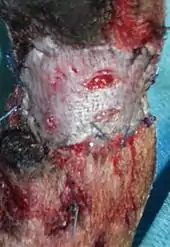
Die chirurgische Entfernung (Resektion) sollte möglichst frühzeitig erfolgen, also bevor Lymphknoten oder gar andere Organe befallen sind (Stadium 1). Mastzelltumoren besitzen eine Pseudokapsel aus komprimierten Tumorzellen und meist feine Ausläufer in das umgebende Gewebe, die über das tastbare Tumorgewebe hinausgehen. Aus diesem Grund wird ein Sicherheitsabstand von etwa 3 cm über den tastbaren Rand empfohlen. Die Entfernung erfolgt, auch bei Mastzelltumoren in der Unterhaut, mit der kompletten Haut und in der Tiefe einschließlich der Unterhautfaszie. An den Gliedmaßen kann es schwierig sein, den dadurch entstandenen Hautdefekt zu verschließen, so dass auch eine Hauttransplantation notwendig werden kann. Aus den Rändern und dem verbliebenen Gewebe in der Tiefe (Tumorbett) sollten Biopsien entnommen werden, um das Vorhandensein von Tumorrestgewebe zu überprüfen.[20][17]
Vor allem an den Gliedmaßen lassen sich diese tumorchirurgischen Grundregeln nicht immer vollständig umsetzen, weil dies den Verlust von Nerven, Gefäßen und Sehnen zur Folge hätte, so dass auch eine Amputation in Erwägung gezogen werden muss. Unter Umständen kann durch die Anwendung von H₁- und H₂-Rezeptor-Antagonisten vor der Operation versucht werden, die Tumorgröße zu verringern. Auch bei unvollständiger Entfernung zur Verringerung der Zahl der Tumorzellen (zytoreduktive Resektion) ist die Gabe dieser Wirkstoffe angezeigt, da der Eingriff zu einer Degranulation der Mastzellen und damit Freisetzung von Entzündungsfaktoren führen kann.[20]
Bei gut differenzierten Mastzelltumoren, die kleiner als 5 cm sind, ist die Heilungsaussicht (Prognose) bei ordnungsgemäßer chirurgischer Entfernung sehr gut, bei Rezidiven dagegen schlecht. Die Planung des chirurgischen Vorgehens beim Ersteingriff ist daher von entscheidender Bedeutung.[17] Bei Tumoren kleiner 2,5 cm ist die Überlebenszeit auch bei high-grade-Tumoren sehr hoch.[30]
Strahlentherapie
Die Strahlentherapie wird vor allem bei nicht vollständig entfernbaren Mastzelltumoren als Begleittherapie eingesetzt und gilt dabei als Mittel der Wahl. Mastzellen sind sehr empfindlich gegenüber ionisierender Strahlung. Bei Grad-2-Mastzelltumoren zeigen verschiedene Studien nach einem Jahr Krankheitsfreiheit bei etwa 95 % der Patienten, zwischen dem zweiten und fünften Jahr nach der Behandlung bei etwa 90 % der Patienten. Bei Grad-3-Tumoren ohne Lymphknotenbeteiligung betrug die Einjahresüberlebensrate in einer Studie 71 %. Die Strahlentherapie kann auch als palliative Behandlung eingesetzt werden, da sie meist zu einer deutlichen Schrumpfung des Tumors führt.[27] Eine Studie zur Kurzdistanzstrahlentherapie bei Tumoren der Grade 2 und 3 nach chirurgischer Entfernung zeigte ebenfalls gute Erfolge und eine gute Verträglichkeit.[31]
Chemotherapie
Zur Chemotherapie werden verschiedene Wirkstoffe eingesetzt. Glucocorticoide haben einen direkten hemmenden Effekt auf die Vermehrung von Mastzellen. Die direkte Injektion in den Tumor wird nicht mehr empfohlen, die systemische Verabreichung wird dagegen häufig mit der Gabe von Zytostatika kombiniert. Als Zytostatika werden Vincaalkaloide wie Vinblastin, Cyclophosphamid, Hydroxycarbamid, Doxorubicin, Mitoxantron und L-Asparaginase eingesetzt, wobei Kombinationen verschiedener Wirkstoffe erfolgversprechender sind.[20][32] Nach dem europäischen Konsenspapier aus dem Jahre 2012 ist eine Chemotherapie immer angezeigt, wenn sich der Tumor bereits im Körper verbreitet hat oder wenn bei unvollständiger chirurgischer Entfernung weder Nachoperation noch Bestrahlung möglich sind.[33]
Hydroxycarbamid sprach in einer Studie bei 28 % der behandelten Hunde an, 4 % (zwei Tiere) zeigten eine vollständige Heilung (komplette Remission). Nebenwirkungen waren vor allem Blutbildveränderungen wie Anämie und Neutropenie.[34] Die Kombination von Hydroxycarbamid mit Prednisolon bei unvollständig entfernten Grad-2-Tumoren führte in zwei Fällen zum Tod durch Leberversagen, von den verbliebenen Hunden überlebten alle das erste und 77 % das zweite Jahr.[35] Mit der Kombination von Hydroxycarbamid, Vinblastin und Prednisolon konnte bei nicht oder unvollständig entfernbaren Mastzelltumoren eine Ansprechrate von 65 % erzielt werden, die mittlere Überlebenszeit war bei Grad-2- deutlich höher als bei Grad-3-Tumoren (954 gegenüber 190 Tage). Die Nebenwirkungen (Neutropenie, Anstieg der Leberwerte) waren moderat.[36]
Tyrosinkinase-Inhibitoren
Mittlerweile gibt es mit den Tyrosinkinase-Inhibitoren Wirkstoffe, die spezifisch am Stammzellrezeptor der Mastzellen wirken. Seit 2009 wurden zwei Tyrosinkinase-Inhibitoren – Masitinib (Handelsname Masivet) und Toceranib (Handelsname Palladia) – zur Behandlung von Mastzelltumoren bei Hunden in der EU zugelassen.[17][37][38]
Masitinib ist zur Behandlung inoperabler Mastzelltumoren der Grade 2 und 3 (bzw. high-grade) mit c-KIT-Mutation zugelassen. Nebenwirkungen sind vor allem Erbrechen, Durchfall, Neutropenie, Anämie und Proteinurie, die jedoch meist mild sind. Die mittlere Überlebenszeit stieg in einer Studie an Hunden mit Tumoren der Grade 2 und 3 ohne Metastasen von 75 auf 118 Tage, wenn der Wirkstoff zur Erstbehandlung eingesetzt wurde auf 253 Tage.[39]
Toceranib hat mehrere Angriffspunkte (multitarget drug): Es wirkt nicht nur am Stammzellrezeptor, sondern auch an den Rezeptoren für den Gefäß- (VEGF) und den Plättchenwachstumsfaktor (PDGF) und ist damit auch bei Mastzelltumoren ohne c-KIT-Mutation einsetzbar. Die Nebenwirkungen sind ähnlich denen von Masitinib, treten aber sehr häufig auf und sind bei über einem Drittel der Tiere schwerwiegend.[40]
Positive Erfahrungen gibt es auch mit dem für die Humanmedizin zugelassenen Tyrosinkinase-Inhibitor Imatinib.[41]
Tigilanoltiglat
Seit 2019 gibt es eine neue Behandlungsoption durch die Injektion von Tigilanoltiglat (EBC-46), einem Wirkstoff aus der Blushwood-Frucht, direkt in den Tumor. Tigilanoltiglat aktiviert die Proteinkinase C und führt durch Schädigung der Blutgefäße zu einer Nekrose der Tumorzellen.[42] Eine Studie konnte bei 75 % der Tiere mit einer einmaligen Injektion eine vollständige Tumorremission erzielen, die bei 93 % ohne Rezidiv blieb. Bei einer zweimaligen Injektion stieg die Erfolgsrate auf 88 %.[43] In der EU ist mittlerweile ein Medikament (Handelsname Stelvonta, Virbac) zur Behandlung von Mastzelltumoren zugelassen. Tigilanoltiglat eignet sich zur Behandlung von Mastzelltumoren der Haut und Unterhaut bis zu einem Volumen von 8 cm3, begleitet wird die Behandlung mit der Gabe eines Antihistaminikums, eines Kortikoids und eines Schmerzmittels.[42]
Mastzelltumoren anderer Spezies
Mastzelltumoren beim Menschen
| Klassifikation nach ICD-10 | |
|---|---|
| C94.3 | Mastzellenleukämie |
| C96.2 | Bösartiger Mastzelltumor Bösartige Mastozytose |
| Q82.2 | angeborene Mastozytose Urticaria pigmentosa |
| ICD-10 online (WHO-Version 2019) | |
Eine krankhafte Vermehrung von Mastzellen wird in der Humanmedizin als Mastozytose bezeichnet. Die vermehrte Einlagerung von Mastzellen in die Haut (Kutane Mastozytose) ist eine seltene Erkrankung mit einer Inzidenz von unter zehn Neuerkrankungen pro 1 Million Einwohner.[44] Die häufigste Form dieser Haut-Mastozytosen ist die gutartig verlaufende Urticaria pigmentosa („Pigmentnesselsucht“).[45] Bei etwa 20 % der Kleinkinder sind auch andere Organe betroffen, bei Erwachsenen schwanken die Angaben zwischen 40 und 90 %.[46]
Vereinzelte Mastzelltumoren wie beim Hund sind beim Menschen dagegen sehr selten. Gutartige Mastzelltumoren (Mastozytom, Mastzellnävus) entstehen meist bei Kleinkindern unter zwei Jahren und zeigen sich als einzelne oder mehrere, rötliche oder rotbraune erhabene Flecken oder Knötchen der Haut. Auf mechanische Reize oder spontan können sie nesselsuchtartig anschwellen (Darier-Zeichen) und Juckreiz auslösen. Es besteht keine Tendenz zur Entartung oder zur Beteiligung anderer Organe. Mastozytome bilden sich meist ohne Behandlung zurück, was aber Jahre in Anspruch nehmen kann.[47] Bösartige Mastzelltumoren (Mastzellsarkome) sind beim Menschen äußerst selten[46] und als eigenständiges Krankheitsbild umstritten.[48]
Mastzelltumoren bei anderen Tierarten
Relativ häufig sind Mastzelltumoren auch bei Pferden, Katzen und Frettchen, allerdings seltener als beim Hund. Beim Hauspferd treten sie vor allem bei älteren Tieren im Kopf- und Halsbereich sowie an den unteren Gliedmaßenabschnitten auf. Die Rezidivrate ist bei sachgemäßer chirurgischer Entfernung gering.[49] Bei der Hauskatze sind Mastzelltumoren der Haut zumeist gutartig. Eine histologische Gradierung wie beim Hund hat sich nicht als sinnvoll erwiesen. Die chirurgische Entfernung ist auch bei der Katze die Behandlungsmethode der Wahl, bei unvollständiger Resektion auch in Kombination mit einer Bestrahlung. Wenn zahlreiche Mastzelltumoren auftreten, kann auch eine palliative Behandlung mit Glucocorticoiden versucht werden. Eine Sonderform des Mastzelltumors tritt bei Siamkatzen auf. Hier ähneln die Mastzellen Histiozyten und in den Tumor sind Ansammlungen von Lymphozyten und eosinophilen Granulozyten eingestreut.[17] Bei älteren Katzen treten gelegentlich auch Mastzelltumoren im Dünndarm auf, die zu einer Darmeinstülpung oder Darmperforation führen können und ein aggressives biologisches Verhalten zeigen.[50] Bei Frettchen machen Mastzelltumoren etwa 16 % der Hauttumoren aus, verhalten sich aber ebenfalls meist gutartig.[51]
Bei anderen Säugetieren sind Mastzelltumoren sehr selten. Es gibt Einzelfallberichte bei Hausrind[52], Hausesel[53], Hausschwein[54], Lama[55], Richardson-Ziesel[56], Hamster[57] und Afrikanischen Igeln.[58] Bei Mäusen sind spontane Mastzelltumoren sehr selten[59], in der Forschung wird die Mäuse-Masttumor-Zelllinie P 815 jedoch sehr häufig verwendet.
Bei Vögeln und Reptilien sind Mastzelltumoren sehr selten, Einzelfälle wurden beim Haushuhn[60], der Kettennatter[61] und einer Galápagos-Riesenschildkröte[62] beschrieben.
Weblinks
- Martin Kessler: Der Mastzelltumor des Hundes: ein Tumor mit vielen Gesichtern.
- Mastzelltumor – Informationen der Uni München
Literatur
- Martin Kessler: Kleintieronkologie: Diagnose und Therapie von Tumorerkrankungen bei Hunden und Katzen. 2. Auflage, Parey Verlag, Stuttgart 2005, ISBN 978-3-8304-4103-8, S. 210–215.
- Martin Kessler: Mastzelltumoren, Mastozytom (Mastzellsarkom). In: Hans Georg Niemand, Peter F. Suter (Hrsg.): Praktikum der Hundeklinik. 10. Auflage, Parey Verlag, Stuttgart 2006, ISBN 978-3-8304-4141-0, S. 1135–1136.
- Anthony S. Stannard und L. Thoma Pulley: Mastocytoma of the dog. In: Jack E. Moulton (Hrsg.): Tumors in domestic animals. 2. Auflage, University of California Press, Berkeley [u. a.] 1978, ISBN 0-520-02386-2, S. 26–31.
- C. Guillermo Couto: Mast cell tumors in dogs and cats. In: Richard W. Nelson und C. Guillermo Couto (Hrsg.): Small animal internal medicine. 3. Auflage, Mosby, St. Louis 2003, ISBN 0-323-01724-X, S. 1146–1149.
- 55. Österreichische Apotheker-Verlagsgesellschaft m.b.H: Austria-Codex Schnellhilfe 2016/17. Druckerei Berger, Horn 2016, S. 1015, ISBN 978-3-85200-244-6
Einzelnachweise
- R. J. Mayoral et al.: MiR-221 influences effector functions and actin cytoskeleton in mast cells. In: PloS one. Band 6, Nummer 10, 2011, S. e26133, ISSN 1932-6203. doi:10.1371/journal.pone.0026133. PMID 22022537. PMC 3192147 (freier Volltext).
- C. P. Shelburne und J. J. Ryan: The role of Th2 cytokines in mast cell homeostasis. In: Immunological Reviews. Band 179, Februar 2001, S. 82–93, ISSN 0105-2896. PMID 11292031. (Review).
- S. Ch'ng et al.: Mast cells and cutaneous malignancies. In: Modern Pathology. Band 19, Nummer 1, Januar 2006, S. 149–159, ISSN 0893-3952. doi:10.1038/modpathol.3800474. PMID 16258517. (Review).
- S. J. Galli, M. Tsai: Mast cells in allergy and infection: versatile effector and regulatory cells in innate and adaptive immunity. In: European Journal of Immunology. Band 40, Nummer 7, Juli 2010, S. 1843–1851, ISSN 1521-4141. doi:10.1002/eji.201040559. PMID 20583030. (Review).
- Erwin Dahme und Eugen Weiss: Grundriss der speziellen pathologischen Anatomie der Haustiere. 6. Auflage, Parey Verlag, Stuttgart 2007, ISBN 978-3-8304-1048-5, S. 143.
- L. A. Hillman, et al.: Biological behavior of oral and perioral mast cell tumors in dogs: 44 cases (1996–2006). In: Journal of the American Veterinary Medical Association. Band 237, Nummer 8, Oktober 2010, S. 936–942, ISSN 0003-1488. doi:10.2460/javma.237.8.936. PMID 20946081.
- A. K. Patnaik et al.: Extracutaneous mast-cell tumor in the dog. In: Veterinary pathology. Band 19, Nummer 6, November 1982, S. 608–615, ISSN 0300-9858. PMID 6815869.
- M. Fife et al.: Canine conjunctival mast cell tumors: a retrospective study. In: Veterinary ophthalmology. Band 14, Nummer 3, Mai 2011, S. 153–160, ISSN 1463-5224. doi:10.1111/j.1463-5224.2010.00857.x. PMID 21521438.
- Martin Kessler: Mastzelltumoren, Mastozytom (Mastzellsarkom). In: Hans Georg Niemand, Peter F. Suter (Hrsg.): Praktikum der Hundeklinik. 10. Auflage, Parey Verlag, Stuttgart 2006, ISBN 978-3-8304-4141-0, S. 1135–1136.
- Anthony S. Stannard und L. Thoma Pulley: Mastocytoma of the dog. In: Jack E. Moulton (Hrsg.): Tumors in domestic animals. 2. Auflage, University of California Press, Berkeley [u. a.] 1978, ISBN 0-520-02386-2, S. 26–31.
- F. Riva et al.: A study of mutations in the c-kit gene of 32 dogs with mastocytoma. In: Journal of veterinary diagnostic investigation. Band 17, Nummer 4, Juli 2005, S. 385–388, ISSN 1040-6387. PMID 16131001.
- H. Sadrzadeh, O. Abdel-Wahab, A. T. Fathi: Molecular alterations underlying eosinophilic and mast cell malignancies. In: Discovery medicine. Band 12, Nummer 67, Dezember 2011, S. 481–493, ISSN 1944-7930. PMID 22204765.
- Y. Takeuchi et al.: Aberrant autophosphorylation of c-Kit receptor in canine mast cell tumor cell lines. In: Veterinary immunology and immunopathology. Band 137, Nummer 3–4, Oktober 2010, S. 208–216, ISSN 1873-2534. doi:10.1016/j.vetimm.2010.05.009. PMID 20591500.
- K. Ohmori et al.: Identification of c-kit mutations-independent neoplastic cell proliferation of canine mast cells. In: Veterinary immunology and immunopathology. Band 126, Nummer 1–2, November 2008, S. 43–53, ISSN 0165-2427. doi:10.1016/j.vetimm.2008.06.014. PMID 18687474.
- Heike Aupperle et al.: Neue diagnostische Aspekte bei kaninen Mastzelltumoren – Ein Überblick zur aktuellen Studienlage. In: kleintier konkret. S1 (2011), S. 44–48. (Volltext (Memento vom 13. August 2012 im Internet Archive); PDF; 1,3 MB)
- M. M. Welle et al.: Canine mast cell tumours: a review of the pathogenesis, clinical features, pathology and treatment. In: Veterinary dermatology. Band 19, Nummer 6, Dezember 2008, S. 321–339, ISSN 1365-3164. doi:10.1111/j.1365-3164.2008.00694.x. PMID 18980632. (Review).
- James Warland und Jane Dobson: Hauttumore bei Hunden und Katzen. In: Veterinary Focus. Band 21, 2011, S. 34–41.
- Martin Kessler: Der Mastzelltumor des Hundes: ein Tumor mit vielen Gesichtern.
- C. Guillermo Couto: Mast cell tumors in dogs and cats. In: Richard W. Nelson und C. Guillermo Couto (Hrsg.): Small animal internal medicine. 3. Auflage, Mosby, St. Louis 2003, ISBN 0-323-01724-X, S. 1146–1149.
- Martin Kessler: Kleintieronkologie: Diagnose und Therapie von Tumorerkrankungen bei Hunden und Katzen. 2. Auflage, Parey Verlag, Stuttgart 2005, ISBN 978-3-8304-4103-8, S. 210–215.
- Reinhard Mischke: Zytologisches Praktikum für die Veterinärmedizin. Schlütersche, Hannover 2005, ISBN 978-3-89993-013-9, S. 135.
- A. K. Patnaik, W. J. Ehler, E. G. MacEwen: Canine cutaneous mast cell tumor: morphologic grading and survival time in 83 dogs. In: Veterinary pathology. Band 21, Nummer 5, September 1984, S. 469–474, ISSN 0300-9858. PMID 6435301.
- M. Kiupel et al.: Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior. In: Veterinary pathology. Band 48, Nummer 1, Januar 2011, S. 147–155, ISSN 1544-2217. doi:10.1177/0300985810386469. PMID 21062911.
- R. M. Gil da Costa et al.: CD117 immunoexpression in canine mast cell tumours: correlations with pathological variables and proliferation markers. In: BMC veterinary research. Band 3, 2007, S. 19, ISSN 1746-6148. doi:10.1186/1746-6148-3-19. PMID 17711582. PMC 2077863 (freier Volltext).
- D. Zemke, B. Yamini, V. Yuzbasiyan-Gurkan: Mutations in the juxtamembrane domain of c-KIT are associated with higher grade mast cell tumors in dogs. In: Veterinary pathology. Band 39, Nummer 5, September 2002, S. 529–535, ISSN 0300-9858. PMID 12243462.
- J. J. Thompson et al.: Canine subcutaneous mast cell tumors: cellular proliferation and KIT expression as prognostic indices. In: Veterinary pathology. Band 48, Nummer 1, Januar 2011, S. 169–181, ISSN 1544-2217. doi:10.1177/0300985810390716. PMID 21160022.
- M. N. Mayer: Radiation therapy for canine mast cell tumors. In: The Canadian veterinary journal. La revue vétérinaire canadienne. Band 47, Nummer 3, März 2006, S. 263–265, ISSN 0008-5286. PMID 16604985. PMC 2823470 (freier Volltext). (Review).
- M. Fife et al.: Canine conjunctival mast cell tumors: a retrospective study. In: Veterinary ophthalmology. Band 14, Nummer 3, Mai 2011, S. 153–160, doi:10.1111/j.1463-5224.2010.00857.x, PMID 21521438.
- K. Rigas et al.: Mast cell tumours in dogs less than 12 months of age: a multi-insitutional retrospective study. In: J. Small Anim. Pract. Band 61, 2020, Heft 7, S. 449–457.
- A.S. Mooreet al.: Retrospective outcome evaluation for dogs with surgically excised, solitary Kiupel high‐grade, cutaneous mast cell tumours. In: Vet. Comp. Oncol. 2020. doi: 10.1111/vco.12565
- N. C. Northrup, R. E. Roberts, T. W. Harrell, K. L. Allen, E. W. Howerth, T. L. Gieger: Iridium-192 interstitial brachytherapy as adjunctive treatment for canine cutaneous mast cell tumors. In: Journal of the American Animal Hospital Association. Band 40, Nummer 4, 2004 Jul–Aug, S. 309–315, ISSN 1547-3317. PMID 15238561.
- S. M. Govier: Principles of treatment for mast cell tumors. In: Clinical techniques in small animal practice. Band 18, Nummer 2, Mai 2003, S. 103–106, ISSN 1096-2867. doi:10.1053/svms.2003.36624. PMID 12831070. (Review).
- L. Blackwood et al.: European consensus document on mast cell tumours in dogs and cats. In: Veterinary and comparative oncology. Band 10, Nummer 3, September 2012, S. e1–e29, doi:10.1111/j.1476-5829.2012.00341.x, PMID 22882486 (Review)
- K. M. Rassnick et al.: Phase II open-label study of single-agent hydroxyurea for treatment of mast cell tumours in dogs. In: Veterinary and comparative oncology. Band 8, Nummer 2, Juni 2010, S. 103–111, ISSN 1476-5829. doi:10.1111/j.1476-5829.2010.00211.x. PMID 20579323.
- K. Hosoya et al.: Adjuvant CCNU (lomustine) and prednisone chemotherapy for dogs with incompletely excised grade 2 mast cell tumors. In: Journal of the American Animal Hospital Association. Band 45, Nummer 1, 2009 Jan–Feb, S. 14–18, ISSN 1547-3317. PMID 19122059.
- K. M. Rassnick et al.: A phase II study to evaluate the toxicity and efficacy of alternating CCNU and high-dose vinblastine and prednisone (CVP) for treatment of dogs with high-grade, metastatic or nonresectable mast cell tumours. In: Veterinary and comparative oncology. Band 8, Nummer 2, Juni 2010, S. 138–152, ISSN 1476-5829. doi:10.1111/j.1476-5829.2010.00217.x. PMID 20579327.
- Österreichische Apotheker-Verlagsgesellschaft m.b.H.: Austria-Codex Schnellhilfe 2016/17. Hrsg.: Österreichische Apotheker-Verlagsgesellschaft m.b.H. Wien 2016, ISBN 978-3-85200-244-6, S. 1015.
- Fachinformation für Palladia Filmtabletten für Hunde. (PDF) Abgerufen am 2. Januar 2017.
- K. A. Hahn et al.: Masitinib is safe and effective for the treatment of canine mast cell tumors. In: Journal of veterinary internal medicine Band 22, Nummer 6, 2008 Nov–Dec, S. 1301–1309, ISSN 0891-6640. doi:10.1111/j.1939-1676.2008.0190.x. PMID 18823406.
- Eintrag zu Toceranib bei Vetpharm, abgerufen am 29. Juli 2012.
- O. Yamada et al.: Imatinib elicited a favorable response in a dog with a mast cell tumor carrying a c-kit c.1523A>T mutation via suppression of constitutive KIT activation. In: Veterinary immunology and immunopathology. Band 142, Nummer 1–2, Juli 2011, S. 101–106, ISSN 1873-2534. doi:10.1016/j.vetimm.2011.04.002. PMID 21561667.
- Isabelle Devillers und Laura Meyer: Therapie von Mastzelltumoren beim Hund mit Tigilanoltiglat – Erfahrungen mit besonderen Fällen. In: Kleintiermedizin Band 24, 2021, Nummer 3, S. 1–7.
- T.T. De Ridder et al.: Randomized controlled clinical study evaluating the efficacy and safety of intratumoral treatment of canina mast cell tumors with Tigilanol tiglate (EBC-46). In: J. Vet. Intern. Med. 2020, doi:10.1111/jvim.15806.
- Leitlinie Mastozytose (PDF; 313 kB) der Deutschen Dermatologischen Gesellschaft
- Heiko Traupe, Henning Hamm: Pädiatrische Dermatologie. 2. Auflage, Springer, Heidelberg 2005, ISBN 978-3-540-25646-5, S. 215–223.
- Gerd Plewig, P. Thomas: Fortschritte der praktischen Dermatologie und Venerologie 2006. Band 20 von Fortschritte Der Praktischen Dermatologie und Venerologie. Springer, Heidelberg 2007, ISBN 3-540-30514-9, S. 391.
- Otto Braun-Falco et al.: Dermatologie und Venerologie. 5. Auflage, Springer, Heidelberg 2005, ISBN 978-3-540-40525-2, S. 1396.
- Wolfgang Remmele: Pathologie. 1. Rechtsfragen in der Pathologie; Einführung in die bioptische Diagnostik; Herz und Gefäßsystem; Hämatologie; Milz; Thymus. 2. Auflage, Springer, Berlin 1999, ISBN 3-540-61095-2, S. 507–508.
- Hanns-Jürgen Wintzer: Krankheiten des Pferdes: ein Leitfaden für Studium und Praxis. 3. Auflage, Parey, Berlin 1999, ISBN 3-8263-3280-6, S. 483.
- Laura Marconato und Giuliano Bettini: Darmtumoren bei der Katze. In: Veterinary Focus 23 (2013), S. 39–45.
- G. A. Parker, C. A. Picut: Histopathologic features and post-surgical sequelae of 57 cutaneous neoplasms in ferrets (Mustela putorius furo L.). In: Veterinary pathology. Band 30, Nummer 6, November 1993, S. 499–504, ISSN 0300-9858. PMID 8116142. (Review).
- B. I. Smith und L. A. Phillips: Congenital mastocytomas in a Holstein calf. In: The Canadian veterinary journal. Band 42, Nummer 8, August 2001, S. 635–637, ISSN 0008-5286. PMID 11519274. PMC 1476568 (freier Volltext).
- G. Kay et al.: Grade III mastocytoma in a donkey. In: The Veterinary record. Band 152, Nummer 9, März 2003, S. 266–267, ISSN 0042-4900. PMID 12638914.
- G. Migaki, K. A. Langheinrich: Mastocytoma in a pig. In: Pathologia veterinaria. Band 7, Nummer 4, 1970, S. 353–355, ISSN 0031-2975. PMID 4998946.
- T. Y. Lin et al.: Mast cell tumors in a llama (Lama glama). In: Journal of veterinary diagnostic investigation. Band 22, Nummer 5, September 2010, S. 808–811, ISSN 1040-6387. PMID 20807950.
- X. J. He et al.: Spontaneous cutaneous mast cell tumor with lymph node metastasis in a Richardson’s ground squirrel (Spermophilus richardsonii). In: Journal of veterinary diagnostic investigation. Band 21, Nummer 1, Januar 2009, S. 156–159, ISSN 1040-6387. PMID 19139521.
- K. Nishizumi, K. Fujiwara, A. Hasegawa: Cutaneous mastocytomas in Djungarian hamsters. In: Experimental animals. Band 49, Nummer 2, April 2000, S. 127–130, ISSN 1341-1357. PMID 10889951.
- J. T. Raymond, M. R. White, E. B. Janovitz: Malignant mast cell tumor in an African hedgehog (Atelerix albiventris). In: Journal of wildlife diseases. Band 33, Nummer 1, Januar 1997, S. 140–142, ISSN 0090-3558. PMID 9027702.
- D. J. Lewis, J. M. Offer: Malignant mastocytoma in mice. In: Journal of comparative pathology. Band 94, Nummer 4, Oktober 1984, S. 615–620, ISSN 0021-9975. PMID 6439762.
- G. M. Patnaik, D. Mohanty: A case of avian mastocytoma. In: The Indian veterinary journal. Band 47, Nummer 4, April 1970, S. 298–300, ISSN 0019-6479. PMID 4987390.
- J. Schumacher, R. A. Bennett, L. E. Fox, S. L. Deem, L. Neuwirth, J. H. Fox: Mast cell tumor in an eastern kingsnake (Lampropeltis getulus getulus). In: Journal of veterinary diagnostic investigation. Band 10, Nummer 1, Januar 1998, S. 101–104, ISSN 1040-6387. PMID 9526872.
- M. Santoro et al.: Mast cell tumour in a giant Galapagos tortoise (Geochelone nigra vicina). In: Journal of comparative pathology. Band 138, Nummer 2–3, 2008 Feb–Apr, S. 156–159, ISSN 0021-9975. doi:10.1016/j.jcpa.2007.11.004. PMID 18308330.