Masitinib
Masitinib ist ein Tyrosinkinase-Inhibitor, der in der Tiermedizin zur Therapie von Mastzelltumoren bei Hunden zugelassen ist.[2] Nach der Zulassung im November 2008 ist Masitinib unter dem Handelsnamen Masivet seit Mitte 2009 in Europa erhältlich. In den USA ist das Tierarzneimittel unter dem Handelsnamen Kinavet seit 2011 auf dem Markt. Zulassungsinhaber ist AB Science aus Paris. Das Arzneimittel ist peroral wirksam.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
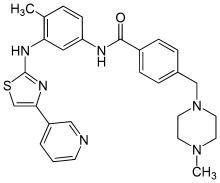 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Masitinib | |||||||||||||||
| Andere Namen |
4-[(4-Methylpiperazin-1-yl)methyl]-N-(4-methyl-3-{[4-(pyridin-3-yl)-1,3-thiazol-2-yl]amino}phenyl)benzamid (IUPAC) | |||||||||||||||
| Summenformel | C28H30N6OS | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkmechanismus |
Protein-Tyrosinkinase-Inhibitor | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 498,64 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Wirkungsmechanismus
Masitinib hemmt in vitro selektiv die mutierte Form der c-Kit-Tyrosinkinase. Solche durch Mutationen dauerhaft aktivierte c-Kit-Tyrosinkinase spielt eine Rolle bei verschiedenen Krebsformen. Durch die selektive Wirkung von Masitinib werden andere Rezeptor-Tyrosinkinasen der Klasse III nicht beeinflusst.
Masitinib hemmt außerdem den Plättchenwachstumsfaktor-Rezeptor (PDGFR) und den Fibroblastenwachstumsfaktor-Rezeptor (FGFR3).
Klinische Entwicklung in der Humanmedizin
In der Humanmedizin befand bzw. befindet sich Masitinib in der Entwicklung zur Behandlung verschiedener Krebserkrankungen (gastrointestinale stromale Tumoren, akute myeloische Leukämie, NSCLC, Ovarialkarzinom, Prostatakarzinom, multiples Myelom, metastasiertes Pankreaskarzinom, Mastzelltumoren, malignes Melanom),[3][4] zur Behandlung der Demenz bei Alzheimer-Krankheit,[5][6] und zur Behandlung der Multiplen Sklerose (Stand 2016).[7] Masitinib ist zudem für die Behandlung des Pankreaskarzinoms in der EU als Orphan-Arzneimittel eingestuft.[8]
Zulassungsanträge in der EU für Masitinib zur Behandlung von gastrointestinalen stromalen Tumoren (geplanter Handelsname: Masican) und Pankreasneoplasmen (geplanter Handelsname: Masiviera) wurden 2014 abschlägig beschieden.[9]
Für die Behandlung von systemischer Mastozytose (Masipro) wurde die EU-Zulassung 2017 verweigert. Der CHMP stellte die Zuverlässigkeit der Studienergebnisse infrage, da eine Begutachtung an den Prüfzentren „schwere Mängel“ in der Weise, wie die Studie durchgeführt worden war, aufzeige. Darüber hinaus wurden große Veränderungen am Studiendesign vorgenommen, während die Studie im Gange war, und Sicherheitsdaten seien begrenzt.[10]
Die EU-Zulassung von Masitinib zur Behandlung der amyotrophen Lateralsklerose[11] (Alsitek) wurde 2018 versagt.[9]
Chemisch-pharmazeutische Informationen
Arzneilich verwendet wird Masitinib als Salz der Methansulfonsäure (Masitinibmesilat), das in wässrigen Lösungen bei saurem pH-Wert sehr gut, bei alkalischem pH-Wert hingegen unlöslich ist.[2]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Produktinformation zu Masivet auf der Website der Europäischen Arzneimittelagentur.
- I. Marech, R. Patruno, N. Zizzo, C. Gadaleta, M. Introna, A. F. Zito, C. D. Gadaleta, G. Ranieri: Masitinib (AB1010), from canine tumor model to human clinical development: where we are? In: Critical reviews in oncology/hematology, Band 91, Nummer 1, Juli 2014, S. 98–111, doi:10.1016/j.critrevonc.2013.12.011, PMID 24405856.
- EU Clinical Trials Register; abgerufen am 30. August 2011.
- J. Folch, D. Petrov, M. Ettcheto, S. Abad, E. Sánchez-López, M. L. García, J. Olloquequi, C. Beas-Zarate, C. Auladell, A. Camins: Current Research Therapeutic Strategies for Alzheimer’s Disease Treatment. In: Neural plasticity, Band 2016, 2016, S. 8501693, doi:10.1155/2016/8501693, PMID 26881137, PMC 4735913 (freier Volltext).
- A Phase 3 Study to Evaluate the Safety and Efficacy of Masitinib in Patients With Mild to Moderate Alzheimer’s Disease.
- A. Shirani, D. T. Okuda, O. Stüve: Therapeutic Advances and Future Prospects in Progressive Forms of Multiple Sclerosis. In: Neurotherapeutics: the journal of the American Society for Experimental NeuroTherapeutics, Band 13, Nummer 1, Januar 2016, S. 58–69, doi:10.1007/s13311-015-0409-z, PMID 26729332, PMC 4720678 (freier Volltext).
- Orphan designation for Masitinib auf der Website der Europäischen Arzneimittelagentur.
- Abgelehnte Humanarzneimittel im EU-Gemeinschaftsregister, abgerufen am 7. März 2019.
- Refusal of the marketing authorisation for Masipro (masitinib). (PDF) EMA, 15. September 2017; abgerufen am 21. September 2017
- D. Petrov, C. Mansfield, A. Moussy, O. Hermine: ALS Clinical Trials Review: 20 Years of Failure. Are We Any Closer to Registering a New Treatment? In: Frontiers in aging neuroscience, Band 9, 2017, S. 68, doi:10.3389/fnagi.2017.00068, PMID 28382000, PMC 5360725 (freier Volltext).