Kupferorganische Verbindungen
Kupferorganische Verbindungen oder Kupferorganyle sind metallorganische Verbindungen des chemischen Elementes Kupfer. Ihre häufigste Verwendung finden sie in der organischen Chemie für Synthesen. Aufgrund ihrer hohen Reaktivität werden sie meist nicht als fertiges Reagenz gekauft, sondern entweder direkt vor der gewünschten Reaktion hergestellt und sofort verwendet oder sie entstehen währenddessen (in situ).
Verbindungen
Kupfer bildet mit organischen Resten, d. h. Molekülteilen, die überwiegend aus Kohlenwasserstoffen bestehen (hier mit R abgekürzt), eine Reihe von Verbindungstypen, die nach der stöchiometrischen Zusammensetzung und anderen, neben Kupfer noch beteiligten Metallen unterschieden werden. Zu jedem dieser Verbindungstypen gehört jeweils eine große Zahl von Verbindungen mit unterschiedlichen organischen Resten wie Methyl- oder Ethylresten. Die komplexeren kupferorganischen Verbindungen mit mehr als einem organischen Rest werden auf Grund ihrer R2Cu−-Anionen auch als organische Cuprate (von lat. cuprum=Kupfer, at: Anion-Endung, vgl. Sulfat) bezeichnet.
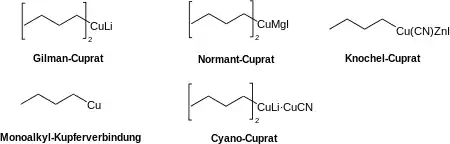
Die wichtigsten Verbindungsklassen sind:
- Gilman-Cuprate (nach Henry Gilman) mit der allgemeinen Formel R2CuLi
- Normant-Cuprate (nach J. F. Normant) mit der allgemeinen Formel R2CuMgX
- Knochel-Cuprate (nach P. Knochel) mit der allgemeinen Formel RCu(CN)ZnX
- Monoalkyl-Kupferverbindungen mit der allgemeinen Formel RCu
- Cyano-Cuprate mit der allgemeinen Formel R2CuLi · LiCN
Neben den „normalen“ Cupraten, die auch als Cuprate niederer Ordnung bezeichnet werden, existieren auch solche höherer Ordnung mit der allgemeinen Formel MenCumRn+m (Me=Metall).[1]
Geschichte
Als erste Kupfer-Kohlenstoff-Verbindung wurde 1859 von Rudolf Christian Böttger das Kupferacetylid Cu2C2, eine explosive Verbindung von Kupfer und Ethin, hergestellt. Die eigentliche Erforschung begann 1936 mit Henry Gilman, der zunächst die Reaktion von Monoalkylkupferverbindungen mit Halogenalkanen erforschte. 1941 erkannte Kharash, dass Grignard-Verbindungen mit 2-Cyclohexen-1-on in Anwesenheit von Kupfersalzen nicht zum 1,2-Produkt (wie es bei Reaktionen von Grignard-Verbindungen mit Ketonen normal gewesen wäre), sondern zum 1,4-Produkt reagieren. Im Jahr 1952 konnte Gilman dann mit (CH3)2CuLi das erste organische Cuprat synthetisieren.[1]
Herstellung
Organische Kupferverbindungen werden durch Transmetallierung, d. h. durch Austausch des Metalls im Molekül, aus anderen metallorganischen Verbindungen und Kupferhalogeniden, meist Kupfer(I)-iodid oder Kupfer(I)-bromid hergestellt. Auch Pseudohalogenide wie Kupfer(I)-cyanid sind als Kupferspender für die Synthese dieser Verbindungen möglich.
-
- Reaktion von Kupfer(I)-iodid und Butyllithium (Bu=Butylrest)
-
- Reaktion von Kupfersalz und Grignard-Verbindung (Bu=Butylrest)
-
Für die einzelnen Reagenzklassen werden unterschiedliche Vorläuferreagenzien benötigt. Bei den Gilman-Cupraten sind es Organische Lithiumverbindungen, wie beispielsweise Butyllithium oder Methyllithium. Bei den Normant-Cupraten dienen Grignard-Verbindungen, also organische Verbindungen des Magnesiums, als Ausgangssubstanzen, bei den Knochel-Cupraten organische Zinkverbindungen. Dabei ist auf die richtige Stöchiometrie zu achten: Bei einem Verhältnis von 1:1 entstehen Monoalkyl-Kupferverbindungen, bei 2:1 von organischer Verbindung zu Kupfersalz Cuprate und bei noch größeren Überschüssen an organischen Reagenzien Cuprate höherer Ordnung.
Es können auch zwei metallorganische Verbindungen verwendet werden, die sich in ihren organischen Resten unterscheiden. Einer dieser beiden ist hier meist eine unreaktive Verbindung, häufig Thiophen. Da bei einer Reaktion eines Cuprates immer nur ein organischer Rest reagiert, hat dies den Vorteil, dass man Reagenzien, die sonst bei der Reaktion verloren gehen würden, spart. Dies ist vor allem bei komplizierteren und damit schwerer herzustellenden Molekülen wichtig.
- Herstellung von organischen Kupferverbindungen mit unterschiedlichen Resten (Bu=Butylrest, Thio=Thiophen)
Eigenschaften
Es sind bisher nur kupferorganische Verbindungen bekannt, bei denen Kupfer die Oxidationsstufe +I, in Zwischenstufen auch +III besitzt. Organische Kupfer(II)-Verbindungen zerfallen sofort unter Bruch der Kupfer-Kohlenstoff-Bindung. Da die Kupfer-Sauerstoff-Bindung sehr viel stärker als die Kupfer-Kohlenstoff-Bindung ist, sind die meisten organischen Kupferverbindungen sehr empfindlich gegen Sauerstoff und Wasser. Reaktionen mit ihnen müssen daher in inerten organischen Lösungsmitteln, wie Diethylether oder 1,4-Dioxan, und unter Luftabschluss (z. B. Argon) durchgeführt werden.
Monoalkyl-Kupferverbindungen
Monoalkyl-Kupferverbindungen haben die allgemeine Formel RCu; R ist dabei ein organischer Rest. Der Rest kann eine Alkylgruppe, ein Aromat, ein Alken oder ein Alkin sein. Auch kompliziertere oder größere Reste sind möglich. Es dürfen jedoch keine nucleophilen funktionellen Gruppen, wie Ester- oder Alkoholgruppen, im Molekül vorhanden sein, da diese sowohl mit anderen kupferorganischen Verbindungen, als schon bei der Herstellung mit den dafür nötigen Reagenzien (z. B. Grignard-Verbindungen) reagieren.
Kupferorganische Verbindungen sind wie andere metallorganische Verbindungen nucleophil, d. h., sie übertragen bei der Reaktion ihren organischen Rest an elektrophile Stellen in anderen Molekülen. Dadurch kommt es zur Knüpfung einer Kohlenstoff-Kohlenstoff-Einfachbindung.
Monoalkyl-Kupferverbindungen sind häufig explosiv und zersetzen sich leicht. Sie sind darum schwer zu handhaben und werden auch selten oder nur in katalytischen Mengen eingesetzt. Dies betrifft vor allem die Verbindungen, deren organischer Rest klein ist. So zersetzt sich Methylkupfer (CH3Cu) schon ab −15 °C, während Phenylkupfer (C6H5Cu) bei 100 °C in einer inerten Atmosphäre noch stabil ist.[2]
Die Struktur vieler kupferorganischen Verbindungen ist tetramer, sie sind aus jeweils vier verbrückten CuR-Einheiten aufgebaut. Dadurch ergibt sich eine viereckige Struktur, wobei sich organische Molekülteile an den Ecken und Kupfer auf den Seitenkanten befindet. Eine Ausnahme ist Methylkupfer, diese Verbindung ist polymer aus langen Cu-Me-Cu-Ketten aufgebaut.[3]
Cuprate
Cuprate unterscheiden sich in ihren Eigenschaften deutlich von den Monoalkyl-Kupferverbindungen. Sie sind wesentlich stabiler und nucleophiler als diese. Darum werden sie sehr viel häufiger und auch in stöchiometrischen Mengen in Reaktionen verwendet. Die einzelnen Arten an Cupraten unterscheiden sich in ihren Eigenschaften und Reaktionen kaum und können deshalb meist auch alternativ eingesetzt werden. Eine Ausnahme sind die Knochel-Cuprate. Diese sind deutlich weniger reaktiv als die anderen und müssen vor der Reaktion durch den Zusatz von Lewis-Säuren wie Bortrifluorid aktiviert werden. Dadurch ist es möglich, Reaktionen auch mit Molekülen durchzuführen, die normalerweise nicht zugänglich sind. Dies sind vor allem solche, in denen bestimmte funktionelle Gruppen, wie beispielsweise eine Estergruppe, vorhanden sind.
In Lösungen liegen Gilman-Cuprate abhängig vom Lösungsmittel in einem Gleichgewicht von Dimer aus zwei R2CuLi und Monomeren vor.
Reaktionen
Cuprate spielen in einigen Reaktionen der organischen Chemie eine Rolle. Sie werden sowohl als Katalysator als auch stöchiometrisch eingesetzt. Cuprate werden meist nicht direkt eingesetzt, sondern werden erst während der Reaktion aus metallorganischen Verbindungen und Kupferhalogeniden gebildet. Die wichtigsten Reaktionen sind die 1,4-Addition an α,β-ungesättigte Ketone, Carbonsäuren oder Ester, Nucleophile Substitutionen und Kupplungsreaktionen.
1,4-Addition
Die 1,4-Addition (auch Michael-Addition genannt) an α,β-ungesättigte Ketone, Carbonsäuren oder Ester ist die wichtigste Reaktion von kupferorganischen Verbindungen. α,β-ungesättigte Ketone sind Verbindungen, die an dem Kohlenstoffatom, das der Carbonylgruppe benachbart ist, eine Doppelbindung besitzen. Die Zahlen 1 und 4 beziehen sich auf eine Zählung, bei der das Sauerstoffatom der Carbonylgruppe die Zahl 1 erhält und die folgenden Kohlenstoffatome nacheinander nummeriert werden. Bei der 1,4-Addition wird somit eine C-C-Bindung an der Doppelbindung gebildet, diese wird zu einer Einfachbindung.
_V2.svg.png.webp)
Nucleophile Substitution
Neben der 1,4-Addition ist die nucleophile Substitution eine weitere wichtige Reaktion von Cupraten. Bei dieser Reaktion überträgt das Cuprat einen organischen Rest an ein Kohlenstoffatom, das eine geeignete Abgangsgruppe trägt, und bildet eine C-C-Bindung. Dabei wird die Abgangsgruppe, beispielsweise ein Iodid- oder Bromid-Ion abgespalten. Der Mechanismus verläuft nach dem sogenannten SN2-Mechanismus, d. h. der Angriff des nucleophilen Kohlenstoffes und die Abspaltung der Abgangsgruppe finden gleichzeitig statt.
- Nucleophile Substitution von Methyliodid und Knüpfung einer C-C-Bindung
Kupplungen
Kupfer katalysiert einige Kupplungsreaktionen von organischen Molekülen. Dabei bilden sich in Zwischenstufen kupferorganische Verbindungen. Es wird zwischen einigen Kupplungen mit unterschiedlichen Reagenzien und Reaktionsbedingungen unterschieden. Eine wichtige Kupplung ist die Sonogashira-Kupplung, bei der zunächst ein terminales Alkin (d. h. ein Alkin, das an einer Seite ein Wasserstoff-Atom besitzt) mit dem Kupfersalz zu einer Kupfer-Alkin-Verbindung reagiert. Diese wird dann unter Palladium-Katalyse mit einem Halogenalkan gekuppelt.[4]
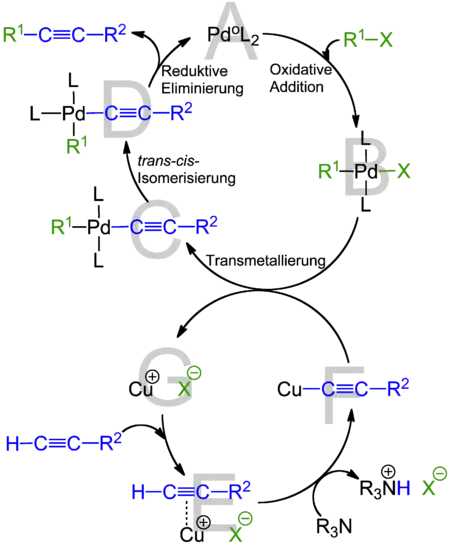
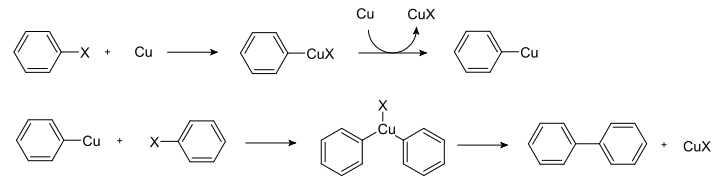
Neben dieser Kupplung, die neben Kupfer auch noch einen Palladium-Katalysator erfordert, gibt es noch einige Palladium-freie Kupplungsreaktionen. Dies sind vor allem die Ullmann- und die Glaser-Kupplung. Bei der Ullmann-Kupplung werden symmetrische Biaryle bei erhöhter Temperatur mit Hilfe von Kupfer(I)-iodid synthetisiert.[5] Bei der Glaser-Kupplung werden terminale Alkine mit Hilfe von Kupferhalogeniden und Sauerstoff miteinander verbunden.[6]
Einzelnachweise
- Chr. Elschenbroich: Organometallchemie, 5. Auflage, 2005, S. 234.
- H. Heaney, S. Christie: Product class 4: Organometallic complexes of copper. In: Josef Houben, Theodor Weyl, I. A. O'Neil: Science of Synthesis Band 3, Thieme Verlag, 2004, S. 529.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1452.
- Reinhard Brückner: Reaktionsmechanismen: Organische Reaktionen, Stereochemie, moderne Synthesemethoden. 3. Auflage. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 715.
- Reinhard Brückner: Reaktionsmechanismen: Organische Reaktionen, Stereochemie, moderne Synthesemethoden. 3. Auflage. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 689.
- Christoph Elschenbroich: Organometallchemie. 5. Auflage. Teubner B.G. GmbH, Wiesbaden 2005, ISBN 3-519-53501-7, S. 241.
Literatur
- H.Heaney, S.Chistie: Product class 4:organometallic complexes of copper, Science of Synthesis, 2004 (S. 305–662) (engl.)
- Christoph Elschenbroich: Organometallchemie. 5. Auflage. Teubner B.G. GmbH, Wiesbaden 2005, ISBN 3-519-53501-7, S. 234–245.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1451–1452.