Kupfer(I)-iodid
Kupfer(I)-iodid ist das Kupfersalz der Iodwasserstoffsäure. In völlig reinem Zustand handelt es sich um ein weißes Pulver.[4]
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Cu+ _ I− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kupfer(I)-iodid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Verhältnisformel | CuI | ||||||||||||||||||
| Kurzbeschreibung |
rein weißes Kristallpulver[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 190,44 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
1290 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,1 mg·m−3[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
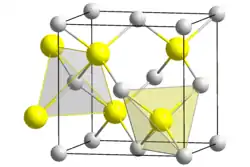
Aufgrund der Elektronenkonfiguration d10 sind Kupfer(I)-Verbindungen diamagnetisch. Kupferiodid kristallisiert in der Sphaleritstruktur.[5] Es ist deutlich weniger lichtempfindlich, als Kupfer(I)-bromid und Kupfer(I)-chlorid, setzt aber dennoch unter Lichteinwirkung an der Raumluft unter leichter Zersetzung geringe Mengen Iod frei. Mit einer Löslichkeit von 0,00042 g/l bei 25 °C ist die Verbindung quasi unlöslich in Wasser.[6]
Struktur
Kupfer(I)-iodid weist ein komplexes Phasendiagramm auf, welches die Existenz multipler kristalliner Formen wiedergibt. Es ist tetraedrisch koordiniert, wenn es sich in der Zinkblendestruktur befindet, in welcher es unterhalb von 300 °C kristallisiert[6]. Der Atomabstand zwischen Kupfer- und Iodatom beträgt 2,338 Å.[7]
Gewinnung und Darstellung
Im Labor kann Kupfer(I)-iodid durch Lösen von Kupfer in konzentrierter Iodwasserstoffsäure, Umsetzung von Kupfer(I)-cyanid mit Iodwasserstoff oder durch Mischen eines Kupfer(II)-salzes (meist einer Kupfersulfatlösung) und einer Kaliumiodidlösung hergestellt werden.
Insbesondere die letzte Variante kann, in Form der Titration einer Kupfer(II)-sulfat-Lösung mit einer stöchiometrischen Lösung von Kaliumiodid und Natriumthiosulfat, verwendet werden, um ein möglichst sauberes Produkt zu erhalten:[6]
Das intermediär gebildete Kupfer(II)-iodid ist instabil und zerfällt beinahe augenblicklich in das Kupfer(I)-iodid und freies Iod. Dieser Zerfall bildet die Grundlage für die iodometrische Bestimmung von Kupfer. Da dieses Iod jedoch im Überschuss dazu neigt das erhaltene Produkt zu verunreinigen und lösliche Kupferiodid-Komplexe zu bilden, wird es durch das eingesetzte Thiosulfat aus der Reaktion entfernt und man erhält die Gesamtgleichung:
Bei der industriellen Herstellung wird Iod-Dampf auf Kupfermetall geleitet:
Einzelnachweise
- Eintrag zu CUPROUS IODIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2022.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 976.
- Eintrag zu Kupfer(I)-iodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Kupferiodide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juni 2014.
- Erwin Riedel, „Anorganische Chemie“, 4. Auflage, de Gruyter Verlag, ISBN 3-11-016602-X.
- George B. Kauffmann and Robert P. Pinnell: Copper(I) iodide. In: Eugene G. Rochow (Hrsg.): Inorganic Syntheses. Band 6. McGraw-Hill Book Company, Inc., 1960, S. 3–6 (englisch).
- A. F. Wells: Structural Inorganic Chemistry. Oxford University Press, Oxford. 5. Auflage 1984, S. 410 und 444.



_iodide.jpg.webp)