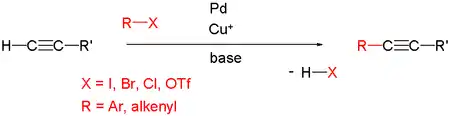
Sonogashira-Kupplung
Die Sonogashira-Kupplung, manchmal auch Sonogashira-Hagihara-Kupplung, ist eine der modernen Namensreaktionen der organischen Chemie. Es handelt sich dabei um eine palladiumkatalysierte Kreuzkupplung zwischen Arylhalogeniden und endständigen Alkinen. Sie wurde in den 1970er Jahren durch Kenkichi Sonogashira und Nobue Hagihara entwickelt und 1975 publiziert. Sie stellt eine Weiterentwicklung der Stephens-Castro-Kupplung dar.[1]
Die Cacchi-Kupplung unterscheidet sich von der Sonogashira-Kupplung in Ausgangsmaterial und Reaktionsablauf: So werden statt Arylhalogeniden Aryltriflate verwendet. Der Reaktionsmechanismus verläuft statt über einen neutralen Komplex über einen positiv geladenen Pd-Komplex und das negativ geladene Triflat-Anion.
Katalysatoren
Diese Art von Kreuzkupplungen benötigen zwei Katalysatoren, einen nullwertigen Palladiumkomplex und ein Kupferhalogenid. Dabei aktiviert das Palladium durch oxidative Addition die Aryl-Halogen- beziehungsweise Aryl-Triflat-Bindung, während das Kupfersalz und das Alkin in einer Zwischenstufe zu einer organischen Kupferverbindung reagieren. Anschließend wird das Kupfer gegen Palladium ausgetauscht. Es sind Beispiele bekannt, bei denen die Kupplung auch ohne Kupfersalz funktioniert.
Mechanismus
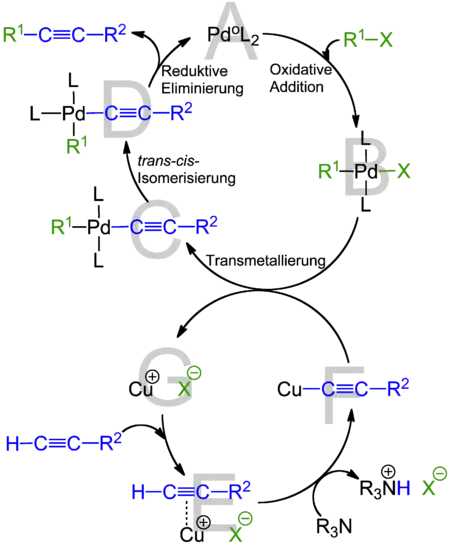
Die Reaktion benötigt ein basisches Lösungsmittel, so dass Sonogashira- und Cacchi-Kupplungen oft in Aminen wie Triethylamin, Diisopropylamin oder Ethyl-diisopropylamin durchgeführt werden. Als Folge der Unbeständigkeit der Palladiumkomplexe gegen Luft wird die Reaktion in der Regel unter Schutzgasatmosphäre durchgeführt, wobei das Schutzgas (z. B. Argon, Stickstoff) auch eine eventuelle sauerstoffunterstützte Dimerisierung des eingesetzten Alkins verhindert. Die Triebkraft der Reaktion ist die Bildung des Salzes CuX, da dieses eine thermodynamische Senke darstellt und die Bildung somit energetisch günstig ist.
Palladium-Zyklus
- Die reaktive Palladium(0)-Spezies ist der 14 Elektronenkomplex Pd(0)L2 A (z. B. mit zwei Triphenylphosphan-Liganden). Dieser reagiert mit dem Arylhalogenid bzw. -triflat R1X in einer oxidativen Addition zu einem Pd(II)-Komplex B
- Im folgenden geschwindigkeitsbestimmenden Schritt der Transmetallierung reagiert der gebildete Komplex B mit dem Kupferacetylid zu Komplex C. Das Kupferacetylid wurde zuvor in situ im Kupfer-Zyklus generiert, unter Freisetzung eines Kupferhalogenids (hier CuX).
- Die beiden organischen Liganden stehen trans zueinander, eine nun folgende trans → cis-Isomerisierung liefert Komplex D.
- Im produktbildenden Schritt wird das Produkt, ein unsymmetrisch substituiertes Alkin, durch reduktive Eliminierung freigesetzt und der Pd(0)-Katalysator regeneriert.
Kupfer-Zyklus
- Die größte Limitierung der Sonogashira-Kupplung ist die Deprotonierung des terminalen Alkins. Dies beruht darauf, dass die verwendeten Amine (z. B. Triethylamin) eine zu geringe Basizität besitzen. Vermutlich ist eine Deprotonierung auch nach der anfänglichen Bildung des Pi-Alkin-Komplex E noch möglich.
- Das Kupferacetylid F reagiert nach ihrer Bildung mit dem Palladium-Intermediat B unter Regeneration des Kupferhalogenids CuX G.
- Es wird angenommen, dass das Kupferacetylid an der Reduktion der Pd(II)-Spezies beteiligt ist. Hierbei wird zunächst ein Dialkin-PdL2-Komplex gebildet. Anschließend erfolgt durch reduktive Eliminierung die Regeneration der Pd(0)-Spezies und die Freisetzung eines Diacetylens als Produkt. Daher kann die Glaser-Kupplung (Kupplung zweier Acetylene) als Nebenreaktion angesehen werden. Um die durch die Glaser-Kupplung entstehenden Homokupplungs-Produkte zu minimieren, gilt es die Sauerstoff-Konzentration so gering wie möglich zu halten.
Entwicklungen
Neuere luftstabile Palladiumkomplexe ermöglichen Reaktionen unter normaler Atmosphäre. Weitere aktuelle Forschungen dienen der kupferfreien oder sogar lösungsmittelfreien Synthese.[2] Als eine weitere Erweiterung kann die Benutzung verdünnter wässriger Ammoniaklösung (c = 0,5 mol/L) als Reaktionsmedium gesehen werden.
Siehe auch
Literatur
- K. Sonogashira, Y. Tohda, N. Hagihara: Tetrahedron Lett. 1975, S. 4467–4470.
- K. Sonogashira; Journal of Organometallic Chemistry. 653, 2002, S. 46–49.
- B. Liang, M. Dai, J. Chen, Z. Yang: J. Org. Chem. 70, 2005, S. 391–393.
- A. Mori, M. S. M. Ahmed, A. Sekiguchi, K. Masui, T. Koike: Chemistry Letters. 2002, S. 756–757.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Spektrum, München 2004, ISBN 3-8274-1579-9.
- R. Chinchilla, C. Nájera: Chem. Rev. 107, 2007, S. 874–922.
- A. G. Myers, P. S. Dragovich: Synthesis of functionalized Enynes by Palladium/Copper-Catalyzed Coupling Reactions of Acetylenes with (Z)-2,3-Dibromopropenoic Acid Ethyl Ester: (Z)-2-Bromo-5-(Trimethylsilyl)-2-Penten-4-Ynoic Acid Ethyl Ester In: Organic Syntheses. 72, 1995, S. 104, doi:10.15227/orgsyn.072.0104; Coll. Vol. 9, 1998, S. 117 (PDF).
- J. A. Marshall, C. A. Sehon: Isomerization of β-Alkynyl Allylic Alcohols to Furans Catalyzed by Silver Nitrate on Silica Gel: 2-Pentyl-3-Methyl-5-Heptylfuran In: Organic Syntheses. 76, 1999, S. 263, doi:10.15227/orgsyn.076.0263; Coll. Vol. 10, 2004, S. 599 (PDF).
Einzelnachweise
- Sonogashira, K.; Tohda, Y.; Hagiwara, N. Tetrahedron Lett. 1975, 50, 4467.
- Liang, Y.-X. Xie, J.-H. Li, J. Org. Chem., 2006, 71, 379–381.