2-Cyclohexen-1-on
2-Cyclohexen-1-on ist eine chemische Verbindung aus der Gruppe der Enone, d. h. ein Keton mit C=C-Doppelbindung. Die Substanz ist im reinen Zustand eine farblose Flüssigkeit; das kommerziell erhältliche Produkt ist meist gelblich gefärbt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
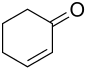 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Cyclohexen-1-on | ||||||||||||||||||
| Andere Namen |
Cyclohex-2-enon | ||||||||||||||||||
| Summenformel | C6H8O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 96,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,99 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
167–169 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,4883 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Zur Herstellung von 2-Cyclohexen-1-on gibt es mehrere verschiedene Synthesewege, von denen nur einige hier genannt seien:
Eine für den Labormaßstab gut ausgearbeitete Methode ist die Reduktion und saure Hydrolyse von 3-Ethoxy-2-cyclohexen-1-on, welches wiederum aus Resorcin über das 1,3-Cyclohexandion zugänglich ist:
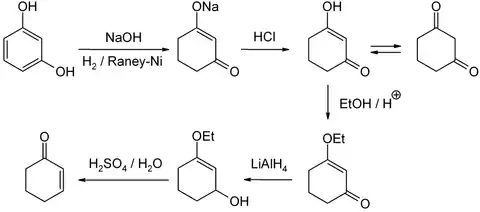
Steht flüssiges Ammoniak zur Verfügung, ist es ausgehend von Anisol durch Birch-Reduktion mit anschließender saurer Hydrolyse und Umlagerung der C–C-Doppelbindung erhältlich:
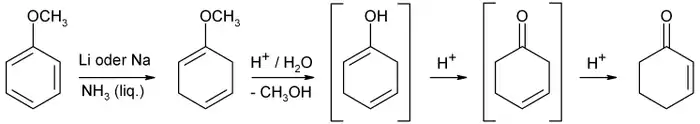
Ebenfalls recht gut ist es aus Cyclohexanon durch α-Bromierung und Eliminierung, oder aus 3-Chlorcyclohexen mittels Hydrolyse und Oxidation erhältlich.
Technisch wird 2-Cyclohexen-1-on durch katalytische Oxidation von Cyclohexen, z. B. mit Wasserstoffperoxid an Vanadiumkatalysatoren, hergestellt. Es sind mehrere Verfahrensvarianten mit unterschiedlichen Oxidationsmitteln bzw. Katalysatoren patentiert.
Eigenschaften
Physikalische Eigenschaften
2-Cyclohexen-1-on hat einen Schmelzpunkt von −53 °C, einen Siedepunkt von etwa 170 °C und einen Flammpunkt von 56 °C.[4] Es ist bei Raumtemperatur eine leichtbewegliche, klare Flüssigkeit, die mit 0,993 g·cm−3 eine Dichte ähnlich der von Wasser aufweist.
Es ist mit vielen Lösungsmitteln, wie z. B. Alkoholen (Methanol, Ethanol), Ethern (Diethylether, Tetrahydrofuran, 1,4-Dioxan, tert-Butylmethylether), Halogenalkanen (Dichlormethan, Chloroform), Estern (Ethylacetat) und auch mit polaren, aprotischen Lösungsmitteln (Dimethylformamid, Dimethylsulfoxid) unbegrenzt mischbar.
Die Löslichkeit in Wasser beträgt 41,3 g·l−1 bei pH 7 und 25 °C.
Chemische Eigenschaften
2-Cyclohexen-1-on kann sowohl übliche Reaktionen von Ketonen (z. B. Acetalbildung) als auch von Alkenen (z. B. elektrophile Additionen, Cycloadditionen, Epoxidierung) eingehen. Als typischer Vertreter der α,β-ungesättigten Carbonylverbindungen besitzt es eine elektronenarme C–C-Doppelbindung, die auch als Elektrophil fungieren kann. Mit starken Basen kann es an den Positionen 4 und 6 (die beiden CH2-Gruppen, die der Carbonylgruppe bzw. der C–C-Doppelbindung benachbart sind) deprotoniert werden.
Verwendung
Es ist ein oft verwendeter Synthesebaustein in der organischen Chemie, da es viele verschiedene Möglichkeiten der Molekülgerüst-Erweiterungen bietet. Beispielsweise kann es leicht in einer Michael-Addition mit Nukleophilen (wie etwa Enolaten oder Silylenolethern) oder auch im Sinne einer Diels-Alder-Reaktion mit elektronenreichen Dienen umgesetzt werden. Weiterhin reagiert es mit Organokupfer-Verbindungen unter 1,4-Addition (Michael-Addition) oder mit Grignard-Verbindungen unter 1,2-Addition, d. h. mit Angriff des Nukleophils am Carbonyl-Kohlenstoffatom. Es wird z. B. in mehrstufigen Totalsynthesen beim Aufbau von polycyclischen Naturstoffen eingesetzt.
Literatur
- W. F. Gannon, H. O. House: 2-Cyclohexenone In: Organic Syntheses. 40, 1960, S. 14, doi:10.15227/orgsyn.040.0014; Coll. Vol. 5, 1973, S. 294 (PDF).
- W. F. Gannon, H. O. House: 3-Ethoxy-2-Cyclohexenone In: Organic Syntheses. 40, 1960, S. 41, doi:10.15227/orgsyn.040.0041; Coll. Vol. 5, 1973, S. 539 (PDF).
- R. B. Thompson: Dihydroresorcinol In: Organic Syntheses. 27, 1947, S. 21, doi:10.15227/orgsyn.027.0021; Coll. Vol. 3, 1955, S. 278 (PDF).
Einzelnachweise
- Datenblatt 2-Cyclohexen-1-on bei AlfaAesar, abgerufen am 15. Dezember 2010 (PDF) (JavaScript erforderlich).
- Datenblatt 2-Cyclohexen-1-on (PDF) bei Merck, abgerufen am 20. März 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-128.
- Eintrag zu 2-Cyclohexen-1-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Januar 2020. (JavaScript erforderlich)

