Ketoester
Ketoester oder Oxoester sind chemische Verbindungen die neben einer Carbonylgruppe eine Carbonsäureester-Funktion aufweisen und die sich von den Ketosäuren ableiten. Der Abstand zwischen den beiden funktionellen Gruppen wird durch die griechischen Buchstaben α (1,2-Abstand), β (1,3-Abstand), γ (1,4-Abstand) etc. gekennzeichnet.[1]
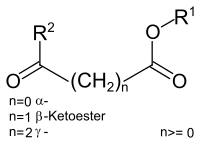
Aufgrund ihrer Reaktivität sind insbesondere die β-Ketoester von Bedeutung.
α-Ketoester
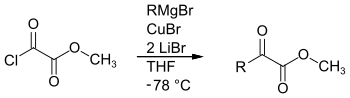
α-Ketoester sind durch eine Kreuzkupplung von Methyloxalylchlorid[2] mit Grignard-Verbindungen in Gegenwart von Kupfer(I)-bromid und Lithiumbromid zugänglich.[3]
Eine alternative Synthese geht von Benzylhalogeniden aus, die durch Luftoxidation in Gegenwart von Sonnenlicht und Tris(2,2'-bipyridyl)ruthenium(II)dichlorid[4] als Cokatalysator zu Aryl-α-ketoestern umgesetzt werden.[5]
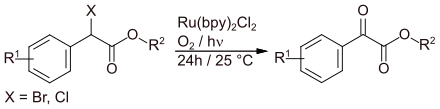
Aryl-α-ketoester können in einer Eintopfreaktion durch den Transfer einer Diazogruppe von 4-Acetamidobenzolsulfonylazid[6] auf einen Arylessigester, gefolgt von einer Oxidation mit Dimethyldioxiran erhalten werden.[7]
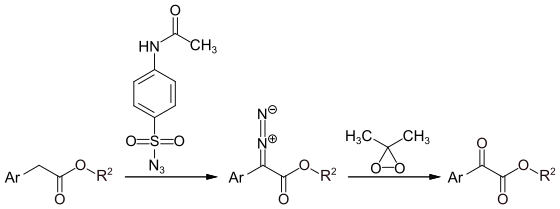
Alternativ kann die Oxidation auch durch eine Dirhodiumacetat-katalysierte Reaktion mit Azodicarbonsäurediethylester erfolgen.[8]
α-Ketoester sind wichtige Zwischenstufen für die Synthese von α-Iminoestern, Succinaten, Furan-Derivaten, α-Oxiranylestern, chiralen α-Hydroxyestern, sowie bei der asymmetrischen Synthese von biologisch aktiven Verbindungen wie beispielsweise Ritalin.[8]
β-Ketoester
Darstellung
β-Ketoester lassen sich durch eine Claisen-Kondensation herstellen. Dabei wird mit einer starken Base das α-Proton eines Monoesters zu einem mesomeriestabilisierten Carbanion abgespalten. Das Carbanion greift nucleophil ein weiteres Estermolekül an und unter Abspaltung eines Alkoholats bildet sich der β-Ketoester.[9]
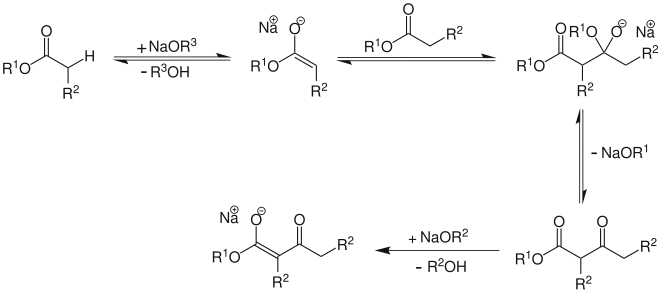
Bei 1,4- und 1,5-Dicarbonsäureestern erhält man cyclische fünf-, bzw. sechsgliedrige β-Ketoester. Diese intramolekulare Claisen-Kondensation ist auch als Dieckmann-Kondensation bekannt.
Der einfachste und wichtigste β-Ketoester ist Acetessigester, der industriell durch Umsetzung von Diketen mit Ethanol hergestellt wird.[10]
Eigenschaften
β-Ketoester zeigen eine Keto-Enol-Tautomerie, bei denen die Ketoform und die Enolform über ein mesomeriestabilisiertes Anion im Gleichgewicht stehen.
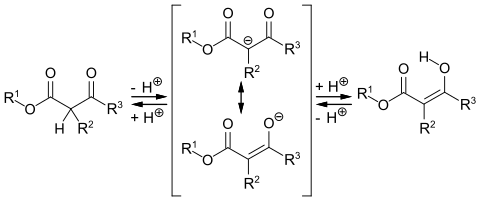
Die Lage des Gleichgewichts hängt von verschiedenen Faktoren, wie Lösungsmittel, Temperatur und Konzentration ab. Die Enolform wird durch Ausbildung einer intramolekularen Wasserstoffbindung stabilisiert.[10]
Die CH-Acidität der zentralen Methylengruppe der β-Ketoester ist aufgrund der beiden direkt verbundenen Carbonylgruppen höher als bei einfachen Ketonen oder Carbonsäureestern.[11]
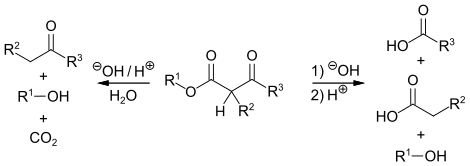
Die β-Ketoester können hydrolytisch in Ketone oder Carbonsäuren gespalten werden. Erfolgt die Hydrolyse mit verdünnten Säuren oder Laugen, so spricht man von der Ketonspaltung. Dabei wird zunächst der Ester zur Säure hydrolysiert. Die entstehende β-Ketosäure ist thermisch instabil und decarboxyliert zu einem Keton. Durch die Säurespaltung erhält man beim Erhitzen von β-Ketoestern mit starken Laugen Carbonsäuren.[10]
Verwendung
Aufgrund ihrer CH-Acidität lassen sich β-Ketoester durch Umsetzung mit Alkylhalogeniden alkylieren, bzw. mit Carbonsäurehalogeniden acylieren.[10]
Durch Umsetzung der β-Ketoester mit einem Aldehyd oder Keton sind in einer Knoevenagel-Reaktion α,β-ungesättigte Carbonylverbindungen zugänglich.[12]
Die Reaktion von β-Ketoestern mit Stickstoffwasserstoffsäure in Gegenwart von Schwefelsäure in einer Schmidt-Reaktion ergibt α-Aminosäuren.[13]
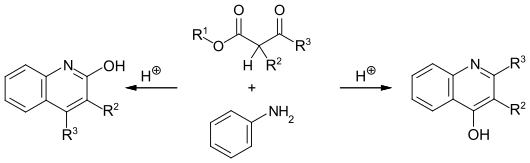
β-Ketoester sind Ausgangsverbindungen zur Darstellung verschiedener Heterocyclen. So führt die Umsetzung mit primären Arylaminen abhängig von den Reaktionsbedingungen entweder bei hoher Temperatur über die Knorr-Chinolin-Synthese zu 2-Hydroxychinolinen oder bei niedriger Temperatur über die Conrad-Limpach-Chinolinsynthese zu 4-Hydroxychonolinen.[14]
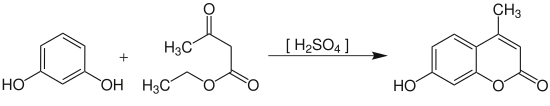
Durch Umsetzung von Phenolen mit β-Ketoestern in einer Pechmann-Kondensation sind substituierte Cumarine zugänglich.[15]
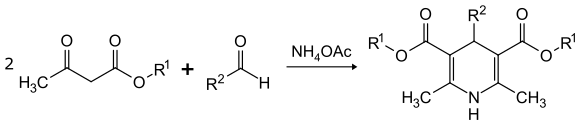
Bei der Hantzschschen Dihydropyridinsynthese erfolgt eine cyclisierende Kondensation von 2 Teilen β-Ketoester mit jeweils einem Teil Aldehyd und Ammoniak, bzw. Ammoniumacetat.[16]
Die Umsetzung von β-Ketoester mit Ammoniak und einem α-Halogenketon führt bei der Hantzschschen Pyrrolsynthese über einen β-Enaminoester als Zwischenstufe zu substituierten Pyrrolen.[17]
.svg.png.webp)
Einzelnachweise
- Eintrag zu Oxoester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Juni 2021.
- Externe Identifikatoren von bzw. Datenbank-Links zu Methyloxalylchlorid: CAS-Nummer: 5781-53-3, EG-Nummer: 227-307-4, ECHA-InfoCard: 100.024.826, PubChem: 79846, ChemSpider: 72139, Wikidata: Q72489213.
- Francesco Babudri, Vito Fiandanese, Giuseppe Marchese, Angela Punzi: A general and straightforward approach to α,ω-ketoesters. In: Tetrahedron. Band 52, Nr. 42, 1996, S. 13513–13520, doi:10.1016/0040-4020(96)00805-8.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tris(2,2'-bipyridyl)ruthenium(II)dichlorid: CAS-Nummer: 14323-06-9, EG-Nummer: 238-266-7, ECHA-InfoCard: 100.034.772, PubChem: 10908382, ChemSpider: 76095, Wikidata: Q3774530.
- Yijin Su, Liangren Zhang, Ning Jiao: Utilization of Natural Sunlight and Air in the Aerobic Oxidation of Benzyl Halides. In: Organic Letters. Band 13, Nr. 9, 2011, S. 2168–2171, doi:10.1021/ol2002013.
- Externe Identifikatoren von bzw. Datenbank-Links zu 4-Acetamidobenzolsulfonylazid: CAS-Nummer: 2158-14-7, EG-Nummer: 606-801-7, ECHA-InfoCard: 100.110.841, PubChem: 5129185, ChemSpider: 4303479, Wikidata: Q72433993.
- Ma, M., Li, C., Peng, L., Xie, F., Zhang, X., Wang, J.: An efficient synthesis of aryl α-keto esters. In: Tetrahedron Letters. Band 46, Nr. 22, 2005, S. 3927–3929, doi:10.1016/j.tetlet.2005.03.199.
- Zhenqiu Guo, Haoxi Huang, Qingquan Fu, Wenhao Hu: Facile Synthesis of Aryl α-Keto Esters via the Reaction of Aryl Diazoacetate with H2O and DEAD. In: Synlett. Band 2006, Nr. 15, 2006, S. 2486–2488, doi:10.1055/s-2006-950412.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 285 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 254 ff.
- Michael B. Smith, Jerry March: March's Advanced Organic Chemistry. Reactions, Mechanisms and Structure. 6. Auflage. John Wiley & Sons, Hoboken, New Jersey 2007, ISBN 978-0-471-72091-1, S. 383 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, 2009, ISBN 978-0-471-70450-8, S. 692.
- Helmut Krauch, Werner Kunz, Eberhard Nonnenmacher: Reaktionen der organischen Chemie. 6. Auflage. Wiley-VCH, Weinheim 1997, ISBN 3-527-29713-8, S. 190.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, 2009, ISBN 978-0-471-70450-8, S. 1621.
- Michael B. Smith, Jerry March: March's Advanced Organic Chemistry. Reactions, Mechanisms and Structure. 6. Auflage. John Wiley & Sons, Hoboken, New Jersey 2007, ISBN 978-0-471-72091-1, S. 712 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 674 f.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 648 (eingeschränkte Vorschau in der Google-Buchsuche).