Schmidt-Reaktion
Bei der Schmidt-Reaktion handelt es sich um eine Namensreaktion in der Organischen Chemie, die nach ihrem Entdecker, dem deutschen Chemiker Karl-Friedrich Schmidt (1887–1971), benannt wurde. Mittels der Schmidt-Reaktion können Carbonsäuren zu primären Aminen und Ketone zu Carbonsäureamiden abgebaut werden.
Schmidt-Reaktion der Carbonsäuren
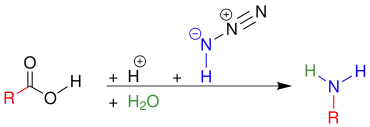
Übersichtsreaktion
Bei dieser Schmidt-Reaktion reagieren Carbonsäuren mit starken Mineralsäuren (meistens Schwefelsäure), mit Stickstoffwasserstoffsäure und mit einer anschließenden Hydrolyse zu primären Aminen.[1]
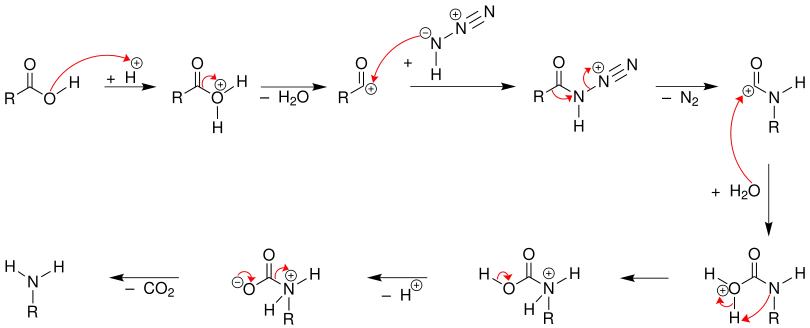
Mechanismus
Hierbei wird zunächst die Hydroxygruppe der Carbonsäure durch Zusatz der starken Säure (Schwefelsäure) protoniert, sodass nach Abspaltung von Wasser ein mesomeriestabilisiertes Acylium-Ion gebildet wird. Dieses wird von der Stickstoffwasserstoffsäure nucleophil angegriffen. Unter Austritt von Stickstoff und unter 1,2-Alkylverschiebung (Umlagerung des Rests R) wird ein Carbenium-Ion erhalten. Durch Hydrolyse und unter Abspaltung eines Protons und von Kohlendioxid wird schließlich das primäre Amin gebildet.
Schmidt-Reaktion der Ketone
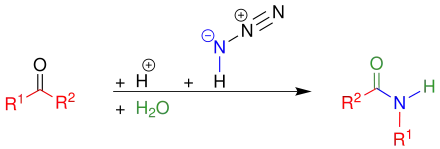
Übersichtsreaktion
Bei dieser Schmidt-Reaktion reagieren Ketone mit starken Mineralsäuren (meistens Schwefelsäure), mit Stickstoffwasserstoffsäure und mit einer anschließenden Hydrolyse zu Carbonsäureamiden.[2]
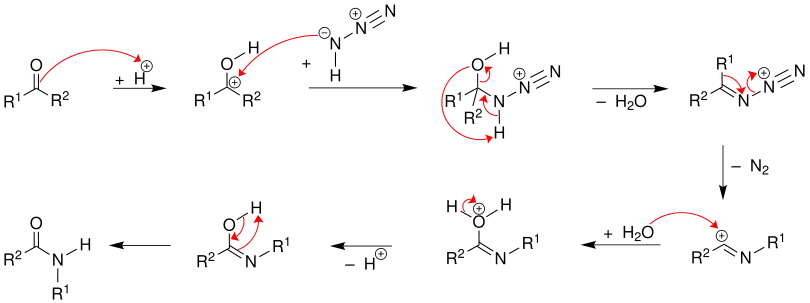
Mechanismus
Bei dieser Reaktion wird zunächst die Carboxygruppe des Ketons durch Zusatz der starken Säure (Schwefelsäure) protoniert. Danach greift die Stickstoffwasserstoffsäure das Carbenium-Ion nucleophil an, wobei anschließend Wasser abgespalten wird. Im nächsten Reaktionsschritt wird Stickstoff freigesetzt und der Rest R1 umgelagert. Dieses Carbenium-Ion wird hydrolysiert und nach Deprotonierung und Tautomerisierung entsteht das Carbonsäureamid.
Die Reaktion verläuft ähnlich der Curtius-Reaktion bzw. der Beckmann-Umlagerung. Gegebenenfalls kann das Amid weiter zu einem Amin hydrolysiert werden.
Siehe auch
Literatur
- Autorenkollektiv: Organikum, 22. Auflage, Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3
- Eberhard Breitmaier, Günther Jung: Organische Chemie, 5. Aufl., 374ff., Thieme, Stuttgart, 2005
Einzelnachweise
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 297–300.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 297–300.