Dieckmann-Kondensation
Die Dieckmann-Kondensation ist eine Namensreaktion der Organischen Chemie und benannt nach dem deutschen Chemiker Walter Dieckmann (1869–1925). Unter dieser Reaktion versteht man in der Chemie eine intramolekulare Claisen-Kondensation von Dicarbonsäureestern zu cyclischen β-Ketoestern.[1][2]
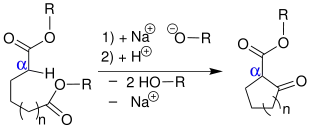

Reaktionsmechanismus
Der Mechanismus ist mit dem der Claisen-Kondensation identisch, jedoch erfolgt ein vollständiger Ablauf der Reaktion nur mit einer stöchiometrischen Menge an Base, die in Form von Alkoholaten, Natriumamid oder Hydriden der Alkalimetalle vorliegt. Die Base bewirkt eine Deprotonierung des Dicarbonsäureesters 1. Im nächsten Schritt erfolgt ein nucleophiler Angriff am Carbonylkohlenstoff. Es kommt zur Abspaltung eines Alkoholats 4 unter Bildung des cyclischen β-Ketoesters 5. Anschließend wird 5 von einem weiteren Alkoholat in α-Position zu beiden Carbonylgruppen deprotoniert. Die Deprotonierung von 5 besitzt eine hohe Triebkraft und ist praktisch irreversibel. So kann das Gleichgewicht zur Seite des gewünschten Produktes verschoben werden. Ist die Reaktion abgeschlossen, setzt man dem Ansatz Säure zu, um das Anion zu neutralisieren, wobei auch alle Alkoholationen ebenfalls protoniert werden und eine Rückreaktion ausgeschlossen ist. Die Produkte einer Dieckmann-Kondensation sind fünf- bis achtgliedrige, cyclische β-Ketoester. Unter bestimmten Voraussetzungen können sogar Ringe mit zwölf C-Atomen oder noch größere synthetisiert werden.[3][4][5] Die Herstellung von 9- bis 13-gliedrigen Ringen ist aufgrund transannularer Spannungen schwer, daher sind die Ausbeuten bei diesen Ringgrößen sehr niedrig, auch dann, wenn man nach dem Ziegler-Ruggli-Verdünnungsprinzip arbeitet.

Siehe auch
Literatur
- R. Brückner: Reaktionsmechanismen. 3. Auflage, 2003, ISBN 978-0-12-429785-2, S. 572 f.
Einzelnachweise
- W. Dieckmann: Zur Kenntniss der Ringbildung aus Kohlenstoffketten. In: Berichte der deutschen chemischen Gesellschaft. 27, Nr. 1, 1894, S. 102–103, doi:10.1002/cber.18940270126.
- W. Dieckmann: Ueber ein ringförmiges Analogon des Ketipinsäureesters. In: Berichte der deutschen chemischen Gesellschaft. 27, Nr. 1, 1894, S. 965–966, doi:10.1002/cber.189402701202.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-369483-6, S. 138–139.
- Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, ISBN 3-342-00280-8, S. 454.
- Hans Beyer, Wolfgang Walter: Organische Chemie. S. Hirzel, Stuttgart 1984, ISBN 3-7776-0406-2, S. 279.