Hantzschsche Pyrrolsynthese
Die Hantzschsche Pyrrolsynthese (Hantzsch’sche Pyrrolsynthese), auch bekannt als die Hantzsch-Pyrrolsynthese, ist eine Namensreaktion der organischen Chemie. Sie wurde nach dem deutschen Chemiker Arthur Hantzsch (1857–1935) benannt, der sie im Jahre 1890 veröffentlichte.[1] Sie dient zur Synthese von Pyrrol und dessen Derivaten.[2][3][4]
Die Reaktion ist mit der Paal-Knorr-Synthese und der Knorr-Pyrrolsynthese verwandt.
Übersicht
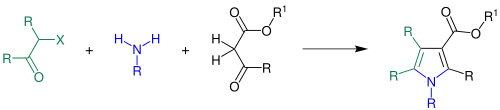
Während der Synthese reagieren β-Ketoester (schwarz) mit einem Amin (blau) und anschließend unter Schließung eines Ringes mit einem α-Halogenketon (grün) zu einem Pyrrolderivat:
Anstelle eines Amins kann auch Ammoniak für die Reaktion verwendet werden. Dann bildet sich ein am Stickstoffatom unsubstituiertes Pyrrolderivat.
Mechanismus
Der Mechanismus wird mit einem allgemeinen β-Ketoester einem α-Halogenketon und einem primären Amin veranschaulicht.
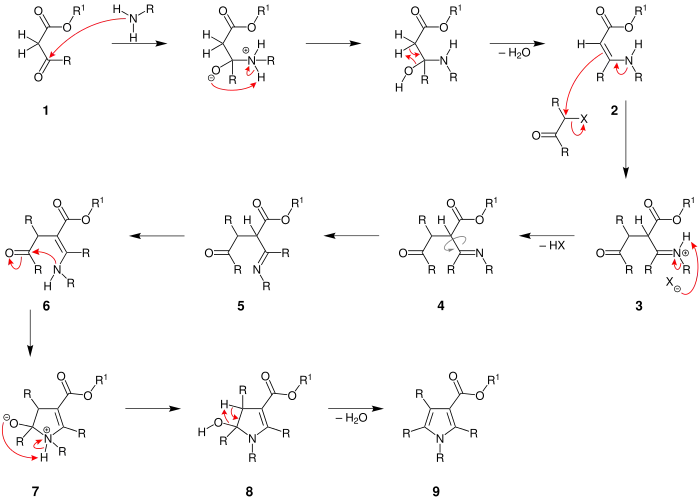 R = Wasserstoff, Alkylgruppe, Arylgruppe; R1 = Alkylgruppe, Arylgruppe; X = Chlor, Brom, Iod[1]
R = Wasserstoff, Alkylgruppe, Arylgruppe; R1 = Alkylgruppe, Arylgruppe; X = Chlor, Brom, Iod[1]
Zu Beginn reagiert der β-Ketoester 1 mit einem primären Amin über mehrere Zwischenstufen zu einem Enamin 2. Dann greift das Enamin im Zuge einer nucleophilen Substitution das α-Halogenketon an und ein Halogenid wird abgespalten. Dieses Halogenid spaltet ein Wasserstoff vom Stickstoff 3 ab und verlässt die Reaktion als Halogenwasserstoff (hier als HX dargestellt). Damit ist ein Imin 4 entstanden, dessen Imingruppe im nächsten Schritt gedreht wird 5. Es folgt eine Isomerisierung des Imins zum Enamin-Tautomer 6. Dann wird das Kohlenstoffatom der Carbonylgruppe 6 von der Aminogruppe angegriffen und damit der Fünfring 7 geschlossen. Nach der Umlagerung eines Protons 7 wird Wasser aus dem Molekül 8 abgespalten. Es entsteht das Produkt 9 in Form eines Pyrrolderivats.[1][5]
Modifikationen
Anstelle der drei ursprünglichen Edukte kann die Reaktion auch zwischen einem Enamin des β-Ketoester und einem α-Halogenketon durchgeführt werden. Außerdem kann die Reaktion durch die Wahl der Edukte dazu benutzt werden Indol- bzw. Carbazolderivate zu synthetisieren.[1] So reagieren beispielsweise o-Aminoacetophenon und α-Chloracetophenon zu 2-Benzoyl-3-methyl-indol:[1][6]
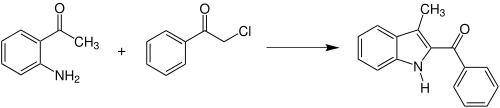 Anwendungsbeispiel der Hantzschschen Pyrrolsynthese
Anwendungsbeispiel der Hantzschschen Pyrrolsynthese
Einzelnachweise
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1326–1327.
- A. Hantzsch: Neue Bildungsweise von Pyrrolderivaten. In: Berichte der deutschen chemischen Gesellschaft. Band 23, Nr. 1, 1890, S. 1474–1476, doi:10.1002/cber.189002301243.
- W. Uhl, A. Kyriatsoulis: Namen- und Schlagwortreaktionen in der Organischen Chemie. 5. durchges. Auflage, Springer Fachmedien, Wiesbaden 1984, ISBN 978-3-663-02003-5, S. 230–232.
- F. Feist: Studien in der Furan- und Pyrrol-Gruppe. In: Berichte der deutschen chemischen Gesellschaft. Band 35, Nr. 2, 1902, S. 1537–1544, doi:10.1002/cber.19020350263.
- J. J. Li: Name Reactions. A Collection of Detailed Reaction Mechanisms. 3. erweiterte Auflage, Springer-Verlag, Berlin/Heidelberg 2006, ISBN 978-3-540-30030-4, S. 283–284.
- C. D. Jones, T. Suarez: Direct synthesis of 2-acylindoles. In: J. Org. Chem. Band 37, Nr. 23, 1972, S. 3622–3623, doi:10.1021/jo00796a012.