Claisen-Kondensation
Die Claisen-Kondensation oder Claisen-Geuter-Kondensation ist eine Reaktion aus dem Bereich der Organischen Chemie. Sie wurde nach ihrem Entdecker, dem deutschen Chemiker Ludwig Claisen (1851–1930), benannt. Unter der Reaktion versteht man die basenvermittelte Acylierung eines Esters mit einem zweiten Estermolekül zu einem β-Ketocarbonsäureester.

Übersichtsreaktion
Die Claisen-Kondensation wird hier beispielhaft an der Reaktion von zwei Molekülen des Essigsäureethylesters mit Ethanolat als Base durchgeführt.
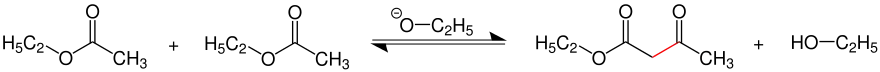
Die rot eingezeichnete Bindung steht für die neu geknüpfte C-C-Einfachbindung innerhalb des entstandenen β-Ketocarbonsäureesters.
Als Basen können auch andere Natriumalkoholate, Natriumamid oder Natriumhydrid zur Anwendung kommen.
Reaktionsmechanismus
Der folgende Mechanismus der Claisen-Kondensation wird an der Beispielreaktion von zwei Molekülen Essigsäureethylester mit Ethanolat als Base erklärt.

Zunächst wird ein Essigsäureethylester (1) in α-Position zur Carbonylgruppe durch zugesetztes Natriumethanolat deprotoniert. Es bildet sich das Enolat 2. Dieses reagiert dann mit einem weiteren Molekül des Essigsäureethylesters über eine Zwischenstufe zum β-Ketocarbonsäureester, im Beispiel dem Acetessigsäureethylester (3). Der β-Ketocarbonsäureester reagiert mit einem weiteren Alkoholat zu einem mesomeriestabilisierten Anion 4. Nach wässrig-saurer Aufarbeitung erhält man letztendlich den gewünschten β-Ketocarbonsäureester 3. Der letzte Schritt ist als einziger Schritt im gesamten Mechanismus irreversibel. Da Ethanol eine stärkere Säure als der CH-acide Ester 1 ist, liegt das Gleichgewicht zwischen 1 und 2 auf der Seite von 1. Hingegen ist der β-Ketocarbonsäureester 3 eine stärkere Säure als Ethanol. Deshalb liegt das Gleichgewicht zwischen 3 und 4 auf der Seite des mesomeriestabilisierten Anions 4 und man benötigt stöchiometrische Mengen der Base – also des Ethanolats. Dadurch wird der β-Ketocarbonsäureester 3 unter Bildung von 4 im letzten Schritt aus dem Reaktionsgemisch entfernt und so die Claisen-Kondensation ermöglicht. Die Protonierung bei der Aufarbeitung von 4 liefert dann den β-Ketocarbonsäureester 3.[1][2][3]
Die cyclische, intramolekulare Claisen-Kondensation wird als Dieckmann-Kondensation bezeichnet.[4]
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 454.
- Hans Beyer, Wolfgang Walter: Organische Chemie. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 279.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/San Diego/London 2005, ISBN 0-12-369483-3.
- Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 219.