Lily-Mottle-Virus
Das Lily-Mottle-Virus (LMoV oder LiMV), selten als Lilienscheckungsvirus bezeichnet, ist ein Pflanzenvirus der Virusfamilie Potyviridae, das bei Pflanzen aus der Familie der Liliengewächse (Liliaceae) zu symptomlosen bis milden Erkrankungen einzelner Pflanzenteile führt. Eine häufig vorkommende gleichzeitige Infektion mit anderen Pflanzenviren, die alleine nur milde oder keine Erkrankungen hervorrufen, kann jedoch ein Absterben der gesamten Pflanze verursachen. Diese Koinfektion führt zu erheblichen Ernteschäden beim Lilienanbau und ist daher von großer wirtschaftlicher Bedeutung. Das Lily-Mottle-Virus wird durch Blattläuse und bei der vegetativen Vermehrung durch Spaltung der Lilienzwiebel im Gartenbau verbreitet. Das LMoV galt als synonyme Bezeichnung eines bei Lilien auftretenden Subtyps des Tulip-breaking-Virus (TBV), das jedoch seit 2005 als nahe verwandte, aber eigenständige Virusart der Gattung Potyvirus eingestuft wird.
| Lily-Mottle-Virus<--de--> | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Lily Mottle Virus | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| LMoV | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Entdeckung
Die Symptome der von LMoV verursachten Pflanzenkrankheit waren bereits im 19. Jahrhundert bekannt. Erst 1944 gelang es P. Brierley und F. F. Smith, durch Infektionsexperimente an mehreren Tulpen- und Lilienarten eine Koinfektion mit zwei Viren als Ursache nachzuweisen.[2] Bei mehreren in den USA angebauten Lilienarten (Lilium auratum, L. speciosum, L. longiflorum), die streifige Aufhellungen (Chlorosen) oder einzelne nekrotische Flecken auf den Blättern aufwiesen, konnten sie das Lily-symptomless-Virus (LSV, Ordnung Tymovirales: Betaflexiviridae: Carlavirus) nachweisen, das stets mit dem Gurkenmosaikvirus oder dem Lily-Mottle-Virus gleichzeitig vorlag.[3] Sie konnten auch zeigen, dass alle drei Viren durch Blattläuse der Art Aphis gossypii übertragen werden.
Virusaufbau
Morphologie
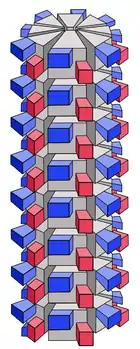
Virusteilchen (Virionen) des Lily-Mottle-Virus bestehen aus einem fadenförmigen Kapsid mit helikaler Symmetrie, in das eine einzelsträngige RNA als Genom verpackt ist; eine Virushülle ist nicht vorhanden.[4] Das Kapsid ist 13 nm dick und etwa 740 nm lang. Die Länge des Kapsids nimmt bei Anwesenheit zweiwertiger Kationen (besonders Calcium-Ionen) in der Präparation zu und nach deren Bindung durch Zugabe von EDTA ab. Die einzelnen Kapsomere, aus denen das Kapsid zusammengesetzt ist, benötigen für eine Helixwindung eine Ganghöhe von 3,4 nm. Diese Ganghöhe ist im Vergleich zu Viren mit starren Stäbchen und vergleichbarem Aufbau (z. B. dem Tabakmosaikvirus) relativ groß und ermöglicht die Flexibilität und Biegungsfähigkeit der LMoV-Kapside. Für eine Windung werden 7,7 Kapsomere benötigt, so dass das ganze Kapsid aus etwa 1700 Kapsomeren zusammengesetzt ist.[5] Die einzelnen Kapsomere bestehen aus nur einem Molekül des LMoV-Kapsidproteins (CP, coat/capsid protein) mit einer Länge von 274 Aminosäuren (33 kDa). Das CP ist mehrfach so gefaltet, dass N- und C-Terminus nach außen zeigen. Diese äußeren Enden des Kapsidproteins sind sehr variabel. Der vorragende N-Terminus bestimmt überwiegend die spezifische Anheftung an die Wirtszelle und ermöglicht die serologische Unterscheidung verschiedener Virusisolate. Die innerhalb der verschiedenen Mitglieder der Potyviridae sehr konservierten Abschnitte in der Mitte des CP (216 Aminosäuren) zeigen im Kapsid nach innen und wechselwirken mit der viralen RNA.[6]
Die Virionen sind gegenüber Ethanol stabil und verlieren im Pflanzensaft erst nach 10 Minuten bei 65–70 °C ihre Infektiosität.[2] Das LMoV hat eine Dichte von 1,31 g/ml in der Dichtegradientenzentrifugation (Cäsiumchlorid) und eine Sedimentationsgeschwindigkeit von 137 bis 160 S.[7]
Genom
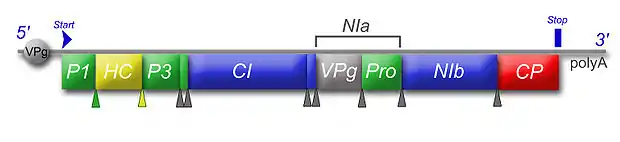
Als Genom besitzt das LMoV eine lineare, einzelsträngige RNA mit positiver Polarität [(+)ssRNA] und einer Länge von 9644 Nukleotiden. Ein virales Protein (VPg) ist kovalent an das 5'-Ende der RNA gebunden. Wie bei zellulären messenger-RNAs befindet sich am 3'-Ende des Virusgenoms ein Poly(A)-Schwanz von 20 bis 160 Adenosinen. Zwischen den beiden nicht codierenden Enden (NCR: non-coding region) liegt ein Offener Leserahmen (ORF), der für ein 3095 Aminosäuren großes Polyprotein codiert. Dieses Polyprotein wird durch Proteasen schon während der Translation in die einzelnen Virusproteine gespalten.
In der 5'-NCR von Potyviren wurde eine IRES-Struktur vermutet, da die Translation ohne eine 5'-Cap-Struktur eingeleitet wird.[8] Weder besitzt das LMoV eine Cap-Struktur, noch konnte aus Sequenzdaten eine IRES bestätigt werden. Das an die 5'-NCR gebundene VPg-Protein dient möglicherweise als Primer für die RNA-Polymerase zur Vervielfältigung der RNA. Das VPg anderer Potyviren interagiert aber zusätzlich direkt mit den Translations-Initiationsfaktoren eIF4E und eIFiso4E.[9] Dies könnte einen bisher nicht näher charakterisierten, Cap- und IRES-unabhängigen Translationsweg darstellen.[10]
Virusproteine und Replikation
Das Virus gelangt nach der Infektion über die Leitbündel in die Pflanze und wird von den Zellen durch Membranbläschen (Endozytose) aufgenommen. Im Zytoplasma zerfällt das Kapsid und die RNA wird freigesetzt. Die virale RNA kann zusätzlich sehr effektiv über infizierte Nachbarzellen durch Zellkontaktstellen (Plasmodesmen) in die Zelle gelangen. Dieser direkte Transport nackter, infektiöser RNA wird durch mehrere Virusproteine gesteuert, unter anderem dem sogenannten HC (helper component), die einen sogenannten Movement Complex bilden. Wie bei allen (+)ssRNA-Viren wird die aufgenommene RNA zuerst an den Ribosomen in Protein translatiert, da für die Vermehrung der RNA mindestens eine Kopie der viralen RNA-abhängigen RNA-Polymerase benötigt wird. Nachdem diese mehrere Kopien der viralen RNA synthetisiert hat, werden die LMoV-Proteine in großen Mengen produziert. Diese ballen sich an den Syntheseorten des Viroplasmas zu morphologisch sichtbaren Einschlusskörperchen (inclusion bodies) zusammen. Diese Einschlusskörperchen haben bei der Infektion mit LMoV im Zytoplasma eine charakteristische, zylindrische bis spiralartige Form; jenes Virusprotein, das überwiegend diese Zylinder bildet, wird daher auch als CI (cylindrical inclusion) bezeichnet. Im Zellkern bilden sich amorphe Einschlusskörper, die aus zwei Virusproteinen NIa und NIb (nuclear inclusions) bestehen. Da bei der Translation der RNA die Virusproteine immer im gleichen Verhältnis gebildet und größere Mengen des Kapsidproteins im Vergleich zu anderen Proteinen benötigt werden, bilden diese nicht in vielen Kopien benötigten Proteine Einschlusskörperchen, werden abgebaut oder aus der Zelle ausgeschieden.
Das Polyprotein des LMoV wird durch virale Proteasen in acht einzelne Proteine gespalten. Am N-Terminus spaltet sich die virale Protease 1 (P1) selbst vom Polyprotein ab. Als nächstes folgt das HC-Protein, das für die Übertragung durch Blattläuse von Bedeutung ist; der Mechanismus ist jedoch ungeklärt. Das HC besitzt am C-Terminus eine Papain-ähnliche Proteindomäne, mit der sich das HC ebenfalls selbstständig vom Polyprotein abspaltet. Alle weiteren Proteine werden durch die NIa-Protease abgespalten. Es folgt eine weitere Protease (P3) mit noch ungeklärter Funktion und das CI, von dem (möglicherweise zur Aktivierung) ein kleines Peptid 6K1 abgespalten wird. Das CI ist bei der RNA-Replikation als Helikase aktiv. Das VPg bildet zusammen mit einer Protease-Komponente das NIa. Das NIb ist die virale RNA-Polymerase, von der das virale Kapsidprotein CP abgespalten wird. Sind genügend virale (+)ssRNA und CP gebildet worden, kann die Verpackung in das Kapsid erfolgen und reife Viren in den Pflanzensaft durch Exozytose abgegeben werden. Die viel effektivere Infektion der nackten RNA von Zelle zu Zelle erklärt das Auftreten von sich fleckförmig ausbreitenden Läsionen der Blätter.
Systematik
Die Gattung Potyvirus ist mit derzeit 168 Virusspezies die größte Gruppe aller Pflanzenviren.[11] Diese Vielzahl an Potyviren erschwert die Unterscheidung und Abgrenzung einzelner Arten oder Subtypen, dies gilt besonders für das Lily-Mottle-Virus und das Tulip-breaking-Virus (TBV), die lange Zeit als Synonyme einer einzigen Art betrachtet wurden. Das LMoV galt als der bei Lilien verbreitete Subtyp des TBV (TBV-Subtyp Lily). Erschwert wurde diese Unterscheidung noch dadurch, dass die echte Spezies TBV ebenfalls bei Lilien Erkrankungen hervorrufen kann. Mit immer mehr Vergleichssequenzen des Genoms verschiedener Virusisolate konnten bislang falsche Zuordnungen nachgewiesen werden.[12] Bei einer Untersuchung an 187 vollständigen Genomsequenzen und 1220 Teilsequenzen für das Kapsidprotein von Potyviren wurden mehrere Untergruppen innerhalb der Gattung festgestellt und die Kriterien für die Speziesgrenzen auch für das LMoV und TBV neu festgelegt.[13] Demnach gilt eine Übereinstimmung in der Nukleotidsequenz zwischen zwei vollständigen Genomen von mehr als 76 % als Speziesgrenze (entspricht 82 % Übereinstimmung in der Aminosäuresequenz). Der das Kapsidprotein CP codierende Teil der Nukleotidsequenz zeigte eine Speziesgrenze bei 76–77 %. Am besten erschien die Sequenz des CI-Proteins zur Unterscheidung geeignet. Mehrere Sequenzen von Potyviren (einschließlich TBV und LMoV), die in der internationalen Genbank GenBank veröffentlicht waren, mussten daraufhin anderen Spezies zugeordnet werden.
Die vom „International Committee on Taxonomy of Viruses“ festgelegte Taxonomie und seit 2005 gültige Zuordnung der Subtypen des LMoV bezieht bisher als TBV klassifizierte Subtypen mit ein:[14]
- Familie Potyviridae
- Gattung Potyvirus
- Spezies Lily-Mottle-Virus (en. Lily mottle virus, LMoV)
- Subtyp Lily-Mild-Mottle-Virus
- Subtyp Lily-Mottle-Virus
- Subtyp Tulip-band-breaking-Virus
- Spezies Tulip-breaking-Virus (en. Tulip breaking potyvirus, offiziell Tulip breaking virus, TBV)
Infektion und Erkrankung durch LMoV
Etwa zwei Wochen nach der Infektion mit LMoV zeigt sich eine hellgrüne Scheckung (engl. mottle) an jungen Blättern. Die Aufhellung kann auch streifig entlang der Blattnervatur auftreten. Im Verlauf weniger Tage wird das Blatt an den hellen Flecken dünner und die Pflanzenzellen können bei einer schweren Verlaufsform in diesen Bereichen absterben; die unregelmäßig begrenzten Flecken erscheinen nun dunkelbraun und ausgetrocknet. Alle neuen Triebe und Blüten, die nach einer Infektion austreiben, sind verkleinert und oft deformiert.
Diese Ausprägung der Erkrankungssymptome ist bei verschiedenen Lilienarten und -hybriden jedoch sehr unterschiedlich. Selbst die Erkrankung identischer Spezies in einem einzelnen Anbaugebiet verläuft unterschiedlich schwer. Dieses Phänomen kann durch den Einfluss der Wachstumsphase zum Infektionszeitpunkt, der Eintrittstelle und der Infektionsdosis des Virus erklärt werden. Bei der Oster-Lilie (L. longiflorum) entwickelt sich regelmäßig keine Erkrankung, obwohl sich das Virus in der Pflanze vermehrt. Bei der Tiger-Lilie (L. lancifolium) tritt nur eine sehr leichte hellgrüne Scheckung auf. Auch können bei einigen LMoV-Infektionen nur ein geringeres Längenwachstum und verkleinerte Blüten und Zwiebeln festgestellt werden. Die wirtschaftlich wichtige Art L. formosanum erkrankt immer nach einer LMoV-Infektion, dies gilt auch für die auf Taiwan vorkommenden Wildsorten. Eine erhöhte Virusresistenz besitzt nur die besonders ausgelesene Sorte Lilium formosanum „Little Snow White“. Sehr empfänglich für das LMoV und weiterer bei Lilien vorkommenden Pflanzenviren ist die 1941 von Jan de Graaff gezüchtete Hybride „Enchantment“ und aller von ihr abgeleiteten Züchtungen wie beispielsweise das in Asien weit verbreitete Kultivar Lilium Asia. Hybrid cv. Enchantment.[12]
Die alleinige Infektion mit dem LMoV führt nie zum Absterben der gesamten Pflanze, sondern bleibt lokal auf einige Pflanzenteile begrenzt. Besonders häufig ist jedoch eine Koinfektion des LMoV mit dem Lily-symptomless-Virus, das alleine keine Erkrankungssymptome, sondern nur einen verminderten Pflanzenwuchs hervorruft. Wird eine Pflanze von beiden Viren infiziert, so verläuft die Erkrankung erheblich schwerer und schneller. Nach den anfänglichen typischen Symptomen einer ausgeprägten LMoV-Infektion kommt es zum Befall größerer Leitbündel wie dem gesamten Phloem, was schließlich die gesamte Pflanze absterben lässt. Eine doppeltinfizierte Lilienzwiebel kann bereits in der Lagerhaltung schwer geschädigt werden, die Austriebsfähigkeit verlieren und absterben.
Übertragung und Verbreitung
Übertragung

Das Lily-Mottle-Virus wird während des Saugaktes von Röhrenblattläusen (Aphididae) übertragen. Die Blattläuse nehmen das in hoher Konzentration im Pflanzensaft vorkommende Virus während des Saugaktes auf und können mit einer Verzögerung von wenigen Stunden weitere Pflanzen infizieren. Das Virus kann sich in der Blattlaus selbst nicht vermehren. Nach Aufnahme des Pflanzensaftes in den Mitteldarm der Blattlaus wird das Virus im Blutkreislauf verteilt und gelangt in den Speichel des Saugapparates; beim nächsten Saugakt kann nun eine neue Pflanze infiziert werden. Jene Blattlausarten, die überwiegend das LMoV übertragen, sind Aphis gossypii, Myzus persicae, Macrosiphum euphorbiae und Doralis fabae. Gelagerte Zwiebeln können auch durch Anuraphis (Yezabura) tulipae mit dem Virus infiziert werden.[16] Geflügelte Exemplare der Blattlauspopulation ermöglichen eine Übertragung über große Distanzen.
Beim Anbau der Pflanzen wird das Virus beim Schneiden und Verletzen der Pflanzen mit kontaminierten Messern und Scheren übertragen. Experimentell wird dieser Infektionsweg durch gezieltes Anritzen der Pflanzen genutzt. Die Spaltung der Lilien-Zwiebeln bei einer vegetativen Vermehrung verbreitet das Virus auf alle Tochterpflanzen. Gleiches gilt bei einer vegetativen Vermehrung durch Stecklinge in Gewebekulturen, die im industriellen Gartenbau sehr verbreitet ist. Das Virus wird nicht durch Samen verbreitet; keimt eine neue Pflanze aus dem Samen einer LMoV-infizierten Pflanze, so ist diese nicht infiziert.
Verbreitung

Die natürliche geographische Verbreitung des Virus ist nicht bekannt, da bei seiner Entdeckung in den USA 1944 bereits eine anthropogene Verbreitung durch weltweiten Blumen- und Zwiebelhandel vorlag. Durch die Aufzucht von Lilien in großen Gewächshäusern und Feldern als Monokultur wird die Übertragung gegenüber dem natürlichen Vorkommen der Wildpflanzen besonders begünstigt. Das Virus ist weltweit verbreitet und in Ländern mit bedeutendem Lilienanbau endemisch. Dies betrifft neben den Vereinigten Staaten auch die Niederlande, Polen, Nord- und Südkorea, Japan, Taiwan, China und Israel. Das Lily-Mild-Mottle-Virus als Subtyp des LMoV, wurde bei einer Untersuchung von 185 Lilienproben aus südkoreanischen Kulturen in 26,3 % aller Pflanzen nachgewiesen, eine Koinfektion von LMoV und dem Tomato-Ringspot-Virus wurde in weiteren 23,2 % beobachtet.[17]
In den Niederlanden konnte mehrfach in allen Pflanzen einzelner Lilienfelder des Kultivars „Enchantment“ das LMoV nachgewiesen werden.[18] Häufig bestand zusätzlich eine Infektion mit dem Lily-symptomless-Virus. In den so betroffenen Plantagen wird vermehrt eine Nekrose des Stammes und der Blätter beobachtet, der meist das Absterben der Pflanze folgt. Sind alle Lilien einer Plantage nur mit dem LMoV infiziert, hat dies meist nicht einen Ausfall der gesamten Blumenernte zur Folge; verkleinerte Blüten oder Pflanzen mit Minderwuchs werden dann zu geringeren Preisen angeboten.
Bei allen etwa 340 in größerem Umfang angebauten Lilien-Kultivaren konnte das LMoV nachgewiesen werden.[19] Die unerkannte Verbreitung durch weltweiten Transport ist besonders durch jene Lilienarten gegeben, die keine oder nur geringe Infektionssymptome aufweisen, aber das Virus vermehren können wie beispielsweise die Oster-Lilie und Tiger-Lilie. Das Virus besitzt ein größeres Wirtsspektrum als durch frühere Untersuchungen angenommen wurde. So konnte in der Winterendivie (C. endivia L. var. latifolium Lam.) ebenfalls das LMoV nachgewiesen werden.[20]
Infektionsverhütung
Die Verbreitung des LMoV wird in der industriellen Produktion vorwiegend durch eine Bekämpfung der Blattläuse als Überträger verhindert.[19] Überwiegend im Juni und Juli, weniger im Mai und August wird das Virus durch die sich ausbreitende Blattlaus-Populationen übertragen. Eine wöchentliche Bekämpfung der Insekten ab Mai und zweiwöchentlich im August und September wird im industriellen Maßstab durchgeführt. Die Lilien werden am häufigsten mit Paraffinöl oder Pyrethroiden als Aerosole behandelt.
Für die Infektionsverhütung ist die Vermeidung einer Weiterverbreitung durch Saatzwiebeln und weltweiten Pflanzenhandel bedeutsam. Jene Lilienarten, bei denen keine oder nur milde Symptome auftreten, sind in besonderer Weise eine Quelle für Infektionsausbrüche, da die Infektion hier unerkannt bleibt. Oft wird aus diesem Grund eine gleichzeitige Anzucht resistenter und empfänglicher Liliensorten vermieden, da sich das Virus in den resistenten Sorten unbemerkt ausbreiten kann ohne Krankheitssymptome zu entwickeln. Diese bilden ein ständiges Reservoir für die Infektion der empfänglichen Sorten. Bei einer Monokultur empfänglicher Sorten können befallene Pflanzen aussortiert und damit die Ausbreitung des Virus in einem gewissen Maß kontrolliert werden. Da das Virus nicht wie andere Mitglieder der Gattung Potyvirus durch Samen übertragen wird, kann eine Kultur durch aufwändigere, erneute Aufzucht aus Samen von einer Infektion mit dem LMoV befreit werden.
Der Transport und Handel mit Pflanzenteilen wie Blüten, Stecklinge oder Zwiebeln aus Anbaugebieten, in denen das LMoV nachgewiesen wurde, unterliegt in vielen Ländern einer gesetzlichen Beschränkung oder einem Einfuhrverbot. Insbesondere die zur Vermehrung und Aufzucht gehandelten Pflanzenteile müssen seit 1998 in Deutschland gemäß einer Umsetzung mehrerer EU-Richtlinien auf LMoV getestet sein.[21] Zum Nachweis des LMoV finden immunologische Tests auf LMoV-Virusproteine (ELISA) und selten der Nachweis des Virusgenoms durch PCR Anwendung. Sowohl die Blätter („leaf test“) als auch die geernteten Zwiebeln („bulb test“) werden als Testprobe zur Diagnostik verwendet. Neuere Verfahren zum gleichzeitigen Nachweis mehrerer Pflanzenviren aus einer Probe durch DNA-Hybridisierung (Makroarray) werden derzeit erprobt.[22]
Quellen
Literatur
- Gerhart Drews, Günter Adam, Cornelia Heinze: Molekulare Pflanzenvirologie. Berlin 2004; ISBN 3-540-00661-3
- Sondra D. Lazarowitz: Plant Viruses. In: David M. Knipe, Peter M. Howley (Red.): Fields’ Virology. 5. Auflage. 2 Bände, Philadelphia 2007, S. 641–705; ISBN 0-7817-6060-7
- Kenneth M. Smith: A Textbook of Plant Virus Diseases. 3. Auflage. Edinburgh 1972
- P. H. Berger et al.: Family Potyviridae. In: C. M. Fauquet, M. A. Mayo et al.: Eighth Report of the International Committee on Taxonomy of Viruses. London, San Diego 2005, S. 819–841; ISBN 0-12-249951-4
- Juan José López-Moya, Juan Antonio García: Potyviruses. In: Allan Granoff, Robert G. Webster (Hrsg.): Encyclopedia of Virology. Band 3, Academic Press, San Diego 1999, S. 1369–1375; ISBN 0-12-227030-4
Einzelnachweise
- ICTV: ICTV Taxonomy history: Lily mottle virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- P. Brierley und F. F. Smith: Studies on lily virus diseases: the necrotic fleck complex of Lilium longiflorum. Phytopathology (1944) 34, S. 529–555.
- Kenneth M. Smith: Virus diseases of farm & garden, 1946, S. 82–83
- E. L. Dekker EL et al.: Characterization of potyviruses from tulip and lily which cause flower-breaking. Journal of General Virology (1993) 74(5), S. 881–887; PMID 8492092.
- Drews (2004) S. 149.
- D. D. Shukla und C. W. Ward: Structure of potyvirus coat proteins and its application in the taxonomy of the potyvirus group. Adv. Virus Research (1989) 36, S. 273–314 (Review); PMID 2472047.
- Berger (2005) S. 819.
- D. R. Gallie: Cap-independent translation conferred by the 5' leader of tobacco etch virus is eukaryotic initiation factor 4G dependent. Journal of Virology (2001) 75(24), S. 12141–12152; PMID 11711605.
- S. Wittmann et al.: Interaction of the viral protein genome linked of turnip mosaic potyvirus with the translational eukaryotic initiation factor (iso) 4E of Arabidopsis thaliana using the yeast two-hybrid system. Virology (1997) 234, S. 84–92; PMID 9234949.
- S. Léonard et al.: Complex formation between potyvirus VPg and translation eukaryotic initiation factor 4E correlates with virus infectivity. Journal of Virology (2000) 74(17), S. 7730–7737; PMID 10933678.
- ICTV: Master Species List 2018a v1 MSL including all taxa updates since the 2017 release. Fall 2018 (MSL #33)
- Y. Yamaji, L. Xiaoyun et al.: Molecular evidence that a lily-infecting strain of Tulip breaking virus from Japan is a strain of lily mottle virus. European Journal of Plant Pathology (2001) 107, 8, S. 833–837 (Abstract)
- M. J. Adams, J. F.Antoniw und C. W. Fauquet: Molecular criteria for genus and species discrimination within the family Potyviridae. Archives of Virology (2005) 150(3), S. 459–479; PMID 15592889.
- P. H. Berger (2005) S. 824 und 827.
- Brunt, A.A., Crabtree, K., Dallwitz, M.J., Gibbs, A.J., Watson, L. and Zurcher, E.J. (Hrsg.): Tulip breaking potyvirus, auf: Plant Viruses Online: Descriptions and Lists from the VIDE Database (1996 onwards). Version: 16th January 1997
- Smith (1972), S. 552.
- K. Lee et al.: Virus disease of Lilies in Korea. Acta Horticulturae (ISHS), International Symposium on the Genus Lilium (1996) 414, S. 195–202.
- Allan Granoff, Robert G. Webster (eds.): Encyclopedia of Virology, San Diego (Academic Press) 1999, Band 2, S. 1321; ISBN 0-12-227030-4.
- C. J. Asjes: Control of aphid-borne Lily symptomless virus and Lily mottle virus in Lilium in the Netherlands. Virus Research (2000) 71(1–2), S. 23–32; PMID 11137159 (Review).
- V. Lisa, H. J. Vetten, D.-E. Lesemann, P. Gotta: Occurrence of Lily mottle virus in escarole. Plant Disease (2002) 86, S. 329.
- Verordnung über das Inverkehrbringen von Anbaumaterial von Gemüse-, Obst- und Zierpflanzenarten sowie zur Aufhebung der Verordnung zur Bekämpfung von Viruskrankheiten im Obstbau (16. Juni 1998), (BGBl. I S. 1322)
- S. Sugiyama et al.: A simple, sensitive, specific detection of mixed infection of multiple plant viruses using macroarray and microtube hybridization. J. Virol. Methods. (2008) Sep 12. (Epub) PMID 18760308
Weblinks
- Virionen des TBV mit gleicher Morphologie wie das LMoV (TEM-Aufnahme)
- Einschlusskörperchen im Zytoplasma (TEM)
- Lily mottle virus in der Datenbank des ICTV
- Lily mottle virus in der Taxonomie-Datenbank des NCBI
- Genom- und Polyproteinsequenz des LMoV (NC 005288)