Chlorovirus
Chlorovirus, auch Chlorellavirus genannt, ist eine Gattung von Viren mit doppelsträngigem DNA-Genom in der Familie der Phycodnaviridae. Sie gehört damit zum Phylum Nucleocytoviricota (alias Nucleocytoplasmic large DNA viruses, NCLDV).[4][5]
| Chlorovirus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
_PBCV-1.png.webp)
Paramecium bursaria chlorella virus-1 | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Chlorovirus | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Diese Gattung ist weltweit in Süßwasserumgebungen anzutreffen, wo mikroskopische Algen als natürliche Wirte dienen. Es gibt derzeit 19 Spezies in dieser Gattung, einschließlich der Typusspezies Paramecium bursaria Chlorella virus 1.[6][7][8] Der Wortbestandteil Chloro- ist abgeleitet von altgriechisch χλωρός chlōrós, deutsch ‚gelblich‘, ‚grün‘.
Das Chlorovirus wurde 1981 von Russel H. Meintz, James L. Van Etten, Daniel Kuczmarski, Kit Lee und Barbara Ang entdeckt, als sie versuchten, Chlorella-ähnliche Algen zu kultivieren. Während des Verfahrens wurden Viruspartikel (Virionen) in den Zellen 2 bis 6 Stunden nach der anfänglichen Isolierung entdeckt, gefolgt von der Lyse (Tod durch Auflösung der Wirtszelle) nach 12 bis 20 Stunden. Dieses Virus wird als HVCV-1 (Hydra viridis Chlorella virus 1) bezeichnet, da in dem Süßwasserpolyp Hydra viridis lebende einzellige Grünalgen (Zoochlorellen) infiziert wurden.[9][10] Vor einiger Zeit wurde festgestellt, dass eine Spezies, das in Seen häufig vorkommende Spezies ATCV-1 (Acanthocystis turfacea chlorella virus 1), auch Menschen infiziert. Genauere Untersuchungen sind aber noch nötig.[11] Es folgten neuere Studien über die Auswirkungen von Infektionen im Mausmodell.[11][12]
Systematik
Innere Systematik
Das International Committee on Taxonomy of Viruses (ICTV) hat mit Stand April 2020 (Master Species List #35) folgende Spezies anerkannt:
- Gattung: Chlorovirus
- Spezies Acanthocystis turfacea chlorella virus 1 (ATCV-1, assoziiert mit Acanthocystis turfacea)[13] mit Stamm ATCV1[14][15][16]
- Spezies Hydra viridis Chlorella virus 1 (HVCV-1, Hauptwirt Hydra viridissima)
- Spezies Paramecium bursaria Chlorella virus 1 (PBCV-1, Typusspezies, Hauptwirt Paramecium bursaria)[15][16][13] mit Stamm PBCV1 und Mutante CME6
- Spezies Paramecium bursaria Chlorella virus A1 (PBCV-A1)[15] mit Stämmen CVA-1, FR483,[17][16] MT325[13]
- Spezies Paramecium bursaria Chlorella virus AL1A (PBCV-AL1A)
- Spezies Paramecium bursaria Chlorella virus AL2A (PBCV-AL2A)
- Spezies Paramecium bursaria Chlorella virus BJ2C (PBCV-BJ2C)
- Spezies Paramecium bursaria Chlorella virus CA4A (PBCV-CA4A)
- Spezies Paramecium bursaria Chlorella virus CA4B (PBCV-CA4B)
- Spezies Paramecium bursaria Chlorella virus IL3A (PBCV-IL3A) mit Stamm IL-3A
- Spezies Paramecium bursaria Chlorella virus NC1A (PBCV-NC1A)
- Spezies Paramecium bursaria Chlorella virus NE8A (PBCV-NE8A)
- Spezies Paramecium bursaria Chlorella virus NY2A (PBCV-NY2A)[15][16]
- Spezies Paramecium bursaria Chlorella virus NYs1 (PBCV-NYs1)[15]
- Spezies Paramecium bursaria Chlorella virus SC1A (PBCV-SC1A)
- Spezies Paramecium bursaria Chlorella virus XY6E (PBCV-XY6E)
- Spezies Paramecium bursaria Chlorella virus XZ3A (PBCV-XZ3A)
- Spezies Paramecium bursaria Chlorella virus XZ4A (PBCV-XZ4A)
- Spezies Paramecium bursaria Chlorella virus XZ4C (PBCV-XZ4C)
Weitere vorgeschlagene Spezies sind:
- Spezies „Acanthocystis turfacea Chlorella virus Br0604L“[18][1]
- Spezies „Acanthocystis turfacea Chlorella virus Can0610SP“[19][1]
- Spezies „Acanthocystis turfacea Chlorella virus Canal-1“[20][1]
- Spezies „Acanthocystis turfacea Chlorella virus GM0701.1“[21][1]
- Spezies „Acanthocystis turfacea Chlorella virus MO0605SPH “[22][1]
- Spezies „Acanthocystis turfacea Chlorella virus MN0810.1“[23][1]
- Spezies „Acanthocystis turfacea Chlorella virus NTS-1“[24][1]
- Spezies „Acanthocystis turfacea Chlorella virus NE-JV-2“[25][1]
- Spezies „Acanthocystis turfacea Chlorella virus NE-JV-3“[26][27]
- Spezies „Acanthocystis turfacea Chlorella virus OR0704.3“[28][1]
- Spezies „Acanthocystis turfacea Chlorella virus TN603“ (ATCV-TN603)[29][16]
- Spezies „Acanthocystis turfacea Chlorella virus TN603.4.2“[30][1]
- Spezies „Acanthocystis turfacea Chlorella virus WI0606“[31][1]
- Spezies „Paramecium bursaria Chlorella virus AN69C“ (alias „Chlorella virus AN69C“)[32][1]
- Spezies „Paramecium bursaria Chlorella virus AR158“ (PBCV-AR158)[33][16][1]
- Spezies „Paramecium bursaria Chlorella virus CZ-2“[34][27]
- Spezies „Paramecium bursaria Chlorella virus AP110A“[35][1]
- Spezies „Paramecium bursaria Chlorella virus Can18-4“[36][1]
- Spezies „Paramecium bursaria Chlorella virus CVB-1“[37][1]
- Spezies „Paramecium bursaria Chlorella virus CVG-1“[38][1]
- Spezies „Paramecium bursaria Chlorella virus CviKI“[39][1]
- Spezies „Paramecium bursaria Chlorella virus CVK2“ (PBCV-CVK2)[40][16]
- Spezies „Paramecium bursaria Chlorella virus CVM-1“[41][1]
- Spezies „Paramecium bursaria Chlorella virus CVR-1“[42][1]
- Spezies „Paramecium bursaria Chlorella virus CvsA1“[43][1]
- Spezies „Paramecium bursaria Chlorella virus CZ-2“[44][1]
- Spezies „Paramecium bursaria Chlorella virus Fr5L“[45][1]
- Spezies „Paramecium bursaria Chlorella virus IL-5-2s1“[46][1]
- Spezies „Paramecium bursaria Chlorella virus KS1B“[47][1]
- Spezies „Paramecium bursaria Chlorella virus MA-1D“[48][1]
- Spezies „Paramecium bursaria Chlorella virus MA-1E“[49][1]
- Spezies „Paramecium bursaria Chlorella virus MT325“ (PBCV-MT325)[40][16]
- Spezies „Paramecium bursaria Chlorella virus NE-JV-1“[50][1]
- Spezies „Paramecium bursaria Chlorella virus NE-JV-4“ mit Stamm NE-JV4[51][1]
- Spezies „Paramecium bursaria Chlorella virus NW665.2“[52][1]
- Spezies „Paramecium bursaria Chlorella virus NY-2B“[53][1]
- Spezies „Paramecium bursaria Chlorella virus NYs1“[54] mit Stamm NYs-1[1]
- Spezies „Paramecium bursaria Chlorella virus OR0704.2.2“[55][1]
- Spezies „Chlorella variabilis Virus NC64A“ (s. u.)
- Spezies „Chlorella variabilis Virus Syngen“ (s. u., Hauptwirt in der Gattung Chlorella)
- Spezies „Chlorella heliozoae Virus SAG“ (s. u.)
- Spezies „Only Syngen Nebraska virus 5“ (OSy-NE5)[56][1][13]
Phylogenetischer Baum nach Hao Chen et al. (2018):[15]
| Chlorovirus |
| ||||||||||||||||||||||||
Phylogenetischer Baum (Maximum-Likelihood) der Chloroviren (A) und ihrer Algenwirte (B) nach Van Etten at al. (2019) – als Outgroups dienten vier Ostreococcus-Virus-Sequenzen (Gattung Prasinovirus) in (A), Parachlorella-Arten in (B).
.png.webp)
Das Kladogramm der Chloroviren (A) zeigt, dass die Gattung sich in die folgenden Kladen aufteilen lässt:
- NC64A-Viren (mit PBCV-1)
- OSy-Viren (nur OSy-NE5)
- SAG-Viren (mit ATCV-1)
- PBi-Viren (mit PBCV-A1)
Äußere Systematik
Die folgende Systematik folgt F. Schulz et al. (2018) mit Korrekturen und Ergänzungen nach Hao Chen et al. (2018)[57][15] und Shengzhong Xu et al. (2020):[27]
| Phycodnaviridae |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
YSLPV = „Yellowstone Lake Phycodnavirus“
DSLPV = „Dishui Lake Phycodnavirus“
Greiner et al. (2018) sehen YLPV2 (alias YSLPV2, Yellowstone Phycodnavirus 2) jedoch nicht in der Klade der Viren vom Chlorovirus-Typ.[13]
Ökologie
Chloroviren sind in Süßwasserumgebungen in allen Teilen der Welt weit verbreitet und wurden aus Süßwasserquellen in Europa, Asien, Australien sowie Nord- und Südamerika isoliert.[60][61]
Wirte
Zu den natürlichen Wirten der Chloroviren zählen verschiedene Arten einzelliger Chlorella-ähnlicher Algen, die Zoochlorellen genannt werden. Sie sind sehr spezies- und sogar stammspezifisch: Einzelne Virusspezie infizieren typischerweise nur Wirte einer bestimmten Linie (engl. strain). Diese Zoochlorellen bauen im Allgemeinen endosymbiotische Beziehungen auf zu größeren Protozoen (Protisten) und Wirbellosen (Invertebrata) des Süß- oder Salzwassers, beispielsweise:
- dem Grünen Pantoffeltierchen (Paramecium bursaria, ein Wimpertierchen – Ciliophora),
- der Grünen Hydra (Hydra viridissima alias H. viridis, Hydrozoa),[62]
- Acanthocystis turfacea (Hacrobia: Centroheliozoa, veraltet ‚Sonnentierchen‘, siehe auch Acanthocystis turfacea auf Microworld).[63]
Während ein einzelner Protist zu einem bestimmten Zeitpunkt bis zu mehrere hundert Algenzellen beherbergen kann, sind frei schwebende Algen sehr anfällig für Chloroviren, was darauf hindeutet, dass eine solche Endosymbiose eine Infektionsresistenz verleiht.[64]
Kürzlich wurde auch festgestellt, dass Chloroviren Menschen infizieren. Die Möglichkeit einer Infektionen von Mäusen wird untersucht (s. u.).[11]
Vorkommen
Die Chlorovirus-Titer variieren je nach Jahreszeit und Ort. Aufgrund der reichen genetischen Vielfalt und der hohen Spezialisierung einzelner Virusspezies sind Abweichungen in ihrer Ökologie nicht ungewöhnlich. Dies führt zu spezifischen räumlich-zeitlichen Mustern, die letztendlich vom Lebensstil und der Art des Wirts abhängen. Bisherige Übersichtsdaten zeigten zwei hervorstechende saisonale Häufigkeitsspitzen: für Chlorella variabilis NC64A-Viren im Spätherbst und für Chlorella variabilis Syngen-Viren im späten Frühling bis Mitte des Sommers, was wahrscheinlich auf die Tatsache zurückzuführen ist, dass den Wirt gemeinsam haben. Umgekehrt erreichten Chlorella heliozoae SAG-Viren zu verschiedenen Jahreszeiten ihren Höhepunkt und zeigten im Vergleich zu den NC64A- und Syngen-Viren im Allgemeinen eine größere Variabilität der Titer.[60]
Darüber hinaus zeigten Studien, dass Chloroviren eine gewisse Widerstandsfähigkeit gegen den winterlichen Temperaturabfall aufweisen, was durch das Vorhandensein von infektiösen Partikeln (Virionen) unter Eisschichten in einem Regenwassermanagement-Teich in Ontario, Kanada, belegt ist.[65] DeLong et al. vermuten 2016, dass Verfolgung durch kleine Krebstiere (Crustaceen) eine indirekte Rolle bei der Titerfluktuation spielen können. Der Abbau von Protistenzellen, die den Verdauungstrakt der Krebstiere passieren, könnte zu einer Freisetzung einer großen Anzahl der einzelligen Algen führt, die – aufgrund des weggefallenen Endsymbiose-Wirts – anfällig für eine Virusinfektion werden.[64] In Konsequenz hängt die saisonale Häufigkeit von Chloroviren nicht nur von der eigenen Wirtsart ab, sondern auch von vielen anderen Mikroorganismen, dem allgemeinen Nährstoffstatus und ökologischen Rahmenbedingungen.[66]
In ihrer Gesamtheit können Chloroviren über den Phytoplanktonumsatz globale biogeochemische Zyklen beeinflussen. Bekannterweise verursacht Chlorella zusammen mit anderen Arten mikroskopischer Algen und Blaugrünbakterien (Cyanobakterien) wie Microcystis aeruginosa toxische Algenblüten, die in der nördlichen Hemisphäre (Erdhälfte) üblicherweise von Februar bis Juni dauern. Dies führt zu Sauerstoffmangel und in der Folge zum Tod größerer Organismen in den Süßwasserlebensräumen.[67][68]
Lytische (d. h. zellzerstörende) Infektion einzelliger Algen durch Chloroviren führt zum Abbruch der Algenblüten und anschließender Freisetzung des in den Algenzellen enthaltenen von Kohlenstoffs, Stickstoffs und Phosphors, die verdünnt letztendlich der Nahrungskette wieder zugeführt werden.[66]
Aufbau
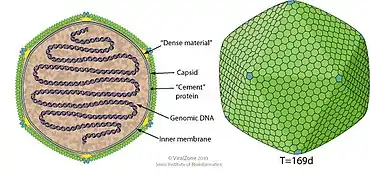
.
Die Virionen der Gattung Chlorovirus haben eine Hülle mit ikosaedrischer oder sphärischer Geometrie und eine Symmetrie (Triangulationszahl) T=169. Der Durchmesser beträgt ca. 100–220 nmDas Genom ist linear, in der Regel einfach vorhanden und besteht aus doppelsträngiger DNA (dsDNA), mit einer Länge von etwa 330 kb. Die dsDNA ist geschlossen mit einer Hairpin (Haarnadelstruktur) am Ende. Es gibt oft mehrere hundert ORFs (offene Leserahmen, englisch 'open reading frames').[6]
Die Gattung der Chloroviren kodiert in ihrer Gesamtheit für in Summe 632 Proteinfamilien, jedes einzelne Virus hat jedoch nur 330–416 Gene, die Proteine kodieren. Chloroviren in bestimmten Abschnitten ihrer DNA-Sequenz methylierte Basen. Einige Chloroviren enthalten auch Introns und Inteine, obwohl dies innerhalb der Gattung selten ist.[62]
- Die Typenspezies Paramecium bursaria Chlorella virus 1 (PBCV-1) hat einen Durchmesser von 190 nm und eine Fünffach-Achse.[62][69] Die Verbindungsstelle seines Kopfes weist einen hervorstehenden Dorn (Spike) auf. Dies ist der erste Teil des Virions, das seinen Wirt kontaktiert.[63] Die Kryo-EM-Aufnahmen von PBCV-1 zeigen die lange schmale zylindrische Spike-Struktur an einem Scheitelpunkt (Vertex) und eine innere Membran (grün), die das Virus-Genom asymmetrisch umgibt.[1] Das äußere Kapsid bedeckt eine einzelne Membran aus einer Lipid-Doppelschicht, die aus dem endoplasmatischen Retikulum des Wirts gewonnen wird.[69] Die Genomlänge beträgt 330.611 bp, dabei werden vorhergesagt 802 Proteine kodiert. Der GC-Gehalt liegt bei 40 %.[70] Einige Kapsomere auf der äußeren Hülle haben Fasern, die sich vom Virusteilchen abstehen und die Anheftung an den Wirts unterstützen (vgl. Mimivirus).[62][63][71]
- Die Spezies Acanthocystis turfacea Chlorella virus 1 (AtCV-1) hat eine Genomlänge von 288.047 bp, es werden vorhergesagt 860 Proteine kodiert und der GC-Gehaklt beträgt 49 %.[70]
Vermehrungszyklus
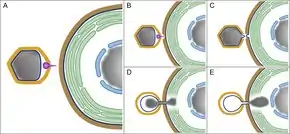
_assembly_schema.png.webp)
_PBCV-1.png.webp)
_(ABCDEGHJ)_frameless.png.webp)
Bei Paramecium bursaria chlorella virus 1 (PBCV-1), dem Prototyp des Chlorovirus, berührt zunächst der Dorn (Spike) die Zellwand des Wirts.[73] und wird dann durch Fasern unterstützt, um das Virusteilchen (Virion) am Wirt zu sichern. Die Anlagerung von PBCV-1 an seinen Rezeptor ist sehr spezifisch und schränkt den Bereich der möglichen Wirte stark ein. Virusassoziierte Enzyme ermöglichen den Abbau der Wirtszellwand und die interne Membran des Virus verschmilzt mit der Wirtsmembran. Diese Fusion ermöglicht den Transfer der Virus-DNA und von viralen Proteinen in die Wirtszelle und löst auch eine Depolarisation der Wirtsmembran aus.
Da PBCV-1 kein Gen für RNA-Polymerase besitzt, wandern seine DNA und viralen Proteine in den Zellkern, wo die Transkription 5–10 Minuten nach der Infektion beginnt. Es wird angenommen, dass diese schnelle Transkription durch ein Protein ermöglicht wird, das den Transfer der DNA in den Zellkern bewerkstelligt und durch das PBCV-a443r-Gen kodiert wird. Es ähnelt Proteinen, die am Durchschleußen durch die Kernmembran in Säugetierzellen beteiligt sind.
In dieser frühen Infektionsphase sinkt die (eigene) Transkriptionsrate des Wirts, und die Transkriptionskomponenten des Wirts werden zur Transkription der neuen viralen DNA umprogrammiert. Minuten nach der Infektion beginnt der Abbau der chromosomalen DNA des Wirts. Es wird vermutet, dass dies durch PBCV-1-kodierte und verpackte DNA-Restriktionsendonukleasen erfolgt. Durch den Abbau der chromosomalen Wirts-DNA kommt die Transkription des Wirts zum Erliegen. Dies führt dazu, dass 33–55 % der polya.[74]
Die virale DNA-Replikation beginnt nach 60 bis 90 Minuten. Etwa 2–3 Stunden nach der Infektion beginnt der Zusammenbau der Virushüllen (Kapside). Dies tritt in lokalisierten Regionen des Zytoplasmas auf, wobei die Viruskapside 3–4 Stunden nach der Erstinfektion beobachtbar sind. 5–6 Stunden nach der PBCV-1-Infektion füllt sich das Zytoplasma der Wirtszelle mit infektiösen Viruspartikeln (der Nachkommenschaft). Kurz danach (6–8 Stunden nach der Infektion) setzt die lokalisierte Lyse (Auflösung) der Wirtszelle diese Nachkommen frei. Aus jeder infizierten Zelle werden ca. 1000 Viruspartikel freigesetzt.[63]
Infektion beim Menschen
Kürzlich wurde Chlorovirus ATCV-1-DNA in menschlichen Pharynx-Proben gefunden. Bis dato war nicht bekannt, dass das Chlorovirus Menschen infizieren könnte, daher ist das Wissen über Infektionen bei Menschen noch sehr begrenzt. Infizierte Personen hatten ein verzögertes Gedächtnis und verringerte Aufmerksamkeit sowie eine verminderte visuelle Verarbeitung und visuelle Motorik. Dies führte insgesamt zu einem Rückgang der Fähigkeit, Aufgaben basierend auf Sehen und räumlichem Denken durchzuführen.[11]
Die Studien zur Infektion von Mäusen mit ATCV-1 zeigten bei infizierten Tieren Veränderungen im Cdk5-Signalweg,[75] der das Lernen und die Gedächtnisbildung unterstützt, sowie Veränderungen der Genexpression im Dopamin-Signalweg.[11] Infizierte Mäuse erwiesen sich zudem als weniger sozial und interagierten weniger mit neu eingeführten Begleitmäusen als die gesunde Kontrollgruppe. Sie verbrachten längere Zeit in einem lichtexponierten Bereich der Testkammer, wohingegen die Kontrollmäuse die wie üblich dunkle Seite bevorzugten und das Licht mieden. Dies deutet auf eine Abnahme der Angstzustände bei einer ATCV-1-Infektion hin. Die Testmäuse waren auch weniger in der Lage, ein Objekt zu erkennen, das von seiner vorherigen Position verschoben worden war, was eine Abnahme des räumlichen Referenzspeichers belegt.[12] Wie beim Menschen nimmt die räumliche Aufgabenfähigkeit des Sehzentrums ab.[11][12]
Literatur
- Dickson Kinyanyi, George Obiero, Peris W Amwayi, Stephen Mwaniki, Mark Wamalwa: In silico structural and functional prediction of African swine fever virus protein-B263R reveals features of a TATA-binding protein, in: PeerJ 6(4):e4396 (2018), doi:10.7717/peerj.4396, S. 13, insbes. Fig. 7
- Weijia Zhang, Jinglie Zhou, Taigang Liu, Yongxin Yu, Yingjie Pan, Shuling Yan, Yongjie Wang: Four novel algal virus genomes discovered from Yellowstone Lake metagenomes, in: Scientific Reports volume 5, Artikel Nr. 15131, 2015, doi:10.1038/srep15131, Abstract
Weblinks
Anmerkungen
- Das Material wurde von dieser Quelle kopiert, die unter einer Creative Commons Attribution 4.0 International License verfügbar ist.
Einzelnachweise
-
James L. Van Etten, Irina V. Agarkova, David D. Dunigan: Chloroviruses. In: Viruses, Band 12, Nr. 1, Reihe: Viruses Ten-Year Anniversary, 13. Dezember 2019, 20, doi:10.3390/v12010020.

- ICTV: ICTV Master Species List 2019.v1, New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35)
- Chuan Xiao, Matthias G. Fischer, Duer M. Bolotaulo, Nancy Ulloa-Rondeau, Gustavo A. Avila & Curtis A. Suttle: Cryo-EM reconstruction of the Cafeteria roenbergensis virus capsid suggests novel assembly pathway for giant viruses, in: Nature Scientific Reports Band 7, Nr. 5484, 14. Juli 2017, doi:10.1038/s41598-017-05824-w.

- Yutin N, Wolf YI, Koonin EV: Origin of giant viruses from smaller DNA viruses not from a fourth domain of cellular life. In: Virology. 466–467, Oktober 2014, S. 38–52. doi:10.1016/j.virol.2014.06.032. PMID 25042053. PMC 4325995 (freier Volltext).
- Dunigan DD, Fitzgerald LA, Van Etten JL: Phycodnaviruses: a peek at genetic diversity. In: Virus Research. 117, Nr. 1, April 2006, S. 119–32. doi:10.1016/j.virusres.2006.01.024. PMID 16516998.
- Viral Zone. ExPASy. Abgerufen am 23. Dezember 2018.
- ICTV: Virus Taxonomy. Abgerufen am 22. Dezember 2015.
- ICTV Master Species List 2018a v1, ICTV MSL including all taxa updates since the 2017 release.
- Russel H. Meints, James L. Van Etten, Daniel Kuczmarski, Kit Lee, Barbara Ang: Viral infection of the symbiotic chlorella-like alga present in Hydra viridis. In: Virology. 113, Nr. 2, September 1981, S. 698–703. PMID 18635088.
- Ryo Hoshina, Mayumi Shimizu, Yoichi Makino, Yoshihiro Haruyama, Shin-ichiro Ueda, Yutaka Kato, Masahiro Kasahara, Bun-ichiro Ono, Nobutaka Imamura: Isolation and characterization of a virus (CvV-BW1) that infects symbiotic algae of Paramecium bursaria in Lake Biwa, Japan. In: Virology Journal. 7, 13. September 2010, ISSN 1743-422X, S. 222. doi:10.1186/1743-422X-7-222. PMID 20831832. PMC 2949830 (freier Volltext).
- Yolken RH, Jones-Brando L, Dunigan DD, Kannan G, Dickerson F, Severance E, Sabunciyan S, Talbot CC, Prandovszky E, Gurnon JR, Agarkova IV, Leister F, Gressitt KL, Chen O, Deuber B, Ma F, Pletnikov MV, Van Etten JL: Chlorovirus ATCV-1 is part of the human oropharyngeal virome and is associated with changes in cognitive functions in humans and mice. In: Proceedings of the National Academy of Sciences of the United States of America. 111, Nr. 45, November 2014, S. 16106–11. doi:10.1073/pnas.1418895111. PMID 25349393. PMC 4234575 (freier Volltext).
- Marilyn S. Petro, Irina V. Agarkova, Thomas M. Petro: Effect of Chlorovirus ATCV-1 infection on behavior of C57Bl/6 mice. In: Journal of Neuroimmunology. 297, August 2016, S. 46–55. doi:10.1016/j.jneuroim.2016.05.009. PMID 27397075.
- Timo Greiner, Anna Moroni, James L. Van Etten, Gerhard Thiel: Genes for Membrane Transport Proteins: Not So Rare in Viruses, in: MDPI Viruses Band 10, Nr. 9, Special Issue Algae Virus, 26 August 2018, 456; doi:10.3390/v10090456
- William H. Wilson, Ilana C. Gilg, Mohammad Moniruzzaman, Erin K. Field, Sergey Koren, Gary R. LeCleir, Joaquín Martínez Martínez, Nicole J. Poulton, Brandon K. Swan, Ramunas Stepanauskas, Steven W. Wilhelm: Genomic exploration of individual giant ocean viruses, in: ISME Journal 11(8), August 2017, S. 1736–1745, doi:10.1038/ismej.2017.61, PMC 5520044 (freier Volltext), PMID 28498373. Hier offenbar irrtümlich als Acanthamoeba turfacea Chlorella virus (ATCV) bezeichnet.
- Hao Chen, Weijia Zhang, Xiefei Li, Yingjie Pan, Shuling Yan, Yongjie Wang: The genome of a prasinoviruses-related freshwater virus reveals unusual diversity of phycodnaviruses, in: BMC Genomics, Dezember 2018, online 15. Januar 2018, doi:10.1186/s12864-018-4432-4
- Guillaume Blanc, Garry Duncan, Irina Agarkova, Mark Borodovsky, James Gurnon, Alan Kuo, Erika Lindquist, Susan Lucas, Jasmyn Pangilinan, Juergen Polle, Asaf Salamov, Astrid Terry, Takashi Yamada, David D. Dunigan, Igor V. Grigoriev, Jean-Michel Claverie, James L. Van Etten: The Chlorella variabilis NC64A genome reveals adaptation to photosymbiosis, coevolution with viruses, and cryptic sex, in: Plant Cell 22, 2010, S. 2943–2955, doi:10.1105/tpc.110.076406
- NCBI: Paramecium bursaria Chlorella virus FR483 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus Br0604L (Species)
- NCBI: Acanthocystis turfacea Chlorella virus Can0610SP (Species)
- NCBI: Acanthocystis turfacea Chlorella virus Canal-1 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus GM0701.1 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus MO0605SPH (Species)
- NCBI: Acanthocystis turfacea Chlorella virus MN0810.1 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus NTS-1 (Species), Acanthocystis turfacea Chlorella virus NTS1 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus NE-JV-2 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus NE-JV-3 (Species)
- Shengzhong Xu, Liang Zhou, Xiaosha Liang, Yifan Zhou, Hao Chen, Shuling Yan, Yongjie Wang; Julie K. Pfeiffer (Hrsg.): Novel Cell-Virus-Virophage Tripartite Infection Systems Discovered in the Freshwater Lake Dishui Lake in Shanghai, China, in: Journal of Virology, 18. Mai 2020, doi:10.1128/JVI.00149-20, PMID 32188734
- NCBI: Acanthocystis turfacea Chlorella virus OR0704.3 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus TN603.4.2 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus TN603.4.2 (Species)
- NCBI: Acanthocystis turfacea Chlorella virus WI0606 (Species)
- NCBI: Paramecium bursaria Chlorella virus AN69C (Species)
- NCBI: Paramecium bursaria Chlorella virus AR158 (Species)
- NCBI: Paramecium bursaria Chlorella virus CZ-2 (Species)
- NCBI: Paramecium bursaria Chlorella virus AP110A (Species)
- NCBI: Paramecium bursaria Chlorella virus Can18-4 (Species)
- NCBI: Paramecium bursaria Chlorella virus CVB-1 (Species)
- NCBI: Paramecium bursaria Chlorella virus CVG-1 (Species)
- NCBI: Paramecium bursaria Chlorella virus CviKI (Species)
- Julien Andreani, Jacques Y. B. Khalil, Emeline Baptiste, Issam Hasni, Caroline Michelle, Didier Raoult, Anthony Levasseur, Bernard La Scola: Orpheovirus IHUMI-LCC2: A New Virus among the Giant Viruses, in: Front. Microbiol., 22. Januar 2018, doi:10.3389/fmicb.2017.02643
- NCBI: Paramecium bursaria Chlorella virus CVM-1 (Species)
- NCBI: Paramecium bursaria Chlorella virus CVR-1 (Species)
- NCBI: Paramecium bursaria Chlorella virus CvsA1 (Species)
- NCBI: Paramecium bursaria Chlorella virus CZ-2 (Species)
- NCBI: Paramecium bursaria Chlorella virus Fr5L (Species)
- NCBI: Paramecium bursaria Chlorella virus IL-5-2s1 (Species)
- NCBI: Paramecium bursaria Chlorella virus KS1B (Species)
- NCBI: Paramecium bursaria Chlorella virus MA-1D (Species)
- NCBI: Paramecium bursaria Chlorella virus MA-1E (Species)
- NCBI: Paramecium bursaria Chlorella virus NE-JV-1 (Species)
- NCBI: Paramecium bursaria Chlorella virus NE-JV-4 (Species)
- NCBI: Paramecium bursaria Chlorella virus NW665.2 (Species)
- NCBI: Paramecium bursaria Chlorella virus NY-2B (Species)
- NCBI: Paramecium bursaria Chlorella virus NYs1 (Species)
- NCBI: Paramecium bursaria Chlorella virus OR0704.2.2 (Species)
- NCBI: Only Syngen Nebraska virus 5 (Species)
- Frederik Schulz, Lauren Alteio, Danielle Goudeau, Elizabeth M. Ryan, Feiqiao B. Yu, Rex R. Malmstrom, Jeffrey Blanchard, Tanja Woyke: Hidden diversity of soil giant viruses, in: Nature Communicationsvolume 9, Article number: 4881 (2018) vom 19. November 2018, doi:10.1007/s00705-016-2853-4
- Fumito Maruyama, Shoko Ueki: Evolution and Phylogeny of Large DNA Viruses, Mimiviridae and Phycodnaviridae Including Newly Characterized Heterosigma akashiwo Virus. In: Front. Microbiol. 30. November 2016, doi:10.3389/fmicb.2016.01942, PMC 5127864 (freier Volltext), PMID 27965659.
- Eugene V. Koonin, Natalya Yutin: Multiple evolutionary origins of giant viruses, in: F1000 Research. 22. November 2018, doi:10.12688/f1000research.16248.1, version 1.
- Quispe CF, Sonderman O, Seng A, Rasmussen B, Weber G, Mueller C, Dunigan DD, Van Etten JL: Three-year survey of abundance, prevalence and genetic diversity of chlorovirus populations in a small urban lake. In: Archives of Virology. 161, Nr. 7, Juli 2016, S. 1839–1847. PMID 27068168.
- Short SM: The ecology of viruses that infect eukaryotic algae. In: Environmental Microbiology. 14, Nr. 9, September 2012, S. 2253–2271. doi:10.1111/j.1462-2920.2012.02706.x. PMID 22360532.
- James L. Van Etten, David D. Dunigan, Richard C. Condit: Giant Chloroviruses: Five Easy Questions. In: PLOS Pathogens. 12, Nr. 8, 18. August 2016, S. e1005751. doi:10.1371/journal.ppat.1005751. PMID 27536965. PMC 4990331 (freier Volltext).
- James L. Van Etten, David D. Dunigan: Chloroviruses: not your everyday plant virus. In: Trends in Plant Science. 17, Nr. 1, Januar 2012, S. 1–8. doi:10.1016/j.tplants.2011.10.005. PMID 22100667. PMC 3259250 (freier Volltext).
- DeLong JP, Al-Ameeli Z, Duncan G, Van Etten JL, Dunigan DD: Predators catalyze an increase in chloroviruses by foraging on the symbiotic hosts of zoochlorellae. In: Proceedings of the National Academy of Sciences of the United States of America. 113, Nr. 48, November 2016, S. 13780–13784. doi:10.1073/pnas.1613843113. PMID 27821770. PMC 5137705 (freier Volltext).
- Long AM, Short SM: Seasonal determinations of algal virus decay rates reveal overwintering in a temperate freshwater pond. In: The ISME Journal. 10, Nr. 7, Juli 2016, S. 1602–1612. doi:10.1038/ismej.2015.240. PMID 26943625. PMC 4918447 (freier Volltext).
- Yanai GM: Transcription analysis of the chlorovirus Paramecium bursaria chlorella virus-1 (PhD). University of Nebraska at Lincoln, 2009.
- Song H, Lavoie M, Fan X, Tan H, Liu G, Xu P, Fu Z, Paerl HW, Qian H: Allelopathic interactions of linoleic acid and nitric oxide increase the competitive ability of Microcystis aeruginosa. In: The ISME Journal. 11, Nr. 8, August 2017, S. 1865–1876. doi:10.1038/ismej.2017.45. PMID 28398349. PMC 5520033 (freier Volltext).
- Rieper M: Investigations on the relationships between algal blooms and bacterial populations in the Schlei Fjord (western Baltic Sea). In: Helgoländer wissenschaftliche Meeresuntersuchungen. 28, Nr. 1, 1. März 1976, S. 1–18. doi:10.1007/BF01610792.
- Cristian F. Quispe, Ahmed Esmael, Olivia Sonderman, Michelle McQuinn, Irina Agarkova, Mohammed Battah, Garry A. Duncan, David D. Dunigan, Timothy P.L. Smith, Cristina De Castro, Immacolata Speciale, Fangrui Ma, James L. Van Etten: Characterization of a new chlorovirus type with permissive and non-permissive features on phylogenetically related algal strains. In: Virology. 500, Januar 2017, S. 103–113. doi:10.1016/j.virol.2016.10.013. PMID 27816636. PMC 5127778 (freier Volltext).
- David M. Needham, Alexandra Z. Worden et al.: A distinct lineage of giant viruses brings a rhodopsin photosystem to unicellular marine predators, in: PNAS, 23. September 2019, doi:10.1073/pnas.1907517116, ISSN 0027-8424, hier: Supplement 1 (xlsx)
- Jean-Michel Claverie, Chantal Abergel: [ „Mimiviridae“: An Expanding Family of Highly Diverse Large dsDNA Viruses Infecting a Wide Phylogenetic Range of Aquatic Eukaryotes]. In: Viruses. 2018 Sep; 10(9), 18. September 2018, S. 506, doi:10.3390/v10090506, PMC 6163669 (freier Volltext), PMID 30231528, Tab. 2
-
Elad Milrot, Eyal Shimoni, Tali Dadosh, Katya Rechav, Tamar Unger, James L. Van Etten, Abraham Minsky: Structural studies demonstrating a bacteriophage-like replication cycle of the eukaryote-infecting Paramecium bursaria chlorella virus-1, in: PLOS Pathogens, Version 2, 29. April 2017, doi:10.1371/journal.ppat.1006562.

- Zhang X, Xiang Y, Dunigan DD, Klose T, Chipman PR, Van Etten JL, Rossmann MG: Three dimensional structure and function of the Paramecium bursaria chlorella virus capsid. Proc. Natl. Acad. Sci. USA 2011, 108, S. 14837–14842, doi:10.1073/pnas.1107847108, PMID 21873222
- Blanc G, Mozar M, Agarkova IV, Gurnon JR, Yanai Balser G, Rowe JM, Xia Y, Riethoven JJ, Dunigan DD, Van Etten JL: Deep RNA sequencing reveals hidden features and dynamics of early gene transcription in Paramecium bursaria chlorella virus 1. PLoS ONE 2014, 9:e90989, doi:10.1371/journal.pone.0090989, PMID 24608750
- Siehe auch Jerry H.-C. Wang
_virions.jpg.webp)
.png.webp)
.png.webp)
_anotated.png.webp)