Elbs-Oxidation
Die Elbs-Oxidation (auch Elbs-Persulfat-Oxidation genannt) ist eine Namensreaktion der Organischen Chemie. Die Reaktion wurde erstmals 1893 von dem deutschen Chemiker Karl Elbs (1858–1933) publiziert.[1] Sie dient der Synthese von Hydrochinonen aus Phenolen. Als Oxidationsmittel dienen Salze der Peroxodischwefelsäure wie Kaliumperoxodisulfat. Die Elbs-Oxidation ist nicht zu verwechseln mit der Elbs-Reaktion zur Synthese mehrkerniger Aromaten.
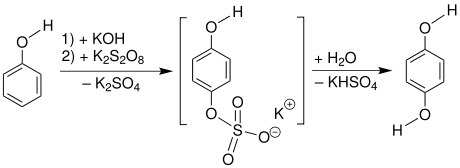
Reaktionsmechanismus
Die Elbs-Oxidation wird im basischen Milieu durchgeführt.[2] Zunächst wird Phenol (1) zu dem mesomeriestabilisierten Phenolat (2) deprotoniert. Das Kohlenstoffatom in para-Stellung greift dann nukleophil am Sauerstoffatom des Peroxodisulfats an, wodurch ein aromatisches Sulfat 5 entsteht. Dieses wird dann hydrolysiert, wodurch das erwünschte Produkt 8 freigesetzt wird.[3][4]
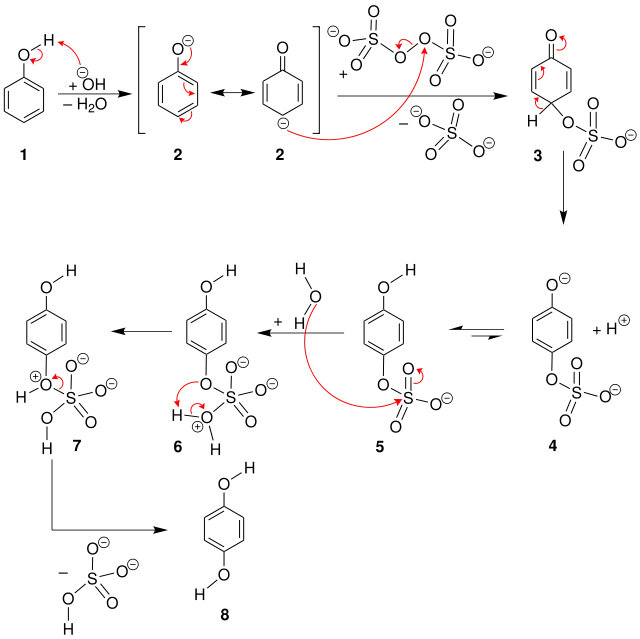
Das para-Produkt wird hierbei mit guter Selektivität gebildet. Brenzcatechin, beziehungsweise dessen Derivate werden dann gebildet, wenn die para-Position bereits durch einen Substituenten belegt ist. Jedoch sind die erreichbaren Ausbeuten mäßig.[3]
Einzelnachweise
- K. Elbs: Ueber Nitrohydrochinon. In: Journal für Praktische Chemie. 48, Nr. 1, 1893, S. 179–185, doi:10.1002/prac.18930480123.
- Siegfried Hauptmann: Organische Chemie. 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, ISBN 3-342-00280-8, S. 325.
- T. Laue, A. Plagens: Namen- und Schlagwort-Reaktionen. 4. Auflage, Teubner, Wiesbaden 2004, ISBN 3-519-33526-3, S. 112–114.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. Volume 1, Wiley, 2009, ISBN 978-0-471-70450-8 (3-Volume Set), S. 977.
Literatur
- Suresh M. Sethna: The Elbs Persulfate Oxidation. In: Chemical Reviews. 49, Nr. 1, 1951, S. 91–101, doi:10.1021/cr60152a002.
- E. J. Behrman: The Persulfate Oxidation of Phenols and Arylamines (The Elbs and the Boyland-Sims Oxidations). In: Org. React. 35, 1988, ISBN 978-0-471-83253-9, S. 421–511.