Bleichaktivator
Bleichaktivatoren oder auch Bleichmittelaktivatoren genannt, erlauben eine niedrigere Waschtemperatur, als sie zur Erzielung der vollen Aktivität von Bleichmitteln in der Waschflotte ansonsten erforderlich wäre. Bleichmittel, in der Regel Peroxide, sind häufig erst ab einer Temperatur von 60 °C ausreichend aktiv. Mit Bleichaktivatoren kann die Wirkung schon bei 40 °C auftreten.
Wirkungsweise
Bleichaktivatoren sind Feststoffe und reagieren sehr schnell mit flüssigen Bleichmitteln (Wasserstoffperoxid bzw. Peroxycarbonsäuren), die aus festen Peroxiden, wie z. B. Percarbonaten, in wässriger Phase entstehen. Daher finden Bleichaktivatoren als Granulat praktisch nur in festen Waschmittelzubereitungen Verwendung, in denen die Lagerstabilität durch die räumliche Trennung der festen Komponenten gewährleistet wird. Wasserfreie Zubereitungen[1] oder die Stabilisierung eines anionischen Aktivators mit kationischen Tensiden und Einbau in nicht-ionische Mizellen[2] konnten sich kommerziell nicht durchsetzen.
Ein wichtiger Aktivator ist Tetraacetylethylendiamin (TAED). TAED geht eine chemische Reaktion ein, z. B. mit dem Bleichmittel Natriumperborat. Dabei wird das Bleichmittel Peroxyessigsäure (= Peressigsäure) gebildet. Peressigsäure ist selbst ein Bleichmittel, das aber wegen seiner zu niedrigen Lagerstabilität z. B. in Vollwaschmitteln nicht direkt beigegeben wird.
TAED wirkt besser gegen hydrophile Flecken (Tee, Kaffee, Rotwein) und wird vor allem in Europa bei Waschtemperaturen zwischen 40 und 60 °C eingesetzt, während sich in den USA bei den dort gebräuchlichen Waschtemperaturen zwischen 20 und 40 °C Nonanoyloxybenzolsulfonat (NOBS) durchgesetzt hat. In Japan, wo auch im Winter mit kaltem Leitungswasser gewaschen wird, findet das NOBS-analoge LOBS (Dodecanoyloxybenzolsulfonat) und die carbonsäurehomologe DOBA (Decanoyloxybenzoesäure) Verwendung.
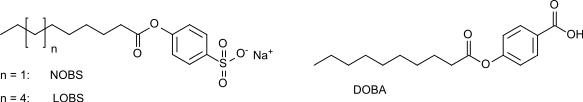
Die Persäuren Peroxynonansäure bzw. Peroxy(do)decansäure (herstellbar aus langkettigen Carbonsäureestern mit Wasserstoffperoxid) besitzen eine höhere Affinität zu hydrophoben Flecken (Ketchup, Curry, Sojasauce), was ein weiterer Grund für die größere Verbreitung in USA bzw. Japan ist.
Wirtschaftliche Bedeutung
Der Verbrauch von Bleichaktivatoren betrug 2002 ca. 105,000 Tonnen.[3] Der Verbrauch ist aber stagnierend bis rückläufig wegen des Kostendrucks bei Waschmitteln und des Vordringens flüssiger Waschmittelzubereitungen (die allerdings keine Bleichmittel und Bleichaktivatoren enthalten). Die relativ hohen Kosten herkömmlicher Bleichsysteme erschwert auch deren Verbreitung in den Schwellenländern, wo mit kaltem Wasser gewaschen wird und die Photobleichung durch Sonnenlicht oder – wie auch in den USA – die Verwendung von Natriumhypochloritlösung weit verbreitet ist.
Wegen der erheblichen Energieeinsparung beim Waschen mit niedrigeren Temperaturen (unter dem Schlagwort: „Kochwäsche bei Raumtemperatur“) besteht in Europa weiter ein erhebliches Potential für aktivere Bleichaktivatoren, deren höhere Aktivität jedoch nicht mit einer stärkeren Schädigung von Textilfarben und -fasern einhergehen darf. Neben der Fleckenbleiche bei der Wäsche spielt auch die desinfizierende und desodorierende Wirkung der Bleichmittel/Aktivator-Kombinationen eine wichtige Rolle – daher auch ihr Einsatz in Geschirrspülmitteln und Gebissreinigern.[1]
Beispiele
Typische Bleichaktivatoren sind im Wesentlichen N- und O-Acylverbindungen, die bei der Perhydrolyse, d. h. der Hydrolyse durch Wasserstoffperoxid aus dem Bleichmittel (Persalze), Peroxysäuren bilden. Aus TAED entsteht so in der Waschflotte die bleichaktive Peroxyessigsäure, aus DOBA Peroxydodecansäure. In allen Fällen wird der Aktivator in dem Verschmutzungsgrad der Wäsche entsprechenden Mengen chemisch umgesetzt und damit „verbraucht“.
In der Literatur ist eine Vielzahl aktiver N-Acylverbindungen beschrieben, wie z. B. Tetraacetylglycoluril und andere acylierte gesättigte stickstoffhaltige Heterocyclen, wie Hydantoine, Hydrotriazine, Diketopiperazine usw., sowie acylierte Imide und Lactame, die im wässrigen Medium ungeladen sind. Nachteilig gegenüber der Standardverbindung TAED ist ihre meist schlechtere ökonomische und ökologische Bilanz.
Neben den im wässrigen Milieu negativ geladenen (anionischen) acylierten Phenolderivaten NOBS, LOBS und DOBA sind weitere bleichaktive O-Acylverbindungen beschrieben, wie z. B. Tetraacetylxylose oder Pentaacetylglucose. Die in Japan gebräuchliche DOBA zeichnet sich durch gute Bioabbaubarkeit und stärkere Wirkung gegenüber einer Reihe von Mikroorganismen im Vergleich zu TAED aus. Beide zusammen wirken synergistisch.[4]
Ferner sind Nitrile, wie Cyanopyridin und Cyanamide, wie Cyanomorpholin und insbesondere die in wässriger Lösung kationischen Cyanomethyl-trialkyl/arylammoniumsalze, die sogenannten Nitrilquats,[5][6] als Bleichaktivatoren bekannt.
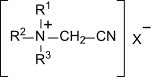
Nitrilquats sind bereits bei Temperaturen um 20 °C bleichaktiv und wirken über mit Peroxoverbindungen intermediär entstehende Peroxoiminosäuren. Diese zerfallen zu den entsprechenden quartären Amiden, die wiederum von Wasserstoffperoxid zu den korrespondierenden, gut bioabbaubaren Betainen reagieren.[7] Nachteilig bei Nitrilquats sind die schlechte Bioabbaubarkeit der originären Substanzen und ihre oft ausgeprägte Hygroskopizität, die jedoch durch geeignete Gegenionen reduziert werden kann.
Als weitere Bleichsysteme, insbesondere für Waschtemperaturen bei Raumtemperatur und darunter und für die Anwendung in flüssigen Waschmittelzubereitungen, sind neue Verbindungsklassen entwickelt worden:
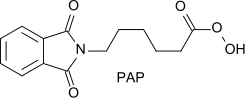
- Neue aktivere Peroxysäuren, wie z. B. Phthalimidoperoxyhexansäure (PAP)[8]
- Persäure-Booster, die mit Persäuren hochreaktive Zwischenstufen bilden, wie z. B. zyklische Sulfonimine als Vorstufen reaktiver Oxaziridine[9] oder zuckerbasierte Ketone, die mit Wasserstoffperoxid bleichaktive Dioxirane bilden[10]
- Bleichkatalysatoren, die als stabile Übergangsmetallkomplexe von Metallen wie Mangan, Eisen, Kobalt usw. bereits bei Temperaturen unter 30 °C mit Persalzen bleichaktive Sauerstoffspezies bilden und in ihrer Aktivität den Standard TAED um fast das 100-fache[11] übertreffen. Solche Komplexe bieten enorme ökonomische (geringeres Waschmittelvolumen, weniger Verpackung, geringere Transportkosten) und ökologische (niedrige Waschtemperatur, geringe Abwasserbelastung) Vorteile. Besonders interessant sind Bleichkatalysatoren der zweiten Generation, die bereits mit Luftsauerstoff bleichaktive Spezies bilden, d. h. biomimetisch die Aktivzentren natürlicher Mono- oder Dioxygenasen nachahmen können. 1994 scheiterte die Markteinführung von „Persil Power“ mit einem Mangankomplex[12] der ersten Generation durch die Firma Unilever in Großbritannien aufgrund zu starker Entfärbung und Schädigung des Gewebes bei älteren Textilien, insbesondere wenn diese bestimmte Farbstoffe enthielten.[13] Die bisher einzige Verwendung von Bleichkatalysator/Persalz-Kombinationen ist in Geschirrspülmitteln.
Einzelnachweise
- Clariant Surfactant Division: The Clean and Clever Way of Bleaching, PERACTIVE® (Memento vom 17. Juli 2013 im Internet Archive) (PDF; 885 kB), August 1999.
- M. Tsumadori, J. Oleo. Sci., 50 (5), 367-372 (2001) und M. Tsumadori: Recent trends of surfactants in the fabric & home care field, in CD Proceedings 6th World Surfactants Congress CESIO, Berlin, Germany, June 21-23, 2004 (paper # 196).
- G. Reinhardt, To Bleach or Not to Bleach – New Oxygen-Based Bleach Technology, in 5th World Conference on Detergents: Reinventing the Industry: Opportunities and Challenges, edit. A. Cahn, AOCS Publishing, 2003, ISBN 978-1-893997-40-0.
- M. Sajitz, J. Grohmann: Hygiene Effects of Bleach Systems in Laundry Detergents (Seite nicht mehr abrufbar, Suche in Webarchiven) (PDF; 401 kB), SOFW Journal 10-2012.
- G. Reinhardt et al., Neue reaktive Bleichaktivatoren – eine Gratwanderung zwischen Bleicheffizienz und Farb-/Faserschädigung, Tenside, Surf. Det., 34 (6), 404-409 (1997)
- Patent EP0790244: Ammoniumnitrile und deren Verwendung als Bleichaktivatoren. Veröffentlicht am 20. August 1997, Anmelder: Hoechst AG, Erfinder: M. Löffler.
- Lars Cuypers, Martina Hirschen, Gerd Reinhardt: Bleaching Product Development in View of Ecological Aspects. In: Tenside Surfactants Detergents. Band 42, Nr. 6, Dezember 2005, S. 342–346, doi:10.3139/113.100277.
- Patent EP0349940: Phthalimidoperoxihexansäure, Verfahren zu deren Herstellung und deren Verwendung. Veröffentlicht am 13. Mai 1998, Anmelder: Clariant GmbH, Erfinder: Hanspeter Gethöffer, Gerd Reinhardt.
- Patent EP0923636: Color-safe bleach boosters, compositions and laundry methods employing same. Veröffentlicht am 20. Januar, Anmelder: The Procter & Gamble Co., Erfinder: G.S. Miracle et al..
- Patent EP1209221: Verwendung von cyclischen Zuckerketonen als Katalysator für Persauerstoffverbindungen. Veröffentlicht am 29. Mai 2002, Anmelder: Clariant GmbH, Erfinder: G. Reinhardt, N. Reichardt.
- Patent EP1225215: Verwendung von Übergangsmetallkomplexen mit Oxim-Liganden als Bleichkatalysatoren. Veröffentlicht am 24. Juli 2002, Anmelder: Clariant GmbH, Erfinder: G. Reinhardt et al..
- Patent US5244594: Bleach activation multinuclear manganese-based coordination complexes. Veröffentlicht am 14. September 1993, Anmelder: Lever Brothers Co., Erfinder: T.L.F. Favre et al..
- M. Verrall, Unilever consigns manganese catalyst to the back-burner, Nature, 373, (1995), 181 und Chemistry in action!, 45, The soap wars: detergent giants fight dirty (Memento vom 12. Dezember 2013 im Internet Archive), letzte Revision am 17. November 1996.