Phenylpropanoide
Phenylpropanoide (griech.: Endung -ειδἠς (-eides) „ähnlich“) sind organische Verbindungen, die sich vom Phenylpropan ableiten, einem typischen Kohlenstoffgrundgerüst, das aus einem Benzolring und einer Seitenkette aus drei Kohlenstoffatomen aufgebaut ist. Sie tragen am Aromaten häufig sowohl Hydroxy- als auch Methoxygruppen als Substituenten. Auch die Seitenkette wird sehr variiert. Es können sich dort C=C-Doppelbindungen befinden; oft ist das endständige Kohlenstoffatom zum Alkohol, Aldehyd oder einer Carbonsäure oxidiert. Viele Phenylpropanoide sind Naturstoffe, die in Pflanzen und Mikroorganismen über den Shikimat-Biosyntheseweg[1] mit Phenylalanin als Zwischenprodukt[2] gebildet werden. Phenylpropanoide sind, neben den Terpenen, ein häufiger Bestandteil von ätherischen Ölen und stellen die Mehrzahl der natürlich vorkommenden phenolischen Naturstoffe bzw. deren Vorstufe dar. Zu den bekannten Vertretern aus der Gruppe der Phenylpropanoide gehören: Anethol, Apiol, Zimtaldehyd, Dillapiol und Estragol.
Vorkommen
Phenylpropanoide sind eine sehr häufig vorkommende Klasse sekundärer Pflanzenstoffe, welche die Hauptmenge der natürlich vorkommenden Phenole und Aromaten darstellt bzw. deren biosynthetische Vorstufe sind. Das strukturelle Spektrum ist sehr breit gefächert und sie erfüllen vielfältige biologische Aufgaben.[3][4]
Als Beispiel für die biologische Funktion wären die Flavonoide zu nennen, welche für viele Arten einen Schutz gegen ultraviolette Strahlung und Blütenfarbstoffe darstellen.[5] Oder aber das Biopolymer Lignin, welches dem pflanzlichen Gewebe Stabilität gibt.[6]
Zimtsäuren
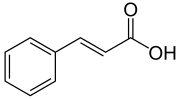
Ein zentrales Zwischenprodukt der meisten Phenylpropanoide stellen die Zimtsäure oder verschiedene Hydroxy- bzw. Methoxyzimtsäuren dar. In vielen Pflanzen stellen sie jedoch in Form von Konjugaten ein Endprodukt dar.[7] Das Vorkommen bestimmter Verbindungen ist dabei häufig auf eine bestimmte Anzahl Arten begrenzt.
Die Zimtsäuren werden biosynthetisch aus Phenylalanin mit Hilfe des Enzyms Phenylalanin-Ammoniak-Lyase (PAL) hergestellt. Eine Reihe von enzymatischen Hydroxylierungen und Methylierungen führt dann zu den Zimtsäurederivaten wie p-Cumarsäure, Kaffeesäure, Ferulasäure, 5-Hydroxyferulasäure und 4-Hydroxy-3,5-dimethoxyzimtsäure. Die Ester dieser Zimtsäuren sind flüchtige Verbindungen mit herbem oder blumigem Duft und dienen dem Anlocken von bestäubenden Insekten. Ein Beispiel hierfür ist der Zimtsäureethylester.
Zimtaldehyde und Monolignole
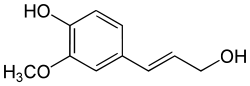
Die Reduktion der Carbonsäure-Gruppe in den Zimtsäuren führt zunächst zu den korrespondierenden Aldehyden wie Zimtaldehyd. Durch einen weiteren Reduktionschritt wird dann der entsprechende Alkohol wie Cumarylalkohol oder Coniferylalkohol hergestellt, welche Monolignole genannt werden. Diese Monolignole können zu Ligninen oder Suberinen polymerisieren, die als Zellwände von Pflanzen von Bedeutung sind.
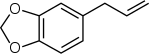
Die Phenylpropene wie Eugenol, Safrol, Myristicin, Elemicin, Estragol sind Derivate der Monolignole und sind Bestandteile von ätherischen Ölen.
Cumarine und Flavonoide
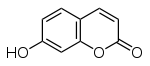
Die Hydroxylierung von Zimtsäure durch das Enzym Zimtsäure-4-Hydroxylase ergibt die p-Cumarsäure, die durch eine weitere Hydroxylierung in 2-Stellung und anschließende Cyclisierung Umbelliferon ergibt.
Flavonoide werden ebenfalls über die p-Cumarsäure hergestellt. Mit Hilfe der Chalkonsynthase reagiert das Cumaryl-CoA mit drei Molekülen Malonyl-CoA zum Chalkon. Eine Isomerase überführt dieses dann in Flavanon, aus welchem alle Flavonoide biosynthetisiert werden.
Stilbenoide
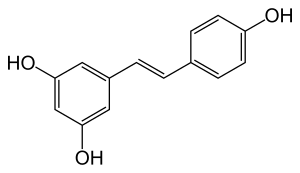
Stilbenoide wie etwa Resveratrol sind hydroxylierte Derivate von Stilben. Sie werden gebildet durch eine alternative Cyclisierung von Zimtsäure-CoA oder Cumaryl-CoA.
Lignane
Dimere Phenylpropanoide werden als Lignane oder Neolignane bezeichnet. Lignane sind dabei über das β-Atom der Propylseitenkette dimerisiert (z. B. im Podophyllotoxin), Neolignane über zwei andere Atome, z. B. über ein Atom der Propylkette sowie ein Atom des Aromaten (3,8′-Verknüpfung) oder über zwei Aromatenatome (z. B. 3,3′-Verknüpfung, z. B. im Honokiol).
Literatur
- G. Michal (Hrsg.): Biochemical Pathways – Biochemie-Atlas, 1. Auflage, Spektrum Akademischer Verlag, Heidelberg Berlin 1999, ISBN 3-86025-239-9.
- Peter Nuhn: Naturstoffchemie: Mikrobielle, pflanzliche und tierische Naturstoffe, 2., neubearb. u. erw. A., Hirzel Verlag, Stuttgart 1997.
Einzelnachweise
- Phenylpropanoid biosynthesis – Reference pathway
- The Douglas Laboratory, Department of Botany, UNIVERSITY OF BRITISH COLUMBIA: Overview of Phenylpropanoid Metabolism (Memento vom 10. Juni 2007 im Internet Archive).
- D. Strack: In: P.M. Dey, J.B. Harborne, editors. Plant Biochemistry; Academic Press San Diego California, USA 1997. p 387–416.
- G. Richter: In Stoffwechselphysiologie der Pflanzen. 6th ed.: Thieme Verlag, Stuttgart 1998, Chapter 8, Phenole; S. 365–390.
- L.G. Landry, C.C.S. Chapple, R. Last: Arabidopsis Mutants Lacking Phenolic Sunscreens Exhibit Enhanced Ultraviolet-B Injury and Oxidative Damage.; Plant Physiol, 1995, 109, S. 1159–1166; doi:10.1104/pp.109.4.1159.
- C.F. Douglas: Phenylpropanoid metabolism and lignin biosynthesis: from weeds to trees. Trends Plant Sci, 1996,1, S. 171–178; doi:10.1016/1360-1385(96)10019-4.
- D. Strack, H.P. Mock: In P.M. Dey, J.B. Harborne, editors. Volume 9, methods in plant biochemistry: enzymes of secondary metabolism; Academic Press, San Diego California, USA 1993, S. 45–97.