Cyanidin
Cyanidin ist ein zur Gruppe der Anthocyanidine zählender kationischer Pflanzenfarbstoff. An Kohlenhydrate (Zucker) gebunden ist das Kation Bestandteil zahlreicher Glycoside, die auch in pflanzlichen Lebensmitteln vorkommen.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
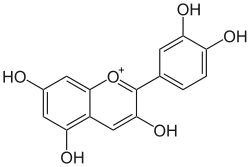 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cyanidin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C15H11O6+ | ||||||||||||
| Kurzbeschreibung |
violetter Feststoff (Chlorid)[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 287,24 g·mol−1
322,70 g·mol−1 (Chlorid) | ||||||||||||
| Aggregatzustand |
fest (Chlorid) | ||||||||||||
| Schmelzpunkt |
> 300 °C (Chlorid, Zersetzung)[2] | ||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Blaufarbene Blüten und Früchte waren für Naturforscher schon immer faszinierende Objekte. So untersuchten die französischen Chemiker E. Frémy und S. Cloëz die blauen Pflanzenfarbstoffe der Kornblume, des Veilchens und der Schwertlilie, und bezeichneten diese mit dem Namen Cyanin (gr. cyanos, κυανός, blau).[5] Richard Willstätter und Arthur E. Everest legten 1913 eine umfangreiche Abhandlung über Anthocyane vor, in der sie u. a. über den Farbstoff der Kornblume (Centaurea cyanus L.) berichteten. Sie fanden, dass Cyanin ein Glycosid ist, genauer ein Glucosid. Es wird durch Hydrolyse mit Mineralsäuren in Glucose und die eigentliche Farbstoffkomponente, das Aglykon, gespalten, welches von den Autoren als Cyanidin bezeichnet wurde.[6] Das Aglykon wurde daraufhin auch in den Blütenblättern der Winteraster (Chrysanthemum indicum L.), der Stiefmütterchen (Viola species), sowie der Löwenmäulchen (Antirrhinum majus) – Klassikern der Pflanzengenetik – nachgewiesen und isoliert, welches die Autoren folglich Chrysanthemin bzw. Antirrhinin nannten.[7][8][9]
Vorkommen
Abgesehen von der Kornblume und den obengenannten Pflanzen ist Cyanidin in Glycosidform als Anthocyan in vielen Pflanzen enthalten, darunter Rotkohl, roten Rosen, Hibiskus, Blaubeeren, Himbeeren, Pflaumen, Holunderbeeren, Brombeeren, Blutorangen und Rhabarber.[10]
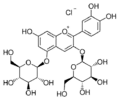 Cyanin (Cyanidin-3,5-O-diglucosid)
Cyanin (Cyanidin-3,5-O-diglucosid)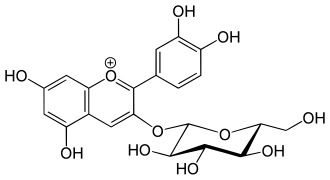 Chrysanthemin, Kuromanin (Cyanidin-3-O-glucosid)
Chrysanthemin, Kuromanin (Cyanidin-3-O-glucosid)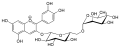 Antirrhinin, Keracyanin, Prunicyanin, Sambucin (Cyanidin-3-O-rutinosid)
Antirrhinin, Keracyanin, Prunicyanin, Sambucin (Cyanidin-3-O-rutinosid)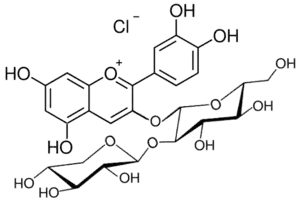 Sambicyanin (Cyanidin-3-O-sambubiosid)
Sambicyanin (Cyanidin-3-O-sambubiosid) Cyanidin-3-O-glycoside in Holunder
Cyanidin-3-O-glycoside in Holunder
Methylether des Cyanidins (Peonidin und Rosinidin) kommen ebenfalls in der Natur als Glycoside vor.
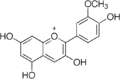 Peonidin, Paeonidin
Peonidin, Paeonidin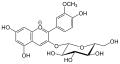 Peonidin-3-O-glucosid
Peonidin-3-O-glucosid Rosinidin
Rosinidin
Gewinnung und Herstellung
Cyanidin wurde durch Extraktion und hydrolytische Abspaltung der Kohlenhydrat (Zucker)- Komponente gewonnen. Zur Isolierung wird das Chlorid – Cyanidinchlorid – hergestellt. Den Arbeitskreisen von Willstätter und Robinson gelangen Synthesen, die damals zum Strukturbeweis dienten (siehe auch Pelargonidin).
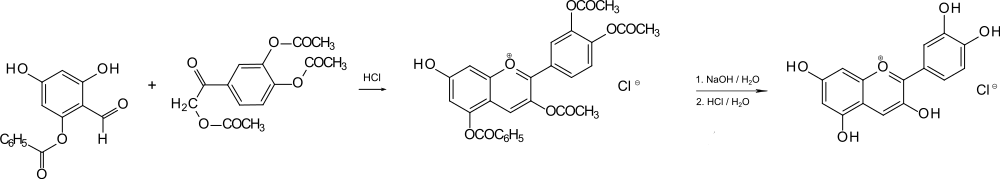
Das Chlorid des Cyanidins ließ sich aus verdünnter alkoholischer Salzsäure, d. h. einer Lösung von Chlorwasserstoff in 96-prozentigem Ethanol, in Kristallform als Monohydrat ausfällen.
Eigenschaften
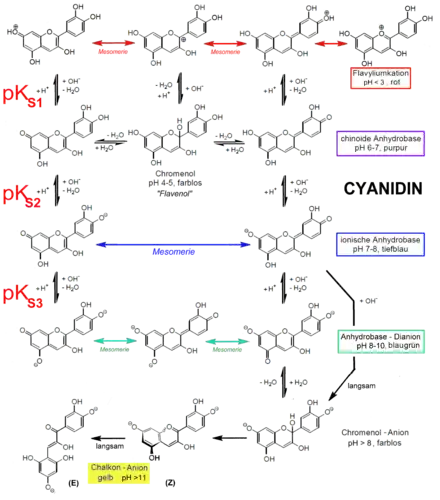
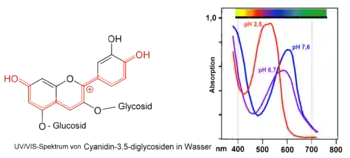
Das Salz bildet braunrote Nadeln, die metallisch glänzen. Entfernt man das Kristallwasser durch Erhitzen, so schmilzt die wasserfreie Verbindung nicht unter 300 °C. Cyanidinchlorid ist praktisch unlöslich in Wasser[3] Es löst sich gut in Ethanol mit violetter Färbung, in wässriger Natriumcarbonat-Lösung mit blauer Farbe (siehe unten). In verdünnter Salzsäure oder Schwefelsäure ist die Löslichkeit gering. In saurer Lösung absorbiert das Cyanidin-Kation Licht im Bereich von ca. 450-580 nm mit einem Absorptionsmaximum bei 535 nm.[11] Dies entspricht der roten Farbe des Flavylium-Kations. Bei einem pH-Wert von 6–6,5 wird es zu einem rotvioletten Produkt mit chinoider Struktur deprotoniert.[2] Bis pH 8 wandelt sich diese Farbe durch weitere Deprotonierung in königsblau. Bei noch höherem pH zeigen Extrakte von schwarzem Holunder oder Rotkohl auch Grünfärbungen.
Cyanidin als Indikator
Da sich die Struktur von Cyanidin je nach pH-Wert der Umgebung ändert und jede Struktur eine andere Farbe besitzt, kann eine Cyanidin beinhaltende Lösung zur Bestimmung des pH-Wertes über nahezu die gesamte pH Skala benutzt werden, eignet sich daher als Indikator.[12] Die 3-O-Glycoside und 3,5-O-Diglycoside des Cyanidins verhalten sich prinzipiell genauso.

In den Pflanzen (Kornblume, Stiefmütterchen) liegt Cyanidin nicht als solches vor, sondern als Komplex mit Aluminium- und Eisen-Ionen. Seine Struktur ist kompliziert.[13] Der Farbstoff besteht aus einem Chelat-Komplex, in dessen Zentrum sich ein Al3+ - und ein Fe3+-Ion befinden, welche unter anderem von Cyanin- und Flavon-Molekülen umgeben sind.
Der Komplex besteht aus 6 Anthocyan- (Cyanin und Succinylcyanin) und 6 Flavon-Molekülen sowie 2 Metall-Ionen (Fe(III) und Al(III))[14]
Literatur
- Norbert Welsch und Claus Chr. Liebmann: Farben, Natur Technik. In: Kunst. 2. Auflage 2006, Spektrum Akademischer Verlag, ISBN 3-8274-1563-2.
Einzelnachweise
- Datenblatt Cyanidin chloride, ≥95% (HPLC) bei Sigma-Aldrich, abgerufen am 12. Februar 2019 (PDF).
- Eintrag zu Anthocyane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. April 2014.
- Sujata V. Bhat, B.A. Nagasampagi, Meenakshi Sivakumar: Chemistry of Natural Products. Springer Science & Business Media, 2005, ISBN 978-3-540-40669-3, S. 602 (eingeschränkte Vorschau in der Google-Buchsuche).
- Axxora.com: Cyanidin chloride (Memento vom 11. März 2007 im Internet Archive), abgerufen am 11. September 2013.
- E. Frémy, S. Cloëz, In: Journal für Praktische Chemie Jg. 1854, Bd. 62, S. 269. Zitiert nach Willstätter & Everest.
- Richard Willstätter, Arthur E. Everest: Über den Farbstoff der Kornblume, In: Justus Liebigs Annalen der Chemie, Jg. 1913, Bd. 401, S. 189.
- Richard Willstätter, E. K. Bolton: Justus Liebigs Annalen der Chemie, Jg. 1917, Bd. 412, S, 136
- Currey Geoffrey Sauders: The colouring matter of the blue pansy. In: Proceedings of the Royal Society B (London), Jg. 1924, Heft 678, Bd. 96, S. 374–382. doi.org/10.1098/rspb.1924.0033
- Rose Scott-Moncrieff: Natural Anthocyanin Pigments. The magenta flower pigment of Antirrhinum majus. In: Biochemistry Jg. 1930, S. 748-766.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 422, ISBN 978-3-906390-29-1.
- Rose Scott-Moncrieff: Natural Anthocyanin Pigments. The magenta flower pigment of Antirrhinum majus. In: Biochemistry Jg. 1930, S. 748-766, dort Abbildung des Spektrums.
- Peter Keusch, Universität Regensburg: Anthocyane als pH-Indikatoren und Komplexbildner (Memento vom 9. Juli 2009 im Internet Archive).
- Ernst Bayer: Über den blauen Farbstoff der Kornblume, I. Natürliche und synthetische Anthocyan-Metallkomplexe. In: Chemische Berichte, Jg. 1958, Bd. 91, Heft 5, S. 1115-1122. DOI.org/10.1002/cber.19580910539
- Ernst Bayer, H. Egeter, A. Fink, K. Nether, K. Wegmann: Komplexbildung und Blütenfarben. In: Angewandte Chemie, Jg. 1966, Bd. 78, S. 834-841.DOI.org/10.1002/ange.19660781803