Silber-Silberchlorid-Elektrode
Die Silber-Silberchlorid-Elektrode ist, wie auch die Kalomel-Elektrode, eine Elektrode zweiter Art.
Aufbau
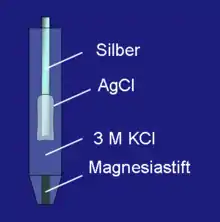

Bei diesem Elektrodentyp taucht meist ein mit Silberchlorid beschichteter Silberdraht in eine Chlorid-Ionen enthaltende Lösung (meist 3 M oder gesättigte Kaliumchlorid-Lösung). Die elektrisch leitende Verbindung zur Elektrolytlösung wird über ein Diaphragma, einen Schliffstopfen oder einen eingeschmolzenen Magnesiastift hergestellt. Dieses Material aus gesintertem Magnesiumoxid ist etwas porös. Diese Poren und die winzigen Spalten und Kanälchen zwischen Glas und Magnesia füllen sich mit dem Elektrolyten. Dadurch ist ein minimaler Ionenfluss gewährleistet, der ausreicht, um die Redox-Gleichgewichte an der Elektrodenoberfläche einzustellen. Der Eingangswiderstand eines Spannungsmessgeräts bzw. der Referenzelektroden-Eingang eines Potentiostaten ist sehr hochohmig, so dass hier keine nennenswerten Ströme zustande kommen. Eine spezielle Elektrode, die im Bauwesen und bei Ankern ihre Anwendung findet, ist die CMS-Elektrode.
Funktionsprinzip
Der potentialbestimmende Schritt ist die Oxidation von Silber mit anschließender Bildung von festem Silberchlorid. Die Reaktionsgleichung dieses Halbelementes lautet:
Die zugehörige Formulierung der Nernstgleichung lautet wie folgt:
Da Silberchlorid eine in Wasser schwerlösliche Verbindung ist, wird die Aktivität der Silberionen über das Löslichkeitsprodukt des Silberchlorids von der Aktivität der Chloridionen bestimmt:
Wird die Ag+-Ionenkonzentration kleiner als die Sättigungskonzentration nach dem Löslichkeitsprodukt, so löst sich festes AgCl auf und umgekehrt. Durch diese Abhängigkeit der Ag+-Konzentration von der Cl−-Konzentration lässt sich ein konstantes Potential einstellen, welches nur von der Chloridionenkonzentration abhängt.
Der logarithmische Term kann jetzt weiter vereinfacht werden gemäß:
Dabei ist der das Löslichkeitsprodukt enthaltende Term konstant und wird deshalb zusammen mit E0 für eine Elektrode zweiter Art tabelliert.
Mit Werten von E0 = 0.800 V, E = 0.222 V und KL = 2*10−10 mol2/l2 erhält man sinnvolle Ergebnisse. Anstelle der Aktivität wird oft auch die Konzentration oder die Molalität benutzt.
Anwendungsgebiete
Durch ihr konstantes Potential dient die Ag/AgCl-Elektrode als Bezugselektrode in vielen elektrochemischen Analyseverfahren. Mit ihr kann beispielsweise über ein hochohmiges Voltmeter das Potential einer ionenselektiven Messelektrode in einer Analytlösung bestimmt werden (vgl. Potentiometrie), um so die Ionenaktivität zu ermitteln.
In aktuellen Forschungen werden Ag/AgCl-Chloridsensoren beispielsweise zur Messung der freien Chloridionen im Porenwasser von Stahlbetonbauteilen eingesetzt und instrumentiert. Derartige Sensoren fallen in die Kategorie der ionensensitiven Sensoren und bestehen aus einem mit Silberchlorid überzogenen Silberdraht (CMS-Elektrode). Das Ziel ist die Erstellung einer kontinuierlichen Aufnahme von Messwerten zur Auswertung der Tiefe der Chlorideindringfront von außen in den Beton hinein. Eine Depassivierung der Bewehrung und somit eine Korrosion derselben soll frühzeitig erkannt werden, um mit geeigneten Maßnahmen gegensteuern zu können.
Literatur
- Gerd Wedler: Lehrbuch der Physikalischen Chemie. 5., vollständig überarbeitete und aktualisierte Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31066-5.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 5. Auflage. Walter de Gruyter, Berlin u. a. 2002, ISBN 3-11-017439-1.
- Yves Schiegg: Online-Monitoring zur Erfassung der Korrosion der Bewehrung von Stahlbetonbauten. Zürich 2002 (Dissertation, ETH Zürich, 2002), doi:10.3929/ethz-a-004319266.