Diazoessigsäureethylester
Diazoessigsäureethylester, kurz Diazoessigester oder EDA, ist eine Diazoverbindung, die durch Diazotierung von Glycinethylester-hydrochlorid entsteht. EDA spielt eine wichtige Rolle als Synthesereagens zur Bildung von Cyclopropancarbonsäure- und Cyclopropencarbonsäurederivaten, von β-Ketoestern im Sinne einer Buchner-Curtius-Schlotterbeck-Reaktion, zur Kettenverlängerung von Ketonen und für 1,3-Dipolare Cycloadditionen.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
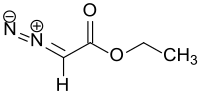 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diazoessigsäureethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H6N2 O2 | ||||||||||||||||||
| Kurzbeschreibung |
klare, gelbe Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser, löslich in Ethanol, Aceton, Benzol, Diethylether und in Ligroin[3] | ||||||||||||||||||
| Brechungsindex |
1,4616 (25 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Diazoessigsäureethylester wurde erstmals 1883 von Theodor Curtius beschrieben, der aus Glycinethylester-hydrochlorid mit Natriumnitrit NaNO2 in Wasser ein mit Diethylether extrahierbares gelbes Öl erhielt.[1] Nach einer Laborvorschrift[4] erhält man daraus praktisch reinen Diazoessigester in guter Ausbeute (85 %).
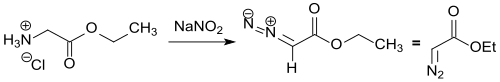
Durch temperaturkontrollierte Reaktion im Zweiphasensystem Wasser-1,2-Dichlorethan konnte das Reinprodukt mit 93,5 % Ausbeute erhalten werden.[5]
Bei der Reaktion von Glycinethylester mit dem stabilen Diazonium-tetrafluoroborat des 4-Nitroanilins entsteht durch Rückspaltung der gebildeten Triazenzwischenstufe EDA.[6]
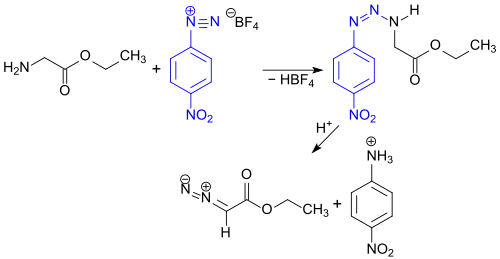
In jüngerer Zeit wurden wegen der Giftigkeit und Explosionsneigung des Diazoessigsäureethylesters auch Synthesen der Substanz und ihrer Derivate mittels Mikroreaktoren durchgeführt.[7][8]
Eigenschaften
Ethyldiazoacetat ist eine klare, gelbe Flüssigkeit von stechendem Geruch, die sich in Wasser wenig löst, aber mit vielen organischen Lösungsmitteln mischbar ist. Die Verbindung ist flüchtig und „beim Erhitzen tritt gegen 110 °C unter gewaltiger Wärmeentwicklung plötzlich mit großer Heftigkeit Zersetzung ein“.[1] Während Diazoessigester im Alkalischen relativ stabil ist, zerfällt er in Gegenwart von Wasser und Säuren und bei Bestrahlung unter Abspaltung von Stickstoff. Handelsüblich sind Lösungen in Dichlormethan oder Toluol, die kalt und dunkel gelagert werden sollten. EDA kann durch fraktionierte Vakuumdestillation unter Einhaltung strikter Explosionsschutzregeln gereinigt werden.[4] Die Verbindung wird allerdings auch als „relativ stabile, im Vakuum unzersetzt destillierbare Flüssigkeit“ beschrieben.[9]
Anwendungen
Bildung von Cyclopropanen und Cyclopropenen
Bei der thermisch oder photochemisch induzierten Abspaltung von Stickstoff N2 aus Diazoessigsäureethylester entsteht das reaktive Carben :CH-COOC2H5, das unter Katalyse mit speziellen Goldkomplexen mit Ethen in bis zu 70 % Ausbeute zu Cyclopropancarbonsäure reagiert.[10]

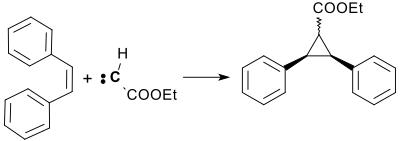
Mit Stilben reagiert Diazoessigester in Gegenwart von wasserfreiem Kupfersulfat CuSO4 mit hohen Ausbeuten zu 2,3-Diphenylcyclopropan-1-carbonsäureethylester. Aus cis-Stilben entsteht ausschließlich der trans,trans-Ester, aus trans-Stilben hingegen das Gemisch der cis,trans-Isomeren.[11]
Die vielen Pyrethroiden mit insektizider Wirksamkeit zugrundeliegende Chrysanthemumsäure ist durch Cyclopropanierung von 2,5-Dimethyl-hexa-2,4-dien mit EDA zugänglich.[12]
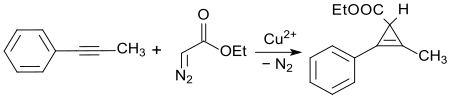
Durch Addition des Carbens aus EDA an Alkine werden Cyclopropencarbonsäurederivate gebildet.[13]
Ringerweiterung durch Buchner-Reaktion
Bei der Buchner-Reaktion von Ethyldiazoacetat mit Benzol erfolgt eine Ringerweiterung zu isomeren Cycloheptatrien-carbonsäureestern.[14]
Bildung von β-Ketoestern
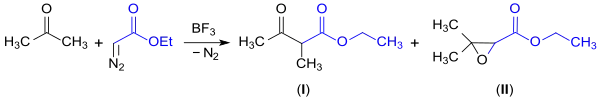
Aldehyde und Ketone können unter Katalyse mit Zinn(II)-chlorid SnCl2[15] oder Bortrifluorid BF3[16] mit Diazoessigester im Sinne einer Kettenverlängerung in die entsprechenden β-Ketoestern überführt werden.

Mit dem einfachsten Keton Aceton reagiert EDA bei tiefen Temperaturen zu einem Gemisch von 2-Methylacetessigsäureethylester (Ethyl-2-methyl-acetoacetat)[17] (I) und 3,3-Dimethyloxiran-2-carbonsäureethylester (Ethyl-3,3-dimethylglycidat, 5369-63-1) (II).[18]
Cycloadditionen mit EDA
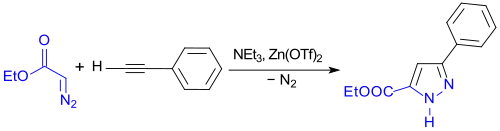
Als 1,3-Dipol lässt sich Ethyldiazoacetat leicht mit so genannten Dipolarophilen, wie z. B. Alkenen und Alkinen, in einer [3+2]- Cycloaddition zu Pyrazolinen bzw. Pyrazolen umsetzen.[19]
So entsteht mit Phenylacetylen und EDA in Gegenwart von Triethylamin NEt3 und der Lewis-Säure Zinktriflat Zn(OTf)2 in hoher Regioselektivität und Ausbeute das entsprechende substituierte Pyrazol[20]
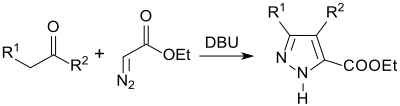
Pyrazol-5-carbonsäuren können durch 1,3-dipolare Cycloaddition von Diazoessigsäureethylester an Carbonylverbindungen mit freien α-Methylengruppen in Gegenwart der starken Base Diazabicycloundecen DBU in Acetonitril in guter Ausbeute und hoher Regioselektivität erhalten werden.[21]
In einer [3+2]-Cycloaddition reagiert Ethyldiazoacetat mit Dehydrobenzol, z. B. aus 2-(Trimethylsilyl)phenyltriflat (88284-48-4), in Gegenwart von Tetrabutylammoniumfluorid TBAF unter Bildung von Indazolen.[22]

Einzelnachweise
- T. Curtius: Ueber die Einwirkung von salpetriger Säure auf salzsauren Glycocolläther. In: Ber. Dtsch. Chem. Ges. Band 16, Nr. 2, 1883, S. 2230–2231, doi:10.1002/cber.188301602136.
- Datenblatt Diazoessigsäure-ethylester bei Sigma-Aldrich, abgerufen am 15. Januar 2022 (PDF).
- V.V. Popik, A.E. Russell, W.D. Wulff, A. Mohammadlou: Ethyl Diazoacetate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2017, doi:10.1002/047084289X.re056.pub3.
- E.B. Womack, A.B. Nelson: Ethyl Diazoacetate In: Organic Syntheses. 24, 1944, S. 56, doi:10.15227/orgsyn.024.0056; Coll. Vol. 3, 1955, S. 392 (PDF).
- Patent US2490714: Preparation of diazoacetic esters. Angemeldet am 13. Mai 1947, veröffentlicht am 6. Dezember 1949, Anmelder: E.I. du Pont de Nemours & Co., Erfinder: N.E. Searle.
- R.N. Baumgarten: Preparation of ethyl diazoacetate via a triazene intermediate. In: J. Org. Chem. Band 32, Nr. 2, 1967, S. 484–485, doi:10.1021/jo01288a059.
- M.M.E. Delville, J.M.C. van Hest, F.P.J.T Rutjes: Ethyl diazoacetate synthesis in flow. In: Beilstein J. Org. Chem. Band 9, 2013, S. 1813–1818, doi:10.3762/bjoc.9.211.
- R.A. Maurya, K.-I. Min, D.-P. Kim: Continuous flow synthesis of toxic ethylacetate for utilization in an integrated microfluidic system. In: Green Chem. Band 16, Nr. 1, 2014, S. 116–120, doi:10.1039/C3GC41226A.
- Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur, Naturstoffe, Syntheseplanung, Nachhaltigkeit, 8. überarb. Auflage. Wiley-VCH, Weinheim 2021, ISBN 978-3-527-35022-3, S. 397.
- S.G. Rull, A. Olmos, P.J. Pérez: Gold-catalyzed ethylene cyclopropanation. In: Beilstein J. Org. Chem. Band 15, 2019, S. 67–71, doi:10.3762/bjoc.15.7.
- J.K. Blatchford, M. Orchin: The synthesis of some 2,3-diarylcyclopropane-1-carboxylic acids. In: J. Org. Chem. Band 29, Nr. 4, 1964, S. 839–843, doi:10.1021/jo01027a017.
- H. Staudinger, O. Muntwyler, L. Ruzicka, S. Seibt: Insektentötende Stoffe VII. Synthesen der Chrysanthemumsäure und anderer Trimethylen-carbonsäuren mit ungesättigter Seitenkette. In: Helv. Chim. Acta. Band 7, Nr. 1, 1924, S. 390–406, doi:10.1002/hlca.19240070147.
- J.A. Pincock, A.A. Moutsokapas: An optically active cyclopropene as a mechanistic probe in cyclopropane photochemistry. In: Can. J. Chem. Band 55, Nr. 6, 1977, S. 979–985, doi:10.1139/v77-137.
- E. Buchner, T. Curtius: Ueber die Einwirkung von Diazoessigäther auf aromatische Kohlenwasserstoffe. In: Ber. Dtsch. Chem. Ges. Band 18, Nr. 2, 1885, S. 2377–2379, doi:10.1002/cber.188501802119.
- C.R. Holmquist, E.J. Roskamp: A selective method for the direct conversion of aldehydes into β-keto esters with ethyl diazoacetate catalyzed by tin(II) chloride. In: J. Org. Chem. Band 54, Nr. 14, 1989, S. 3258–3260, doi:10.1021/jo00275a006.
- N.R. Candeias, R. Paterna, P.M.P. Gois: Homologation reaction of ketones with diazo compounds. In: Chem. Rev. Band 116, Nr. 5, 2016, S. 2937–2981, doi:10.1021/acs.chemrev.5b00381.
- Externe Identifikatoren von bzw. Datenbank-Links zu ethyl 2-methylacetoacetate: CAS-Nummer: 609-14-3, EG-Nummer: 210-179-9, ECHA-InfoCard: 100.009.255, PubChem: 701, ChemSpider: 21106586, Wikidata: Q27284827.
- W.T. Tai, E.W. Warnhoff: β-Ketoesters from reaction of ethyl diazoacetate with ketones. In: Can. J. Chem. Band 42, Nr. 6, 1964, S. 1333–1340, doi:10.1139/v64-205.
- P.R. Krishna, E.R. Sekhar: Lewis acid and/or Lewis base catalyzed [3+2] cycloaddition reaction: Synthesis of pyrazoles and pyrazolines. In: Tetrahedron Lett. Band 49, Nr. 48, 2008, S. 6733–6736, doi:10.1016/j.tetlet.2008.09.037.
- S. He, L. Chen, Y.-N. Niu, L.-Y. Wu, Y.-M. Liang: 1, 3-Dipolar cycloaddition of diazoacetate compounds to terminal alkynes promoted by Zn (OTf)2 an efficient way to the preparation of pyrazole. In: Tetrahedron Lett. Band 50, Nr. 20, 2009, S. 2443–2445, doi:10.1016/j.tetlet.2009.03.030.
- A. Gioiello, A. Khamidullina, M.C. Falcos, F. Veltroni, S. Zlotsky, R. Pellicciari: New one-pot synthesis of pyrazole-5-carboxylates by 1,3-dipole cycloadditions of ethyl diazoacetate with α-methylene carbonyl compounds. In: Tetrahedron Lett. Band 50, Nr. 44, 2009, S. 5978–5980, doi:10.1016/j.tetlet.2009.07.152.
- F. Shi, R.C. Larock: Synthesis of substituted indazoles via [3+2]cycloaddition of benzyne and diazo compounds In: Organic Syntheses. 87, 2010, S. 95, doi:10.15227/orgsyn.087.0095; Coll. Vol. 3, 1955, S. (PDF).


