Cycloheptatrien
Cycloheptatrien (veraltet: Tropiliden; abgeleitet von Tropan, welches selbst von Atropin abgeleitet ist) ist ein cyclischer ungesättigter Kohlenwasserstoff mit der Summenformel C7H8 und drei konjugierten Doppelbindungen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
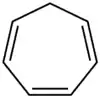 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cycloheptatrien | |||||||||||||||
| Andere Namen |
Tropiliden | |||||||||||||||
| Summenformel | C7H8 | |||||||||||||||
| Kurzbeschreibung |
Gelbe Flüssigkeit mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 92,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,95 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
117 °C[1] | |||||||||||||||
| Brechungsindex |
1,5211[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cycloheptatrien ist ein Strukturisomer von Toluol, in das es z. B. photochemisch umgewandelt werden kann.
Tropyliumkation
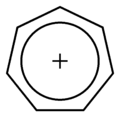
Durch Umsetzung von Cycloheptatrien mit Brom oder Hydridionen-Akzeptoren wie Triphenylcarbeniumtetrafluoroborat bildet sich unter Abspaltung eines Hydridions (H−) das aromatische Tropyliumkation (Cycloheptatrienylium, [C7H7]+):
Cycloheptatrien hat eine gewinkelte Struktur mit unterschiedlichen Bindungslängen zwischen den Kohlenstoffatomen, während das Tropyliumkation vollkommen planar mit identischen C-C-Abständen und gleichwertigen Wasserstoffatomen aufgebaut ist.[3] Dieses Kation wurde schon 1931 von Hückel vorausgesagt, aber erst 1954 von William von Eggers Doering und Lawrence H. Knox nachgewiesen.[4]
Unter Elektronenstoßbedingungen (im Massenspektrometer) lagern sich fast alle Benzylverbindungen vor der Fragmentierung unter Ringerweiterung um, so dass ein Tropyliumkation entsteht.[5]
Einzelnachweise
- Datenblatt Cycloheptatrien bei AlfaAesar, abgerufen am 26. Januar 2013 (PDF) (JavaScript erforderlich).
- Datenblatt Cycloheptatriene bei Sigma-Aldrich, abgerufen am 23. März 2011 (PDF).
- J.E. Huheey, E.A. Keiter, R.L. Keiter: Anorganische Chemie: Prinzipien von Struktur und Reaktivität, 2003, Walter de Gruyter, ISBN 3-11-017903-2.
- W. von E. Doering, L. H. Knox: The Cycloheptatrienylium (Tropylium) Ion. In: Journal of the American Chemical Society. 76, 1954, S. 3203–3206, doi:10.1021/ja01641a027.
- Autorenkollektiv: Analytikum, VEB Deutscher Verlag für Grundstoffindustrie Leipzig, 1971, S. 338.


