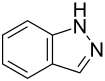
Indazol
Indazol ist ein aromatischer Heterocyclus und bildet das Grundgerüst weniger Naturstoffe (Nigellicin, Nigellidin und Nigeglanin aus Nigella sp.).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Indazol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H6N2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 118,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in heißen Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Derivate des Indazols kommen selten in der Natur vor. Nigellicin, Nigeglanin und Nigellidin sind Naturstoffe, die den Indazolring enthalten. Nigellicin ist ein Alkaloid aus Nigella sativa L. (Schwarzkümmel) und gehört zur Substanzklasse der mesomeren Betaine. Nigeglanin wurde aus Nigella glandulifera isoliert.
Darstellung
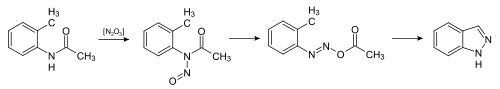
Die Herstellung der Indazole erfolgt beispielsweise über die Indazolsynthese nach Jacobson (siehe Schema unten).[3]
Verwendung
Indazol hat Bedeutung für die Herstellung bestimmter Farbstoffe. Derivate des Indazols sind auch in der Pharmakologie von Interesse, so wird das 1-Benzyl-3-(3-dimethylaminopropoxy)-1H-indazol (Benzydamin) wegen seiner lokalanästhetischen und entzündungshemmenden Wirkung bei schmerzhaften Entzündungen der Schleimhäute eingesetzt.[4]
Literatur
- Synthese (Vereinfacht, nach Jacobson): Synthesis, 1972, Issue 07, S. 375; doi:10.1055/s-1972-21885.
- Synthesemethoden: W. Stadlbauer, in Science of Synthesis 2002, 12, 227.
- Synthesemethoden: W. Stadlbauer, in Houben-Weyl, 1994, E8b, 764.
- Übersichtsartikel (Synthese, Eigenschaften, Biol. Aktivitäten etc.): A. Schmidt, A. Beutler, B. Snovydovych, Recent Advances in the Chemistry of Indazoles, Eur. J. Org. Chem. 2008, 4073–4095.
Einzelnachweise
- Datenblatt 1H-Indazole, 99% bei AlfaAesar, abgerufen am 7. Dezember 2019 (PDF) (JavaScript erforderlich).
- Datenblatt Indazol bei Acros, abgerufen am 24. Februar 2010.
- P. Jacobson, M. Huber: Über Bildung von Indazolkörpern aus orthomethylierten Anilinbasen. In: Chem. Ber. Band 41, Nr. 01, 1908, S. 660–671, doi:10.1002/cber.190804101127.
- Harry Auterhoff: Lehrbuch der pharmazeutischen Chemie, Wissenschaftliche Verlagsgesellschaft, Stuttgart 1968.