Buchner-Reaktion
Die Buchner-Reaktion ist eine Namensreaktion der organischen Chemie, bei der Ethyldiazoacetat mit Benzol oder seinen homologen Verbindungen thermisch oder photochemisch reagiert, um die entsprechenden isomeren Ester des Cycloheptatriens zu bilden. Diese Umsetzung wurde 1885 zuerst von den deutschen Chemikern Eduard Buchner (1860–1917) und Theodor Curtius (1857–1928) veröffentlicht und Jahrzehnte später von dem US-amerikanischen Chemiker William von Eggers Doering und seinen Mitarbeitern erweitert.[1][2]
Übersichtsreaktion
Bei der Buchner-Reaktion reagiert ein sechsgliedriger Aromat (z. B. Benzol) zu einem siebengliedrigen Ring (z. B. Cycloheptatrien).[1][3]
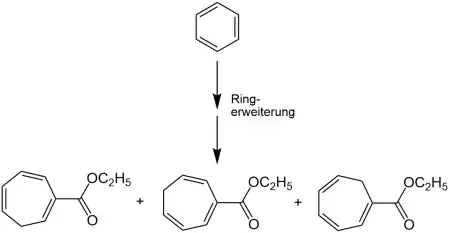
Reaktionsmechanismus
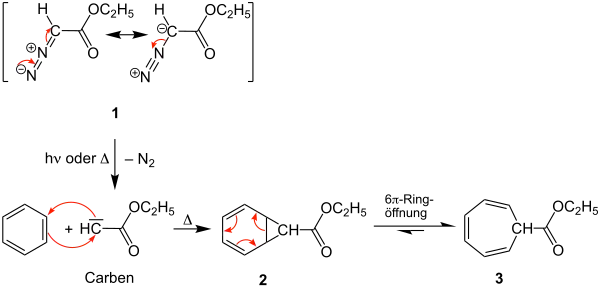
Im vorgeschlagenen Reaktionsmechanismus reagiert laut Buchner der Diazoessigester 1 unter Stickstoffabspaltung und Bildung eines Carbens mit Benzol zu dem Norcaradien 2.[2] William von Eggers Doering und seine Mitarbeiter konnten mit moderner NMR-Technik nachweisen, dass das Norcaradien 2 nur ein Zwischenprodukt der Synthese ist und in einer 6-Ringöffnung zum Cycloheptatrien 3 weiter reagiert. 2 und 3 liegen in einem dynamischen Gleichgewicht vor, wobei die Bildung des Cycloheptatriens 3 stark begünstigt ist.[3][4]
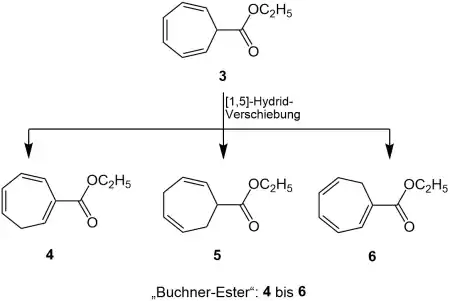
Dieses Cycloheptatrien 3 unterliegt einer [1,5]-Hydrid-Verschiebung, so dass die Isomere 4-6 des Cycloheptatriens gebildet werden. Die moderne NMR-Technik zeigt, dass das Produkt eine Mischung aus den Cycloheptatrienen 4 bis 6 ist, welche auch als „Buchner-Ester“ bezeichnet werden.[3][4]
Anwendung
Die Buchner-Reaktion lässt sich in einem Zwischenschritt der Synthese eines Medikaments namens Egualen Natrium finden, welches gegen Geschwüre wirkt. Bei dem Produkt handelt es sich um ein substituiertes Azulen.[5] Aber nicht nur die Synthese dieses Arzneistoffs bedient sich der Buchner-Reaktion. Auch das Diterpenoidtropon namens Harringtonolid und Fullerenderivate lassen sich für die medizinische Anwendung mittels der Buchner-Reaktion synthetisieren.[6][7]
Heterocyclensynthese
Die Ringerweiterung ist nicht auf die Synthese von Carbocyclen (X = CR2) beschränkt, sondern auf Heterocyclen (X = NR, O) übertragbar:
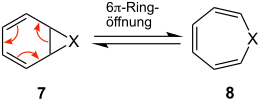
Die Lage des Gleichgewichts zwischen 7 und 8 hängt dabei von der Natur von X ab.[8]
Einzelnachweise
- László Kürti, Barbara Czakó: Strategic applications of named reactions in organic synthesis : background and detailed mechanisms. Elsevier Academic Press, Amsterdam 2005, ISBN 0-12-429785-4, S. 68–69.
- E. Buchner, Th. Curtius: Ueber die Einwirkung von Diazoessigäther auf aromatische Kohlenwasserstoffe. In: Berichte der deutschen chemischen Gesellschaft. Band 18, Nr. 2, 1885, S. 2377–2379, doi:10.1002/cber.188501802119.
- W. von E. Doering, G. Laber, R. Vonderwahl, N. F. Chamberlain, R. B. Williams: THE STRUCTURE OF THE BUCHNER ACIDS. In: Journal of the American Chemical Society. Band 78, Nr. 20, Oktober 1956, S. 5448, doi:10.1021/ja01601a080.
- Sarah E. Reisman, Roger R. Nani, Sergiy Levin: Buchner and Beyond: Arene Cyclopropanation as Applied to Natural Product Total Synthesis. In: Synlett. Band 2011, Nr. 17, Oktober 2011, S. 2437–2442, doi:10.1055/s-0031-1289520.
- John L. Kane, Kevin M. Shea, Aimee L. Crombie, Rick L. Danheiser: A Ring Expansion-Annulation Strategy for the Synthesis of Substituted Azulenes. Preparation and Suzuki Coupling Reactions of 1-Azulenyl Triflates. In: Organic Letters. Band 3, Nr. 7, 2001, S. 1081–1084, doi:10.1021/ol0156897.
- Roberto Pellicciari, Danilo Annibali, Gabriele Costantino, Maura Marinozzi, Benedetto Natalini: Dirhodium(II) Tetraacetate-Mediated Decomposition of Ethyldiazoacetate and Ethyldiazomalonate in the Presence of Fullerene. A New Procedure for the Selective Synthesis of [6-6]-Closed Methanofullerenes. In: Synlett. Band 1997, Nr. 10, Oktober 1997, S. 1196–1198, doi:10.1055/s-1997-980.
- Barbara Frey, Adam P. Wells, Daniel H. Rogers, Lewis N. Mander: Synthesis of the Unusual Diterpenoid Tropones Hainanolidol and Harringtonolide. In: Journal of the American Chemical Society. Band 120, Nr. 8, 1998, S. 1914–1915, doi:10.1021/ja9738081.
- Ulrich Lüning: Organische Reaktionen, 2. Auflage, Elsevier GmbH, München 2007, ISBN 978-3-8274-1834-0, S. 169.