2,5-Diaminohydrochinon-dihydrochlorid
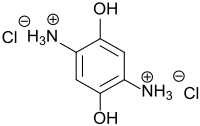
2,5-Diaminohydrochinon-dihydrochlorid DAHQ ist ein symmetrisches Dihydroxybenzol und Phenylendiamin mit beiden Hydroxy- und Aminogruppen jeweils in para-Stellung zueinander, das gewöhnlich als oxidationsstabileres Dihydrochlorid-Salz vorliegt. DAHQ ist Ausgangsstoff für organische Elektrodenmaterialien für wiederaufladbare Batterien,[4] für organische Halbleiter[5] und für MOFs.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,5-Diaminohydrochinon-dihydrochlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H10Cl2N2O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 213,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Mit Carbonsäuren reagiert DAHQ zu trans-Benzobisoxazolen und mit Dicarbonsäuren, wie z. B. Terephthalsäure bzw. Terephthalsäuredichlorid, zur (nicht-kommerziellen) trans-Form des Hochleistungskunststoffs Poly(p-phenylen-2,6-benzobisoxazol) PBO (trans-PBO).
Vorkommen und Darstellung
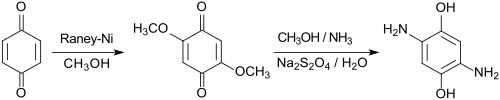
Der aus Hydrochinon bzw. 1,4-Benzochinon einfach zugängliche Ausgangsstoff 2,5-Dimethoxy-1,4-benzochinon DMBQ[7] wird in methanolischer Lösung unter Druck mit Ammoniak zum 2,5-Diamino-1,4-benzochinon umgesetzt und anschließend mit Zinn(II)-chlorid-Dihydrat SnCl2·2H2O in Gegenwart von Salzsäure zu 2,5-Diamino-1,4-benzoldiol-dihydrochlorid reduziert.[8]
1,4-Benzochinon kann auch mit Raney-Nickel in Methanol zu DMBQ umgesetzt werden,[9] das mit Ammoniak in Methanol zum 2,5-Diamino-1,4-benzochinon reagiert und auch mit Natriumdithionit in wässriger Lösung zu DAHQ reduziert werden kann.
Alternativ erfolgt die Umsetzung von Chloranil in 2-Methoxyethylacetat mit wässriger Ammoniumhydroxidlösung zur Zwischenstufe 2,5-Diamino-3,6-dichlor-1,4-benzochinon (95 % Ausbeute),[10] das in Wasser an einem heterogenen Palladium-Kontakt zum Endprodukt DAHQ-dihydrochlorid hydriert wird (Ausbeute > 85 %).[11][12]
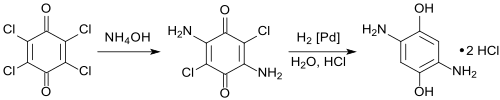
Bei der Überarbeitung der beiden Verfahrensschritte unter optimierten Prozessbedingungen wurden unlängst Ausbeuten von 84 % in der ersten und 95 % in der zweiten Stufe bei Reinheiten > 96 % gefunden.[13]
Eigenschaften
2,5-Diaminohydrochinon-dihydrochlorid fällt bei der Synthese als weißes bis braunes wasserlösliches Pulver an, das erst bei Temperaturen über 300 °C schmilzt. In seinen Eigenschaften ähnelt es sehr dem stellungsisomeren 4,6-Diaminoresorcin-dihydrochlorid DAR, das zudem als sehr oxidationsempfindlich beschrieben wird. Wie DAR kann auch DAHQ aus heißer verdünnter Salzsäure unter Zugabe von Aktivkohle und dem Reduktionsmittel Zinn(II)-chlorid als Oxidationsinhibitor zu farblosen Nadeln[14] umkristallisiert werden.
Anwendungen
In vielen Anwendungen ist die Reinheit der oxidationsempfindlichen Diaminodihydroxybenzole wie 2,5-Diaminohydrochinon kritisch. Quantitative Carbonylierung unter Ringschluss zu Oxazolonen erzeugt stabile, geschützte Zwischenstufen, aus denen das entsprechende Diaminodihydroxybenzol mit konzentrierter Salzsäure vollständig zurückerhalten werden kann.[15]
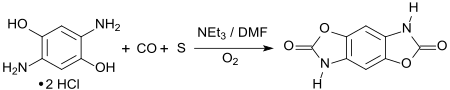
DAHQ als Baustein für leitfähige Materialien
Beim Auflösen von 2,5-Diaminohydrochinon-dihydrochlorid in Wasser, Zugabe der Base Triethylamin und Rühren an der Luft entsteht rasch ein dunkelvioletter Niederschlag des Oxidationsprodukts 2,5-Diamino-1,4-benzochinon DABQ, das als Elektrodenmaterial für organische Lithiumbatterien untersucht wird.[4]
Elektrisch leitende metallorganische Netzwerke MOFs sind in praktisch quantitativer Ausbeute aus 2,5-Dihydroxy-1,4-benzochinon DHBQ – aus 2,5-Diaminohydrochinon über sein Oxidationsprodukt DABQ und dessen Hydrolyse
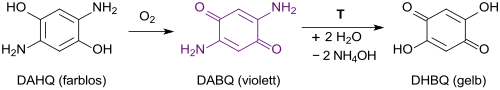
– und Tetrabutylammoniumbromid TBAB, NBu4Br und Nickel(II)-acetat Ni(OAc)2 zugänglich.[6]
Mit Thiophen-2-carbaldehyd und Sauerstoff mit 4-Methoxy-TEMPO als Oxidationskatalysator wird ein bis-thiophensubstituiertes Benzobisoxazol gebildet, das als Modellsubstanz mit ausgedehnterem konjugiertem π-Elektronensystem für organische Elektrolumineszenzmaterialien charakterisiert wurde.[16]
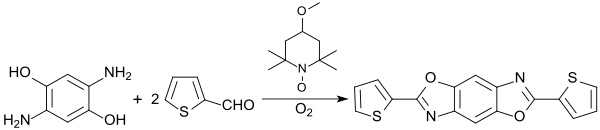
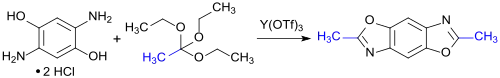
Ein ähnlicher Ansatz – Kondensation von 2,5-Diaminohydrochinon-dihydrochlorid mit Orthoestern, wie z. B. Orthoessigsäuretriethylester (R=CH3), in Gegenwart der Lewis-Säure Yttriumtriflat – wird bei der Synthese niedermolekularer linearer kondensierter Benzobisoxazol-Ringsysteme verfolgt, die wegen ihrer guten Elektronentransporteigenschaften (n-Typ) auf ihre Eignung als organische Halbleiter untersucht wurden.[5]
DAHQ als Monomer für trans-PBO
Wie das stellungsisomere 4,6-Diaminoresorcin-dihydrochlorid lässt sich 2,5-Diaminohydrochinon-dihydrochlorid mit aromatischen Dicarbonsäuren, vorzugsweise Terephthalsäure oder dem Carbonsäurechlorid Terephthalolychlorid zu trans-Poly(p-phenylen-2,6-benzobisoxazol) trans-PBO polykondensieren,

das allerdings wesentlich weniger intensiv bearbeitet und in der Literatur beschrieben wurde. Haupteinsatzgebiet für das Polymer PBO waren ursprünglich Fasern für Gewebe in ballistischen Schutzwesten. Das theoretische E-Modul für Fasern aus trans-PBO wird mit 707 GPa angegeben, nur wenig weniger als der extrem hohe Wert für cis-PBO-Fasern (730 GPa), aber deutlich höher als für die Hochleistungskunststoffe trans-Polybenzimidazol PBI mit 640 oder UHMWPE (ultrahochmolekulares Polyethylen) mit 362 GPa.[17] Aus jüngster Zeit gibt es anekdotische Hinweise auf eine höhere Linearität, sowie bessere mechanische Eigenschaften und photoelektrisches Verhalten von trans-PBO-Fasern im Vergleich zum cis-Pendant.[13]
Nach Befunden des NIST[18] nimmt die Reißfestigkeit von Schutzwesten aus PBO-Fasern bei Gebrauch unter dem Einfluss von Feuchtigkeit und Temperatur um 30 % ab, was zur Dezertifizierung von PBO-Fasern in Schutzwesten und zum rasch nachlassenden Interesse an PBO als Forschungsobjekt führte.
Einzelnachweise
- Datenblatt 2,5-Diamino-1,4-dihydroxybenzenedihydrochloride bei AlfaAesar, abgerufen am 25. Juni 2020 (PDF) (JavaScript erforderlich).
- Datenblatt 2,5-Diamino-hydrochinon-dihydrochloride bei Sigma-Aldrich, abgerufen am 25. Juni 2020 (PDF).
- Safety Data Sheet: 2,5-Diaminohydroquinone Dihydrochloride. Fujifilm, 20. September 2019, abgerufen am 28. Juni 2020.
- L. Sieuw, A.Jouhara, E. Quarez, C. Auger, J.-F. Gohy, P. Poizot, A. Vlad: A H-bond stabilized quinone electrode material for Li-organic batteries: the strength of weak bonds. In: Chem. Sci. Band 10, 2019, S. 418–426, doi:10.1039/c8sc02995d.
- J.F. Mike, A.J. Makowski, M. Jeffries-EL: An efficient synthesis of 2,6-disubstituted benzobisoxazoles: New building blocks for organic semiconductors. In: Org. Lett. Band 10, Nr. 21, 2008, S. 4915–4918, doi:10.1021/ol802011y.
- K.V. Nielsen, L. Zhang, Q. Zhang, T.L. Liu: A strategic high yield synthesis of 2,5-dihydroxy-1,4-benzoquinone based MOFs. In: Inorg. Chem. Band 58, Nr. 16, 2019, S. 10756–10760, doi:10.1021/acs.inorgchem.9b00903.
- Patent US2743286: Process for preparing alkoxyquinone compounds. Angemeldet am 12. März 1952, veröffentlicht am 24. April 1956, Anmelder: Eastman Kodak Co., Erfinder: G.F. Rodgers.
- Patent JP2007070300A: Process for producing 2,5-diamino-1,4-benzoquinone and 2,5-diamino-1,4-benzenediol, and salt thereof. Angemeldet am 8. September 2005, veröffentlicht am 22. März 2007, Anmelder: Teijin Ltd., Erfinder: M. Jokai, H. Kuwabara.
- V.K. Ahluwalia, P. Bhagat, R. Aggarwal, R. Chandra: Intermediates for Organic Synthesis. I.K. International Publishing House Pvt. Ltd., New Delhi 2005, ISBN 978-81-88237-33-3, S. 23.
- Patent US4806688: Method for producing 3,6-bis(carboethoxyamino)-2,5-diaziridinyl-1,4-benzoquinone. Angemeldet am 29. August 1980, veröffentlicht am 29. Juni 1982, Anmelder: United States of America, Erfinder: S.J. Backlund, R.E. Olsen.
- Patent WO198706930: Preparation of diamino-and dialkylaminobenzenediols. Angemeldet am 12. Mai 1987, veröffentlicht am 19. November 1987, Anmelder: The Dow Chemical Co., Erfinder: M.N. Inbasekaran, R.M. Strom.
- M. Inbasekaran, R. Strom: A convenient synthesis of 2,5-diamino-1,4-benzene diol. In: OPPI Briefs. Band 23, Nr. 4, 1991, S. 447–450, doi:10.1080/00304949109458235.
- B. Dong, J. Zhang, C. Wu, N. Jin, D. Zhao: Synthesis of trans-PBO AA type monomer 2,5-diamino-hydroquinone hydrochloride. In: Chemical Industry and Engineering Progress. Band 6, 2019 (com.cn).
- Patent US5892116: Process for producing 4,6-diaminoresorcinols. Angemeldet am 8. Oktober 1997, veröffentlicht am 6. April 1999, Anmelder: Daiwa Kasei Industry Co., Ltd., Erfinder: J. Kawachi, H. Matsubara, Y. Nakahara, Y. Watanabe.
- T. Mizuno, T. Nakai, M. Mihara, T. Ito: Facile sulfur-assisted carbonylation of diaminoresorcinol with carbon monoxide. In: Heteroatom Chem. Band 23, Nr. 1, 2012, S. 111–116, doi:10.1002/hc.20746.
- L.-Q. Chai, Y.-L. Zhang, J.-F. Tong, G. Liu: Synthesis, Crystal Structure and Fluorescence Behavior of 2,6-Di(thiophen-2-yl)-benzo[1,2-d:4,5-d’]bisoxazole. In: Z. Naturforsch. 68b, 2013, S. 239–244, doi:10.5560/ZNB.2013-2301.
- X.-S. Yi, S. Du, L. Zhang (Hrsg.): Composite Materials Engineering, Volume 1: Fundamentals of Composite Materials. Chemical Industry Press, Beijing 2006, ISBN 978-981-10-5695-6, S. 116.
- J. Chin, A. Forster, C. Clerici, L. Sung, M. Oudina, K. Rice: Temperature and humidity aging of poly(p-phenylene-2,6-benzobisoxazole) fibers: Chemical and physical characterization. In: Polym. Degrad. Stabil. Band 92, 2007, S. 1234–1246, doi:10.1016/j.polymdegradstab.2007.03.030.
