Nickel(II)-acetat
Nickel(II)-acetat ist das Nickelsalz der Essigsäure und gehört zur Gruppe der Acetate mit der Konstitutionsformel Ni(CH3COO)2.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
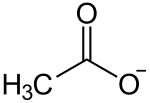 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nickel(II)-acetat | ||||||||||||||||||
| Andere Namen |
Nickelacetat | ||||||||||||||||||
| Summenformel | C4H6NiO4 | ||||||||||||||||||
| Kurzbeschreibung |
grünliche Kristalle mit schwachem charakteristischen Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse |
| ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,768 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
Zersetzung[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Nickel(II)-acetat kann durch Reaktion von Nickel(II)-carbonat mit Essigsäure hergestellt werden.[5]
Eigenschaften
Nickel(II)-acetat tritt üblicherweise als Tetrahydrat auf. Der Kristallwassergehalt wurde erstmals 1878 von H. Stallo bestimmt.[5] Nickel(II)-acetat-Tetrahydrat kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/c (Raumgruppen-Nr. 14) mit den Gitterparametern a = 476,4 pm, b = 1177,1 pm, c = 842,5 pm und β = 93,6°. In der Elementarzelle befinden sich zwei Formeleinheiten.[6][7]
Nickel(II)-acetat-Tetrahydrat beginnt bei ca. 80 °C sein Kristallwasser abzugeben.[8][9] Beim weiteren Erhitzen entsteht ein wasserfreies basisches Nickel(II)-acetat mit der stöchiometrischen Zusammensetzung 0,86 Ni(CH3COO)2·0,14 Ni(OH)2.[10] Die Zersetzung beginnt bei 250 °C, als Zwischenprodukte entstehen Nickelcarbid[9][10] und Nickel(II)-carbonat.[11] Die Endprodukte der Zersetzung sind Nickel(II)-oxid und elementares Nickel.[8][11]
Verwendung
Nickel(II)-acetat wird zum Beizen von Textilien und für Beschichtungen beim Eloxieren („Sealsalz“) eingesetzt.[2]
Sicherheit
Nickel(II)-acetat ist als krebserzeugend eingestuft.[1]
Einzelnachweise
- Datenblatt Nickel(II)-acetat bei AlfaAesar, abgerufen am 25. Februar 2011 (PDF) (JavaScript erforderlich).
- Eintrag bei Nickel acetate bei chemicalland21.com
- Eintrag zu Nickel(II)-acetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Januar 2020. (JavaScript erforderlich)
- Eintrag zu Nickel di(acetate) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- F. W. Clarke: „Einige Bestimmungen specifischer Gewichte“, in: Berichte der Deutschen Chemischen Gesellschaft, 1878, 11 (2), S. 1504–1507; doi:10.1002/cber.18780110261; Volltext bei gallica.
- T. C. Downie, W. Harrison, E. S. Raper, M. A. Hepworth: „A Three-Dimensional Study of the Crystal Structure of Nickel Acetate Tetrahydrate“, in: Acta Crystallographica, 1971, B27, S. 706–712; doi:10.1107/S0567740871002802.
- J. N. Van Niekerk, F. R. L. Schoening: „The crystal structures of nickel acetate, Ni(CH3COO)2·4H2O, and cobalt acetate, Co(CH3COO)2·4H2O“, in: Acta Crystallographica, 1953, 6 (7), S. 609–612; doi:10.1107/S0365110X5300171X.
- M. A. Mohamed, S. A. Halawy, M. M. Ebrahim: „Non-isothermal decomposition of nickel acetate tetrahydrate“, in: Journal of Analytical and Applied Pyrolysis, 1993, 27 (2), S. 109–110. doi:10.1016/0165-2370(93)80002-H.
- M. A. A. Elmasry, A. Gaber, E. M. H. Khater: „Thermal decomposition of Ni(II) and Fe(III) acetates and their mixture“, in: Journal of Thermal Analysis and Calorimetry, 1996, 47, S. 757–763; doi:10.1007/BF01981811.
- J. C. De Jesus, I. Gonzalez, A. Quevedo, T. Puerta: „Thermal decomposition of nickel acetate tetrahydrate: an integrated study by TGA, QMS and XPS techniques“, in: Journal of Molecular Catalysis A: Chemical, 2005, 228 (1–2), S. 283–291; doi:10.1016/j.molcata.2004.09.065.
- G. A. M. Hussein, A. K. H. Nohman, K. M. A. Attyia: „Characterization of the decomposition course of nickel acetate tetrahydrate in air“, in: Journal of Thermal Analysis and Calorimetry, 1994, 42, S. 1155–1165; doi:10.1007/BF02546925.


