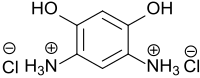
4,6-Diaminoresorcin-dihydrochlorid
4,6-Diaminoresorcin-dihydrochlorid DAR ist ein symmetrisches Dihydroxybenzol und Phenylendiamin, das gewöhnlich als oxidationsstabileres Dihydrochlorid-Salz vorliegt. Mit Terephthalsäure bzw. Terephthalsäuredichlorid kann 4,6-Diaminoresorcin-dihydrochlorid zum Hochleistungskunststoff Poly(p-phenylen-2,6-benzobisoxazol) PBO polymerisiert werden. Intensive Forschungsarbeiten an Hochleistungskunststoffen in den 1970er- und 1980er-Jahren forcierten auch die Suche nach leicht verfügbaren und preisgünstigen, sowie sicher und nachhaltig zugänglichen Monomeren wie DAR.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4,6-Diaminoresorcin-dihydrochlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H10Cl2N2O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 213,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Als Ausgangsstoff für 4,6-Diaminoresorcin-dihydrochlorid diente zunächst Resorcindiacetat (1,3-Diacetoxybenzol), das im ersten Syntheseschritt der Nitrierung neben dem gewünschten 4,6-Dinitroresorcin das explosionsgefährliche 2,4,6-Trinitroresorcin (Styphninsäure) liefert, das durch mehrmaliges Umkristallisieren vollständig aus dem Zielprodukt entfernt werden muss.[3]
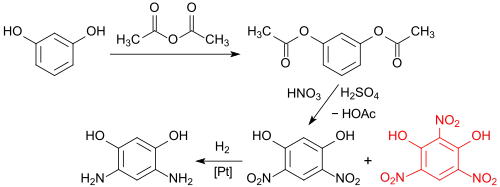
Wegen des gefährlichen Nebenprodukts Styphninsäure und der aufwendigen Reinigung bereits auf der ersten Stufe wurde das u. a. als Herbizid verwendete 1,2,3-Trichlorbenzol als günstigeres Startmaterial identifiziert, bei dem die 2-Stellung durch ein Chloratom besetzt ist und daher nicht nitriert werden kann.[4]
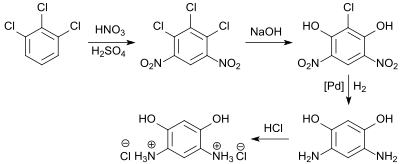
Nachteilig bei dieser Syntheseroute ist das Arbeiten in relativ hoher Verdünnung wegen geringer Löslichkeit der Komponenten in den Reaktionsmedien, die Hydrierung in Hastelloy-Reaktoren und besonders die inzwischen schlechte Verfügbarkeit der Startverbindung 1,2,3-Trichlorbenzol als PBT-Stoff. Als – allerdings fragwürdiger – Alternativrohstoff wurde daher z. B. das giftige und stark allergene 2,4-Dinitrochlorbenzol und die Einführung der meta-ständigen Sauerstofffunktionen mit dem ebenfalls bedenklichen Cumolhydroperoxid vorgeschlagen.[5]
Infolge der zunehmend problematischen Verfügbarkeit und hohen Kosten geeigneter Rohstoffe wurden Synthesen u. a. mit dem heutzutage billigeren Resorcin als Rohstoffbasis erneut aufgegriffen, die zudem Halogenide, Nitrogruppen und Sulfonsäuregruppen in den Zwischenstufen und damit unnötige Salzfrachten vermeiden. So beschreibt ein Patent[6] die Acetylierung von Resorcin mit Acetanhydrid zum 1,3-Diacetoxybenzol (Schritt A), das in einer Fries-Umlagerung in 4,6-Diacetylresorcin überführt (Schritt B) und anschließend mit Hydroxylaminhydrochlorid zum Dioxim umgesetzt wird (Schritt C).
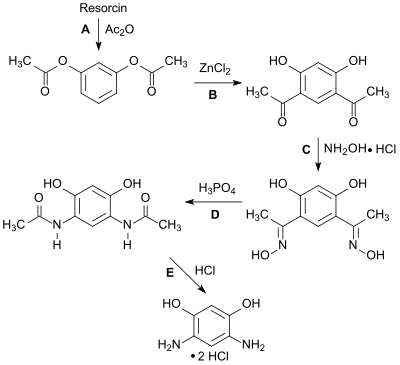
Durch Beckmann-Umlagerung entsteht aus dem Dioxim das entsprechende Diamid (Schritt D), das mit Salzsäure zum Endprodukt 4,6-Diaminoresorcin-dihydrochlorid (Schritt E) hydrolysiert wird. Die Schritte A und B, sowie D und E lassen sich auch ohne Isolierung des jeweiligen Zwischenprodukts als Eintopfreaktionen durchführen. Die Gesamtausbeute beträgt ca. 55 % und sollte diesen Syntheseweg angesichts preisgünstiger Einsatzstoffe und einfacher Prozessführung begünstigen. Acylierung und Fries-Verschiebung der Schritte A und B lassen sich unter Vermeidung von Friedel-Crafts-Acylierungskatalysatoren, wie z. B. AlCl3, ZnCl2 oder FeCl3, und Acetanhydrid mit Essigsäure / Methansulfonsäure und Phosphorpentoxid als wasserbindendes Medium mit Ausbeuten bis 90 % als „grüne“ Reaktion durchführen.[7]
Eigenschaften
4,6-Diaminoresorcin-dihydrochlorid fällt bei der Synthese als weißes bis braunes wasserlösliches und oxidationsempfindliches Pulver an. Aus heißer verdünnter Salzsäure kann es unter Zugabe von Aktivkohle und dem Reduktionsmittel Zinn(II)-chlorid als Oxidationsinhibitor zu weißen Nadeln umkristallisiert werden, die unter Stickstoff aufbewahrt werden sollten.[4] Die dem Salz zugrundeliegende Base 4,6-Diaminoresorcin ist sehr oxidationsempfindlich und verfärbt sich rasch an der Luft, kann aber durch Zugabe von 2,000 ppm SnCl2 über mehrere Wochen stabilisiert werden.
Anwendungen
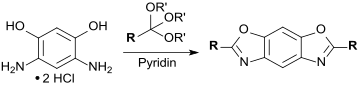
Durch Kondensation von 4,6-Diaminoresorcin-dihydrochlorid mit Orthoestern, wie z. B. Orthoessigsäuretrimethylester (R=R'=CH3), sind niedermolekulare linear kondensierte Benzobisoxazol-Ringsysteme zugänglich, die auf ihre Eignung als organische Halbleiter untersucht wurden.[8]
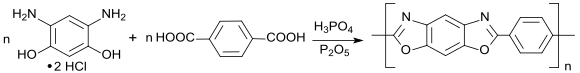
Hauptanwendung von 4,6-Diaminoresorcin-dihydrochlorid ist als Monomer in der Polykondensation mit Terephthalsäure oder Terephthalsäuredichlorid in Polyphosphorsäure zu Poly(p-phenylen-2,6-benzobisoxazol) PBO.
PBO bildet bei Raumtemperatur in Chlorsulfonsäure oder Methansulfonsäure lyotrope nematische Flüssigkristallphasen. Aus solchen anisotropen Lösungen (engl. dope) lassen sich Folien und Filamente extrudieren, die außergewöhnliche Temperaturbeständigkeit und Zugfestigkeit aufweisen.[9]
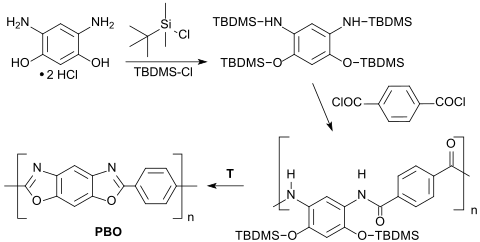
Silylierung von DAR mit dem Schutzgruppenreagenz tert-Butyldimethylsilylchlorid TBS-Cl und Umsetzung mit Terephthalsäuredichlorid liefert ein silyliertes Präpolymer, das im Gegensatz zu PBO in aprotisch dipolaren Lösungsmitteln, wie z. B. NMP, DMAc oder DMSO löslich ist und aus Lösung sich zu transparenten Folien gießen lässt. Beim Erhitzen auf 500 °C gehen sie in PBO-Folien über, die sich unter Stickstoff erst bei Temperaturen > 670 °C zersetzen.[10]
Das Polymer PBO wurde am SRI in Menlo Park entwickelt und von Dow Chemical in den industriellen Maßstab übertragen. Inzwischen wird PBO von dem japanischen Chemieunternehmen Toyobo als Zylon®-Fasern vermarktet.
Einzelnachweise
- Eintrag zu 4,6-Diaminoresorcinol dihydrochloride bei TCI Europe, abgerufen am 2. Juni 2020.
- Datenblatt 4,6-Diaminoresorcinol dihydrochloride bei Sigma-Aldrich, abgerufen am 2. Juni 2020 (PDF).
- J.F. Wolfe, B.H. Loo, F.E. Arnold: Rigid-rod polymers. 2. Synthesis and thermal properties of para-aromatic polymers with 2,6-benzobisthiazole units in the main chain. In: Macromolecules. Band 14, Nr. 4, 1981, S. 915–920, doi:10.1021/ma5000a005.
- Patent US4766244: High purity process for the preparation of 4,6-diamino-1,3-benzenediol. Angemeldet am 30. Oktober 1986, veröffentlicht am 23. August 1988, Anmelder: The Dow Chemical Company, Erfinder: Z. Lysenko.
- R.G. Pews, Z. Lysenko, P.C. Vosejpka: A safe cost-efficient synthesis of 4,6-diaminoresorcinol. In: J. Org. Chem. Band 62, Nr. 23, 1997, S. 8255–8256, doi:10.1021/jo961675g.
- Patent US5892116: Process for producing 4,6-diaminoresorcinols. Angemeldet am 8. Oktober 1997, veröffentlicht am 6. April 1999, Anmelder: Daiwa Kasei Industry Co., Ltd., Erfinder: J. Kawachi, H. Matsubara, Y. Nakahara, Y. Watanabe.
- F. Chen, Y. Gao, Y. Xu: Metal free Friedel-Crafts di-acetylation of resorcinol in acetic acid. In: Asian J. Chem. Band 29, Nr. 4, 2017, S. 749–754, doi:10.14233/ajchem.2017.20224.
- J.F. Mike, A.J. Makowski, M. Jeffries-EL: An efficient synthesis of 2,6-disubstituted benzobisoxazoles: New building blocks for organic semiconductors. In: Org. Lett. Band 10, Nr. 21, 2008, S. 4915–4918, doi:10.1021/ol802011y.
- Raj B. Durairaj: Resorcinol: Chemistry, Technology, Applications. Springer, Berlin 2005, ISBN 978-3-540-25142-2, S. 395–408.
- T. Fukumaru, T. Fujigaya, N. Nakashima: Extremely High Thermal Resistive Poly(p-phenylene benzobisoxazole) with Desired Shape and Form from a Newly Synthesized Soluble Precursor. In: Macromolecules. Band 45, Nr. 10, 2012, S. 4247–4253, doi:10.1021/ma3006526.

