2,4-Dinitrophenol
2,4-Dinitrophenol (kurz: DNP) ist ein gelber kristalliner Feststoff mit phenolartigem Geruch. Die Struktur besteht aus einem Benzolring mit einer Hydroxygruppe (–OH) und zwei Nitrogruppen (–NO2) als Substituenten. Es gehört zur Stoffgruppe der Dinitrophenole, einer Gruppe von sechs Konstitutionsisomeren. Es fand schon 1919 seine erste Anwendung. Damals wurde es in Frankreich zur Herstellung von Munition verwendet. 40 % DNP und 60 % TNT ergaben eine explosive Mischung für Artilleriegranaten. Bevor die Toxizität von DNP erkannt wurde, fand es in den 1930er-Jahren große Verwendung als Mittel gegen Fettleibigkeit.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
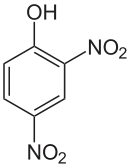 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2,4-Dinitrophenol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H4N2O5 | |||||||||||||||||||||
| Kurzbeschreibung |
gelbes kristallines Pulver mit phenolartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 184,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte |
1,683 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
4,09[2] | |||||||||||||||||||||
| Löslichkeit |
schwer in Wasser (6 g·l−1)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Darstellung
2,4-Dinitrophenol entsteht aus o- und p-Nitrophenol durch erneute Nitrierung. Es ist ein Zwischenprodukt auf dem Weg zur Pikrinsäure.
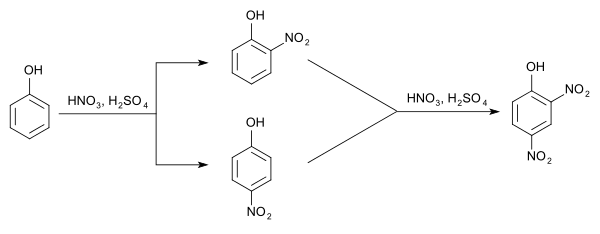
In der Atmosphäre kann 2,4-Dinitrophenol durch Reaktion von Nitratradikalen mit Phenol oder anderen Aromaten entstehen.[4]
Eigenschaften

Physikalische Eigenschaften
2,4-Dinitrophenol ist ein gelbes kristallines Pulver mit phenolartigem Geruch.[1] Es kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe P212121 (Raumgruppen-Nr. 19) mit den Gitterparametern a = 610,6 pm, b = 2324 pm und c = 516,8 pm. In der Elementarzelle befinden sich vier Formeleinheiten.[5]
Chemische Eigenschaften
Der schwach saure Charakter des Phenols ist durch die Mesomeriestabilisierung des Phenolat-Ions zu begründen. Die beiden Nitrogruppen wirken aufgrund des −M-Effekts elektronenziehend; die phenolische OH-Bindung wird zunehmend polarisiert. Es weist daher eine höhere Acidität im Vergleich zum Phenol auf. Der pKs-Wert von 4,09 ist daher entsprechend niedriger (Phenol: 9,99[2]).
In der Atmosphäre reagiert 2,4-Dinitrophenol rasch mit photochemisch entstandenen Hydroxylradikalen.[4] Auch während der Nacht ist es unbeständig, da es von Nitratradikalen oxidiert wird. 2,4-Dinitrophenol wird wahrscheinlich unter aeroben Bedingungen im Wasser abgebaut, ohne Sauerstoff beginnt der Abbau an der Nitrogruppe.
Reaktionen
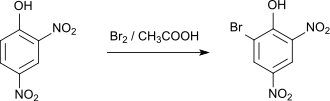
Die Bromierung von 2,4-Dinitrophenol mit elementarem Brom in Eisessig führt zum 2-Brom-4,6-dinitrophenol, das einen Schmelzpunkt von 118–119 °C hat.[6] Durch direkte Iodierung mit elementarem Iod und Quecksilber(II)-oxid entsteht 2-Iod-4,6-dinitrophenol.[7] Chlorierung mit Natriumhypochlorit liefert 2-Chlor-4,6-dinitrophenol.[8]
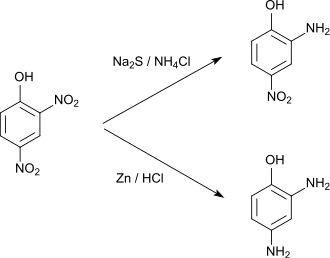
2,4-Dinitrophenol kann mit Natriumsulfid[9] oder Ammoniumsulfid[10] partiell zu 2-Amino-4-nitrophenol reduziert werden. Die vollständige Reduktion zu 2,4-Diaminophenol kann z. B. mit Zinn, Zink oder Eisen und Salzsäure oder mit elementarem Wasserstoff an Nickel-Katalysator[11] durchgeführt werden.
Biologische Wirkungen
Wirkungsmechanismus
2,4-Dinitrophenol (DNP) ist ein Protonenionophor (Protonentransporter), der als Entkoppler der oxidativen Phosphorylierung in den Mitochondrien der Zelle wirkt.
Dort nämlich mündet die Verwertung von Kohlenhydraten und Fettsäuren in der sogenannten Atmungskette, die ein chemiosmotisches Potential zwischen dem Intermembranraum und der mitochondrialen Matrix und damit u. a. einen Protonengradienten zwischen diesen beiden Räumen aufbaut, der normalerweise zur Gewinnung von Energie in Form von ATP genutzt wird.
„Entkoppler“ der oxidativen Phosphorylierung wie das DNP dagegen bauen diesen Gradienten wieder ab, indem sie Protonen aus dem Intermembranraum aufnehmen, mit diesen durch die innere mitochondriale Membran in die Matrix diffundieren und die Protonen dort wieder abgeben.
Im Fall des DNPs wandert dieses anschließend mesomeriestabilisiert wieder zurück in den Intermembranraum, wo der Zyklus von neuem beginnt, die Energie dagegen, die in dem Protonengradienten gespeichert war, geht dabei als Wärme verloren. Um den Gradienten zum Betreiben der ATP-Synthese aufrechtzuerhalten bzw. wieder aufzubauen, muss die Zelle folglich ihren Stoffwechselumsatz erhöhen und beispielsweise vermehrt Fettsäuren und/oder Kohlenhydrate metabolisieren, womit die physiologische Wirkung von DNP also im Endeffekt auf nichts anderem als einer Intensivierung des Fett- und Kohlenhydrat-Stoffwechsels beruht.
Von besonderer physiologischer Bedeutung ist die beschriebene Entkopplung der oxidativen Phosphorylierung auch im braunen Fettgewebe von Neugeborenen, wo sie – dort allerdings durch Thermogenin, ein körpereigenes Ionenkanal-Protein der inneren Mitochondrienmembran – ebenfalls eine zitterfreie Wärmebildung ermöglicht.
Toxische Wirkungen
Unerwünschte Wirkungen des DNPs äußern sich in Blutdruckabfall, Herzrasen (Tachykardie), Herzrhythmusstörungen, plötzlicher Herztod, Luftnot (Dyspnoe), Aspirationspneumonie, Lungenödem, Kopfschmerzen, Unruhe, Hirnödeme, Koma, Überhitzung (Hyperthermie), Dehydration, metabolische Azidose, Zerstörung der quergestreiften Muskulatur (Rhabdomyolyse), Schilddrüsenfehlfunktion, erhöhter Blutzuckerspiegel, Bauchschmerzen, Brechreiz, Erbrechen, Zyanose, gesteigerter Zerfall der roten Blutkörperchen (hämolytische Anämie), Veränderung des Blutfarbstoffes mit Störung des Sauerstofftransports (Methämoglobinämie), Zerstörung der weißen Blutkörperchen (Agranulozytose → Kostmann-Syndrom), gelbliche Hautfärbung, Brennen der Haut, Grauer Star, Niereninsuffizienz, Nierenversagen, Leberstörungen, Leberversagen und letztendlich Multiorganversagen im fortgeschrittenen Stadium einer DNP-Vergiftung.
Ob 2,4-Dinitrophenol krebserregend (karzinogen) ist, bleibt unklar. Bei einer früheren Studie mit Mäusen zeigte DNP keinen Effekt auf das Wachstum von induziertem Hautkrebs.[12] Eine mögliche erbgutändernde (mutagene) Eigenschaft 2,4-Dinitrophenols wurde an Bakterien mit Hilfe des Ames-Tests untersucht. Es zeigt sich, dass DNP keine mutagene Wirkung hatte.[13] Eine fruchtschädigende (teratogene) Wirkung einer DNP-ähnlichen Verbindung, Dinoseb, ist im Tierversuch gezeigt worden.[14]
In aktuellen medizinischen Studien wird die letale Dosis von 2,4-Dinitrophenol mit 1 bis 3 Gramm angegeben.[15] Diese Angabe bezieht sich jedoch auf eine Einmaldosis, und die Pharmakokinetik von DNP ist nicht genau bekannt. Die Halbwertszeit scheint aber lange genug zu sein, so dass eine Kumulierung stattfinden kann. Eine Studie beschreibt z. B. einen Fall, bei dem ein Bodybuilder 4 Tage lang DNP mit jeweils 600 mg/Tag eingenommen hatte und dann einen Tag später gestorben ist.[16] Wahrscheinlich lassen sich die meisten DNP-Todesfälle darauf zurückführen, dass der Kumulierungseffekt nicht beachtet worden ist. Der menschliche Organismus reagiert individuell verschieden, es ist daher durchaus möglich die persönliche letale Dosis (1 Gramm) über mehrere Tage hinweg zu akkumulieren und so die Schwelle einer letale Dosis zu überschreiten, auch wenn pro Tag deutlich weniger eingenommen worden ist. Der jüngste dokumentierte Todesfall in Deutschland ist eine 19-jährige Schülerin, die im August 2006 nach der einmaligen Einnahme von DNP im Agnes-Karll-Krankenhaus Laatzen verstarb.[17]
Bisher wurde kein wirksames Gegenmittel entdeckt, bei DNP-Vergiftungen können nur die Symptome unterstützend behandelt werden. Es ist jedoch ein Fall bekannt, bei dem ein Patient mit einer durch DNP hervorgerufene Hyperthermie durch wiederholte Verabreichung von Dantrolen erfolgreich behandelt werden konnte.[18] Dantrolen wird als Mittel gegen Maligne Hyperthermie eingesetzt. Möglicherweise konnte die rasche Verabreichung dem Patienten das Leben retten.[19]
Verwendung
Illegale gesundheitsbezogene Verwendung
Aus der Beobachtung an französischen Arbeitern in Sprengstofffabriken während des Ersten Weltkrieges, die beruflich in Kontakt mit 2,4-Dinitrophenol kamen und die neben erheblichen Beschwerden (Schwindelanfällen, Schweißausbrüchen und Kopfschmerzen) dabei an Körpergewicht verloren, entstand die Hypothese, dass Übergewicht durch Einnahme von 2,4-Dinitrophenol zu behandeln sei.[20] Dies wurde besonders durch die ersten Studienergebnisse unter dem Pharmakologen Maurice L. Tainter bekannt gemacht. Nach kurzen Anlaufschwierigkeiten avancierte 2,4-Dinitrophenol in den 1930er-Jahren in den USA zu einem Medikament gegen Fettleibigkeit. Der Grund für diese Popularität lag darin, dass tägliche Dosen von 3 bis 5 mg 2,4-Dinitrophenol pro kg Körpergewicht den Grundumsatz bei einem gesunden Menschen um bis 50 % steigen lässt.[21] Im Gegensatz zu Schilddrüsenhormonen greifen Dinitroverbindungen das im Zellgewebe enthaltene Eiweiß Albumin nicht an und der Fettabbau geschieht nicht auf Kosten der Muskulatur. Zudem erhöht es weder den Blutdruck noch den Puls.
Der Einsatz von DNP als Medikament zur Gewichtsreduktion wurde Mitte der 1930er-Jahre immer häufiger hinterfragt. So schlossen zwei Ärzte aus den Daten einer Studie, dass die therapeutischen Mengen an DNP sehr wenig zur Gewichtsreduktion beitragen.[22] Außerdem wurden immer häufiger schwerwiegende Nebenwirkungen bei der Therapie mit DNP beobachtet.[23] Tainter vertrat dagegen die Ansicht, dass diese höchstens die seltenen Folgen einer Hypersensitivität gegenüber DNP seien.
Wegen seiner Gefährlichkeit und seiner gleichzeitig geringen therapeutischen Breite entzog 1938 schließlich die amerikanische Arzneimittelzulassungsbehörde (FDA) die Zulassung für den Verkauf von DNP-enthaltenden Medikamenten.[24][25]
In den 1980er-Jahren fand 2,4-Dinitrophenol illegal wieder Einzug als Mittel gegen Übergewicht und Antikrebsmittel. So wurden DNP-haltige Produkte in Form von Kapseln vertrieben. Der Tod eines Wrestlers aufgrund der Einnahme dieser Tabletten hatte eine Untersuchung zur Folge, die in einer Gerichtsverhandlung mündete. Im Zuge des Urteils wurde DNP als Medikament zur Gewichtsabnahme wieder vom Markt genommen. Es gibt bis heute keine Zulassung eines DNP-haltigen Nahrungsergänzungsmittels oder Medikaments durch die amerikanische Arzneimittelzulassungsbehörde. Dennoch wird unter Bodybuildern und Athleten DNP auch heutzutage verwendet, um schnell Körperfett zu verlieren.
In Deutschland ist der Vertrieb von DNP als Diätmittel gesetzlich verboten. Im August 2006 verstarb dort eine 19-Jährige nach der Einnahme von etwa einem Gramm dieser Substanz. Wegen akuter Herzbeschwerden, Hitzewallungen und Atemnot wurde sie in ein Krankenhaus eingeliefert, wo sie einen Tag später starb.[17][26]
Technische Verwendung
2,4-Dinitrophenol wird bei der Synthese von Farbstoffen und Holzschutzmittel, Fotochemikalien, Insektiziden, Sprengstoffen, pH-Indikatoren sowie zur Darstellung von Pikrinsäure und Amidol verwendet.[4][27]
Rechtliches
Die Verbindung ist trocken oder mit weniger als 15 % Massenanteil Wasser ein Explosivstoff im Sinne von Artikel 1 Abs. 2 und 3 der Richtlinie 93/15/EWG und des Sprengstoffgesetzes.[28]
Literatur
- E. Colman: Dinitrophenol and obesity: an early twentieth-century regulatory dilemma. In: Regul. Toxicol. Pharmacol., 2007, 48 (2), S. 115–117; PMID 17475379; doi:10.1016/j.yrtph.2007.03.006.
- J. Bell: Etude biologique des produits dinitres chez l'homme. In: Medecine, 1939, 19, S. 749–754; PDF (freier Volltextzugriff, englische Übersetzung Biological Study of Dinitro Drugs in Humans von Robert Ames 1996).
Weblinks
- 2,4-Dinitrophenol (DNP) – Informationen des Bundesamts für Lebensmittelsicherheit und Veterinärwesen
- Allgemeine Infos (engl.)
- Nitrophenolic and Nitrocresolic Herbicides (Chapter 11); PDF.
Einzelnachweise
- Eintrag zu 2,4-Dinitrophenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Eintrag zu 2,4-dinitrophenol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Januar 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Environmental Protection Agency: Federal Register, Vol. 56 (44) (März 1991), S. 9564.
- T. Kagawa, R. Kawai, S. Kashino, M. Haisa: The crystal and molecular structure of 2,4-dinitrophenol. In: Acta Cryst., 1976, B32, S. 3171–3175; doi:10.1107/S0567740876009886.
- K. Dudova, F. Castek, V. Machacek, P. Simunek: Preparation of Substituted Methyl o-Nitrophenyl Sulfides. In: Molecules, 2002, 7, S. 7–17; doi:10.1001/jama.1935.02760270015006.
- H. H. Hodgson: The Iodination of o-nitrophenol. In: J. Chem. Soc., 1927, S. 1141–1144; doi:10.1039/JR9270001141.
- H. E. Armstrong: Observations on the nitrochlorophenols. In: J. Chem. Soc., 1872, 25, S. 12–17; doi:10.1039/JS8722500012.
- W. W. Hartman, H. L. Silloway: 2-Amino-4-Nitrophenol In: Organic Syntheses. 25, 1945, S. 5, doi:10.15227/orgsyn.025.0005; Coll. Vol. 3, 1955, S. 82 (PDF).
- K. Auwers, H. Röhrig: Ueber einige neue Oxyazokörper und Triphendioxazinderivate. In: Berichte der Deutschen Chemischen Gesellschaft, 1897, 30, S. 988–998; Volltext
- W. E. Bradt: The Catalytic Preparation of 2-4 Diaminophenol. In: J. Phys. Chem., 1930, 34 (12), S. 2711–2718; doi:10.1021/j150318a006.
- F. Stenbäck und H. Garcia: Studies on the modifying effect of dimethyl sulfoxide and other chemicals on experimental skin tumor induction. In: Ann. N. Y. Acad. Sci., 1975, 243, S. 209–227; PMID 1055541; doi:10.1111/j.1749-6632.1975.tb25359.x.
- D. de Flora: Study of 106 organic and inorganic compounds in the Salmonella/microsome test. In: Carcinogenesis, 1981, 2 (4), S. 283–298; PMID 7023727; doi:10.1093/carcin/2.4.283.
- J. E. Gibson: Teratology studies in mice with 2-sec-butyl-4,6-dinitrophenol (dinoseb). In: Food and Cosmetics Toxicology, 1973, 11 (1), S. 31–43; PMID 4716128; doi:10.1016/0015-6264(73)90059-X.
- J. C. Suozzi, C. M. Rancont, R. B. McFee: DNP 2,4-dinitrophenol: a deadly way to lose weight. In: Journal of Emergency Medical Services, 2005, 30, S. 82–89; PMID 15662347.
- R. B. McFee, T. R. Caraccio, M. A. McGuigan, S. A. Reynolds, P. Bellanger: Dying to be thin: a dinitrophenol related fatality. In: Vet. Hum. Toxicol., 2004, 46, S. 251–254; PMID 15487646.
- 19-Jährige stirbt an Überdosis Diätpulver. In: Welt online, 18. September 2007.
- S. Kumar, K. Barker, D. Seger: Dinitrophenol-Induced Hyperthermia Resolving With Dantrolene Administration. In: Abstracts of the North American Congress of Clinical Toxicology. In: J Toxicol Clin Toxicol, 2002, 40, S. 689; PDF.
- C. Siegmueller, R. Narasimhaiah: Fatal 2,4-dinitrophenol poisoning… coming to a hospital near you. In: Emerg. Med. J., 2010, 27 (8), S. 639–640; PMID 20511642; doi:10.1136/emj.2009.072892.
- E. Colman: Dinitrophenol and obesity: an early twentieth-century regulatory dilemma. In: Regul. Toxicol. Pharmacol., 2007, 48 (2), S. 115–117; PMID 17475379; doi:10.1016/j.yrtph.2007.03.006.
- W. C. Cutting, M. L. Tainter: Actions of Dinitrophenol. In: Proc. Soc. Exper. Biol. Med., 1932, 29, S. 1268–1269.
- J. M. Strang und F. A. Evans: An evaluation of dinitrophenol as an aid in weight reduction. In: Journal of the American Medical Association, 1936, 1, S. 1957–1963; Abstract.
- C. M. MacBryde und B. L. Taussig: Functional changes in liver, heart, and muscle, and loss of dextrose tolerance resutling from dinitrophenol. In: Journal of the American Medical Association, 1935, 6, S. 13–17; Abstract.
- J. Bartlett, M. Brunner, K. Gough: Deliberate poisoning with dinitrophenol (DNP): an unlicensed weight loss pill. In: Emerg. Med. J., 2010, 27 (2), S. 159–160; PMID 20156878; doi:10.1136/emj.2008.069401.
- K. Wagner: 1-2-4 Dinitrophenol-Vergiftungen: In: Fühner-Wieland’s Sammlung von Vergiftungsfällen, 1936, 7, S. C9–C20; doi:10.1007/BF02453003.
- Wilfried Dubbels: Gefährliche Schlankmacher. In: Pharmazeutische Zeitung online, Ausgabe 44, 2007.
- A. Tewari, T. Ali, J. O’Donnell, M. S. Butt: Weight loss and 2,4-dinitrophenol poisoning. In: Br. J. Anaesth., 2009, 102 (4), S. 566–567; PMID 19286775; PDF.
- Gesetz über explosionsgefährliche Stoffe (Sprengstoffgesetz - SprengG), Anlage III Explosivstoffliste nach § 3 Abs. 1 Nr. 1 PDF



