Ammoniumsulfid
Ammoniumsulfid ist ein Ammoniumsalz des Schwefelwasserstoffs. Es besitzt die Formel (NH4)2S und gehört zur Stoffklasse der Sulfide.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
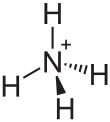 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumsulfid | ||||||||||||||||||
| Andere Namen |
Ammonsulfid
| ||||||||||||||||||
| Summenformel | (NH4)2S | ||||||||||||||||||
| Kurzbeschreibung |
wässrige Lösung: farblos bis gelblich, nach Schwefelwasserstoff riechend[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 68,15 g·mol−1[2] | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,00 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
thermische Zersetzung: −18 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
1280 g·l−1 in Wasser (bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
In der Natur entsteht es als Produkt von Fäulnisprozessen.
Gewinnung und Darstellung
Ammoniumsulfid kann durch die Reaktion von Ammoniak (als Gas oder in Lösung) mit Schwefelwasserstoff gewonnen werden.
Die Reaktionsgleichung lautet:
Verwendung
Ammoniumsulfid, zusammen mit Ammoniak, wird häufig in der anorganischen Chemie für eine Qualitative Analyse verwendet, um im Kationentrennungsgang in der Ammoniumsulfidgruppe aus einer unbekannten Probe die Schwermetallkationen der Elemente Nickel, Cobalt, Eisen, Mangan, Chrom, Aluminium und Zink als eine Gruppe auszufällen, aufzutrennen und mithilfe von Nachweisreaktionen zu identifizieren.[3]
Häufig ist Ammoniumsulfid (wie auch Ammoniumhydrogensulfid und Ammoniumpolysulfide) Bestandteil von sog. Stinkbomben, welche in Glasampullen in den Handel gebracht werden. Diese Verwendung ist in Deutschland verboten (Anlage 1 der Bedarfsgegenständeverordnung).
Das Salz reagiert mit Wasser zu Hydrogensulfid- (HS−) und Hydroxidionen. Eine wässrige Lösung von Ammoniumsulfid ist daher nur im neutralen und schwach basischen Milieu beständig – in Säuren entweicht Schwefelwasserstoffgas, in konzentrierten Laugen Ammoniakgas.
Ammoniumsulfid kann auch verwendet werden, um bei einem Dinitrobenzol selektiv nur eine der beiden Nitrogruppen zu einer Aminogruppe zu reduzieren.[4]
Einzelnachweise
- Eintrag zu Ammoniumsulfid, wässrige Lösung in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Ammoniumsulfid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- E. Schweda: Jander/Blasius: Anorganische Chemie I - Einführung & Qualitative Analyse. 17. Auflage. Hirzel, 2012, ISBN 978-3-7776-2134-0, S. 505.
- P. Y. Bruice: Organische Chemie - Studieren kompakt. 5. Auflage. Pearson, 2011, ISBN 978-3-86894-102-9, S. 611.


