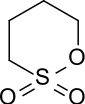
1,4-Butansulton
1,4-Butansulton ist ein sechsgliedriges δ-Sulton und der cyclische Ester der 4-Hydroxybutansulfonsäure. Als so genanntes Sulfoalkylierungsmittel dient 1,4-Butansulton zur Einführung der Sulfobutylgruppe (–(CH2)4–SO3−) in hydrophobe Verbindungen mit nukleophilen funktionellen Gruppen, z. B. Hydroxygruppen wie bei β-Cyclodextrin,[7] oder Aminogruppen wie bei Polymethin-Farbstoffen.[8]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,4-Butansulton | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H8O3S | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 136,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser (54 g·cm−3 bei 20 °C)[6] unter Zersetzung, löslich in organischen Lösungsmitteln, wie z. B. Methanol[4] und Ethanol unter allmählicher Umsetzung, Chloroform,[4] Diethylether[3] und Aromaten, wie z. B. Benzol, Toluol und Anisol | |||||||||||||||
| Brechungsindex |
1,4619–14625 (20 °C, 589 nm)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Die Sulfobutylgruppe liegt darin als neutrales Natriumsalz vor und erhöht die Wasserlöslichkeit der Derivate erheblich.
Vorkommen und Darstellung
Die Laborsynthese von 1,4-Butansulton geht aus von 4,4′-Dichlor-dibutylether (aus Tetrahydrofuran mit Phosphoroxychlorid und konzentrierter Schwefelsäure),[9][10] der mit Natriumsulfit zum entsprechenden 4,4′-Butandisulfonsäure-dinatriumsalz umgesetzt wird. Durch Passage über einen sauren Ionenaustauscher wird das Dinatriumsalz in die Disulfonsäure überführt, die bei erhöhter Temperatur und reduziertem Druck unter Wasserabspaltung zwei Moleküle 1,4-Butansulton bildet. Die erzielten Ausbeuten liegen bei 72 bis 80 %.[5]
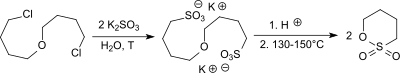
Ausgehend von 4-Chlorbutan-1-ol[11] (aus Tetrahydrofuran und Chlorwasserstoff in 54 bis 57%iger Ausbeute), erhält man mit Natriumsulfit das Natriumsalz der 4-Hydroxybutan-1-sulfonsäure. Das Salz wird wiederum mit starken Säuren, wie z. B. Salzsäure in die sehr hygroskopische 4-Hydroxybutansulfonsäure überführt und unter Wasserabspaltung zum 1,4-Butansulton cyclisiert.
Besonders effizient verläuft die Cyclisierung von 4-Hydroxybutan-sulfonsäure in wässriger Lösung beim Erhitzen mit hochsiedenden und nicht mit Wasser mischbaren Lösungsmitteln, wie z. B. 1,2-Dichlorbenzol oder Diethylbenzol, in denen sich 1,4-Butan-sulton löst und dadurch der Hydrolyse im wässrigen Milieu entzogen wird. Dabei wird bei der Siedetemperatur der Lösungsmittel (ca. 180 °C) 1,4-Butansulton innerhalb einer Stunde in Ausbeuten bis 99 % erhalten.[12]
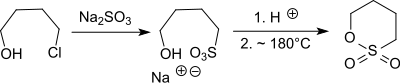
Die Vakuumdestillation des Natriumsalzes der 4-Hydroxybutan-sulfonsäure in Gegenwart von konzentrierter Schwefelsäure führt auch direkt zum 1,4-Butansulton.[13]
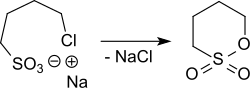
Das aus 1,4-Dichlorbutan mit Natriumsulfit zugängliche Natriumsalz der 4-Chlorbutan-1-sulfonsäure kann durch Erhitzen auf 180–250 °C ebenfalls zum 1,4-Butansulton cyclisiert werden.[14]
Die radikalisch initiierte Sulfochlorierung von 1-Chlorbutan führt zu einem Gemisch stellungsisomerer Sulfochloride, sowie von Chlorierungsprodukten und eignet sich nicht zur gezielten Darstellung von 1,4-Butansulton.[15]
Eigenschaften
1,4-Butansulton ist eine viskose, klare, farb- und geruchlose Flüssigkeit, die in siedendem Wasser (zu 4-Hydroxybutan-sulfonsäure) und Alkoholen (zu 4-Alkoxybutansulfonsäure) reagiert und sich in vielen organischen Lösungsmitteln löst. Bei Temperaturen unterhalb des Schmelzpunkts kristallisiert die Verbindung in „großen prächtigen Platten“.[3] Im Vergleich zum homologen γ-Sulton 1,3-Propansulton ist 1,4-Butansulton als Alkylierungsmittel deutlich weniger reaktiv, aber als mutagen und carcinogen[16] bewertet.
Anwendungen
Sulfobetaine
1,4-Butansulton reagiert mit Nukleophilen, wie z. B. Ammoniak unter Ringöffnung glatt zu den entsprechenden zwitterionischen, meist sehr gut wasserlöslichen Sulfobutylbetainen.[3]
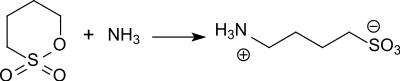
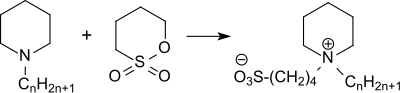
Sulfobetaine mit längeren Alkylketten CnH2n+1 mit n > 10 zeigen interessante Eigenschaften als grenzflächenaktive Verbindungen (Surfactants, Detergentien) mit antimikrobiellen Eigenschaften.[17]
Bei der Umsetzung von N-n-Butylimidazol mit 1,4-Butansulton in Toluol entsteht in 98%iger Ausbeute 1-Butylimidazolium-3-(n-butylsulfonat)[18]
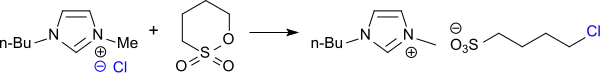
das als Komponente multifunktionaler Katalysatoren die Umsetzung von Platformchemikalien aus Biomasse, wie z. B. Lävulinsäure oder Itaconsäure in die korrespondierenden Lactone, Diole oder cyclische Ether katalysiert.
Aminoalkylphosphonsäuren, wie z. B. Aminomethandiphosphonsäure (aus Phosphortrichlorid, Formamid und Phosphonsäure[19]) bildet mit 1,4-Butansulton N-(Sulfobutyl)aminomethandiphosphonsäure,
aminomethandiphosphons%C3%A4ure.svg.png.webp)
die sich durch sehr hohe Wasserlöslichkeit (< 1000 g·l−1) und ausgeprägte Eigenschaften als Komplexbildner und Wasserenthärter auszeichnet.[20]
Sulfobutylierung von Cyanin-Farbstoffen führt zu gut wasserlöslichen Verbindungen, die sich mit Proteinen, wie z. B. Antikörpern verknüpfen und als pH-empfindliche Fluoreszenzmarker verwenden lassen.[8]

Ionische Flüssigkeiten
Die ionische Flüssigkeit 4-Triethylammoniumbutan-1-sulfonsäure-hydrogensulfat (TEBSA HSO4) entsteht bei der Reaktion von 1,4-Butansulton mit Triethylamin in Acetonitril zum Zwitterion (85 % Ausbeute) und anschließende Umsetzung mit konzentrierter Schwefelsäure,[21]
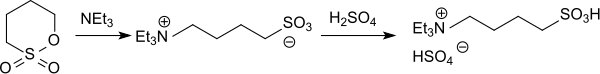
die herkömmliche Mineralsäuren als wirksame und leicht recyclierbare Säurekatalysatoren in lösemittelfreien Reaktionen ersetzen kann.
Die Ringöffnung von 1,4-Butansulton mit organischen Chloridsalzen liefert ionische Flüssigkeiten vom 4-Chlorbutylsulfonat-Typ in quantitativer Ausbeute.[22]
.svg.png.webp)
Das Chloratom im 4-Chlorbutylsulfonat-Anion kann durch Erhitzen mit anorganischen (z. B. Kaliumfluorid) oder organischen (z. B. Natriumacetat) Salzen durch das jeweilige Anion substituiert werden.[23]

Sulfobutyliertes β-Cyclodextrin
Bereits 1949 wurde die Reaktion von 1,4-Butansulton mit dem wasserunlöslichen Polysaccharid Cellulose in Natronlauge berichtet, die zu einem wasserlöslichen Produkt führt.[24]
Eine daraus abgeleitete wichtige Anwendung von 1,4-Butansulton ist die Derivatisierung von β-Cyclodextrin zum Sulfobutylether-beta-cyclodextrin (SBECD),[25] einer wasserlöslichen Einschlussverbindung zur Solubilisierung schwer wasserlöslicher und zur Stabilisierung chemisch instabiler Wirkstoffe.[7][26][27]
Bei der Reaktion von β-Cyclodextrin mit 1,4-Butansulton in Natronlauge bei 70 °C wird der Sulfobutylether in Ausbeuten bis 80 % und einem Substitutionsgrad (engl. engl. degree of substitution, DS) von 6,68 erhalten.[28]
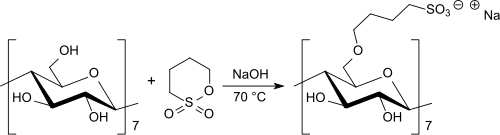
Dadurch nimmt die Wasserlöslichkeit des β-Cyclodextrins bei 25 °C von 18,5 g·l−1 auf mehr als 900 g·l−1 zu.[27]
Sulfobutylether-beta-cyclodextrin findet auch als inertes Vehikel für den Transport und die Freisetzung von Wirkstoffen (engl. drug delivery) vielfältige Anwendungen.[29]
Einzelnachweise
- Eintrag zu 1,4-Butansulton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Februar 2018. (JavaScript erforderlich)
- Datenblatt 1,4-Butansulton bei Sigma-Aldrich, abgerufen am 16. Januar 2017 (PDF).
- J.H. Helberger, H. Lantermann: Zur Kenntnis organischer Sulfonsäuren V. Mitteilung Synthesen des 1,4-Butansultons. In: Liebigs Ann. Chem. Band 586, Nr. 1, 1954, S. 158–164, doi:10.1002/jlac.19545860110.
- Datenblatt 1,4-Butanesultone bei AlfaAesar, abgerufen am 16. Januar 2017 (PDF) (JavaScript erforderlich).
- A.O. Snoddy, T.L. Cairns, W.R. Brasen,: 4-Hydroxy-1-butanesulfonic acid sultone [1-Butanesulfonic acid, 4-hydroxy-, δ-sultone] In: Organic Syntheses. 37, 1957, S. 55, doi:10.15227/orgsyn.037.0055; Coll. Vol. 4, 1963, S. 523 (PDF).
- Datenblatt 1,4-Butansulton zur Synthese (PDF) bei Merck, abgerufen am 16. Januar 2017.
- H. Ueda, D. Ou, T. Endo, H. Nagase, K. Tomono, T. Nagai: Evaluation of a sulfobutyl ether beta-cyclodextrin as a solubilizing/stabilizing agent for several drugs. In: Drug Dev. Ind. Pharm. Band 24, Nr. 9, 1998, S. 863–867, doi:10.3109/03639049809088532.
- V. Wycisk et al.: Responsive Contrast Agents: Synthesis and Characterization of a Tunable Series of pH-Sensitive Near-Infrared Pentamethines. In: ACS Omega. Band 1, Nr. 5, 2016, S. 808–817, doi:10.1021/acsomega.6b00182.
- K. Alexander, H.V. Towles: 4,4‘-Dichlorbutyl ether In: Organic Syntheses. 30, 1950, S. 27, doi:10.15227/orgsyn.030.0027; Coll. Vol. 4, 1963, S. 266 (PDF).
- K. Alexander, L.E. Schniepp: 4,4‘-Dichlorodibutylether and its derivatives from tetrahydrofuran. In: J. Am. Chem. Soc. Band 70, Nr. 5, 1948, S. 1839–1842, doi:10.1021/ja01185a056.
- D. Starr, R.M. Hixon: Tetramethylene chlorohydrin In: Organic Syntheses. 17, 1937, S. 84, doi:10.15227/orgsyn.017.0084; Coll. Vol. 2, 1943, S. 571 (PDF).
- Patent EP0222970A1: Sulfoalkylierungsverfahren. Angemeldet am 9. Juli 1986, veröffentlicht am 27. Mai 1987, Anmelder: Agfa-Gevaert AG, Erfinder: W. Hünicke, R. Gauglitz.
- Patent US3146242: Process for the preparation of sultones. Angemeldet am 21. Mai 1961, veröffentlicht am 25. August 1964, Anmelder: Henkel & Cie GmbH, Erfinder: K.-J. Gardenier, H. Kothe.
- Patent US3117133: Process for the production of sultones. Angemeldet am 19. Oktober 1960, veröffentlicht am 7. Januar 1964, Anmelder: Henkel & Cie GmbH, Erfinder: H. Kothe, K.-J. Gardenier.
- J.H. Helberger, G. Manecke, H.M. Fischer: Zur Kenntnis organischer Sulfonsäuren. II. Mitt.: Die Sulfochlorierung des 1-Chlorbutans und anderer Halogenalkyle: Synthese von Sultonen und eines Sultams. In: Liebigs Ann. Chem. Band 562, Nr. 1, 1949, S. 23–35, doi:10.1002/jlac.19495620104.
- L. Fishbein: Potential Industrial Carcinogens and Mutagens, 1st Edition, in Studies in Environmental Science 4. Elsevier, Amsterdam 1979, ISBN 0-444-41777-X, S. 124.
- D. Wieczorek, A. Dobrowolski, K. Staszak, D. Kwasniewska, P. Dubyk: Synthesis, surface and antimicrobial activity of piperidine-based sulfobetaines. In: J. Surfactants Deterg. Band 20, Nr. 1, 2017, S. 151–158, doi:10.1007/s-11743-016-1906-8.
- F.M.A. Geilen et al.: Selective and Flexible Transformation of Biomass-Derived Platform Chemicals by a Multifunctional Catalytic System. In: Angew. Chem. Band 49, Nr. 32, 2010, S. 5510–5514, doi:10.1002/anie.201002060.
- Patent US3870750: Process for the production of aminomethane-diphosphonic acid and its salts. Angemeldet am 26. April 1972, veröffentlicht am 11. März 1975, Anmelder: Henkel & Cie GmbH, Erfinder: K. Wollmann, W. Plöger, K.-H. Wopms.
- Patent US4250107: N-(Sulfoalkane) amino alkane phosphonic acids and their water-soluble salts. Angemeldet am 6. November 1978, veröffentlicht am 10. Februar 1981, Anmelder: Benckiser-Knapsack GmbH, Erfinder: K. Sommer, G. Schoebel.
- A.R. Hajipour, Y. Ghayeb, N. Sheikhan, A.E. Ruoho: Brønsted acidic ionic liquid as an efficient and reusable catalyst for one-pot synthesis of 1-amidoalkyl 2-naphthols under solvent-free conditions. In: Tetrahedron Lett. Band 50, 2009, S. 5649–5651, doi:10.1016/j.tetlet.2009.07.116.
- N. Paape, W. Wie, A. Bösmann, C. Kolbeck, F. Maier, H.-P. Steinrück, P. Wasserscheid, P.S. Schulz: Chloroalkylsulfonate ionic liquids by ring opening of sultones with organic chloride salts. In: Chem. Commun. 2008, S. 3867–3869, doi:10.1039/B805444D.
- Patent WO2009152902A2: Ionic liquids. Angemeldet am 12. Mai 2009, veröffentlicht am 23. Dezember 2009, Anmelder: Merck Patent GmbH, Erfinder: P. Wasserscheid, N. Paape, A. Boesmann, P. Schulz.
- J.H. Helberger, G. Manecke, R. Heyden: Zur Kenntnis organischer Sulfonsäuren III. Mitteilung: Die Alkylierungsreaktionen der Sultone. In: Liebigs Ann. Chem. Band 565, Nr. 1, 1949, S. 22–35, doi:10.1002/jlac.19495650104.
- The United States Pharmacopeia 38th ed., National Formulary 33th: Betadex Sulfobutyl Ether Sodium. Hrsg.: United States Pharmacopeial Convention. Rockville, MD 2015, ISBN 978-1-936424-34-4, S. 6546–6548.
- T. Loftsson, D. Duchene: Cyclodextrins and their pharmaceutical applications. In: Int. J. Pharm. Band 329, Nr. 1–2, 2007, S. 1–11, doi:10.1016/j.ijpharm.2006.10.044.
- S. Klein, T. Zöller: Cyclodextrine: Molekulare Zuckertüten für Arzneistoffe. In: Pharm. Ztg. Band 26, 2008 (Online).
- D.-Y. Ma, Y.-M. Zhang, J.-N. Xu: The synthesis and process optimization of sulfo butyl ether β-cyclodextrin derivatives. In: Tetrahedron. Band 72, Nr. 22, 2016, S. 3105–3112, doi:10.1016/j.tet.2016.04.039.
- R. Challa, A. Ahuya, J. Ali, R.K. Khar: Cyclodextrins in drug delivery: an updated review. In: AAPS Pharm. Sci. Tech. Band 6, Nr. 2, 2005, S. E329–E357, doi:10.1208/pt060243.

