β-Butyrolacton
β-Butyrolacton ist der intramolekulare Carbonsäureester (Lacton) der optisch aktiven 3-Hydroxybutansäure und fällt bei der chemischen Synthese als Racemat an. 3-Hydroxybuttersäure-β-lacton eignet sich als Monomer zur Herstellung des bioabbaubaren Polyhydroxyalkanoats Poly(3-hydroxybutyrat) (PHB). Polymerisation von racemischem (RS)-4-Methyl-2-oxetanon liefert (RS)-Polyhydroxybuttersäure, die allerdings in wesentlichen Eigenschaften, z. B. Festigkeit oder Abbauverhalten, dem aus natürlichen Quellen stammenden bakteriellen Reservestoff (R)-Poly-3-hydroxybutyrat unterlegen ist.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
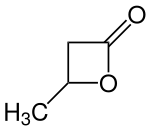 | |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | β-Butyrolacton | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H6O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis hellgelbe Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4100–1,420 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
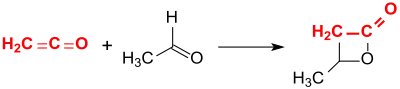
Bei der Addition von Acetaldehyd an Keten in Gegenwart des Tonminerals Montmorillonit wird β-Butyrolacton in 63 %iger Ausbeute erhalten.[4]
Das durch Dehydrobromierung von Acetylbromid mit der Hünig-Base Diisopropylethylamin intermediär entstehende Keten reagiert in Gegenwart eines chiralen Aluminium-Komplexes enantioselektiv zu (S)-β-Butyrolacton in 92 %iger Ausbeute mit einem Enantiomerenüberschuss ee von über 98 %.[5]
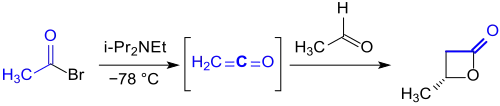
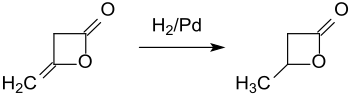
Hydrierung von Diketen an einem Palladium-Kontakt liefert β-Butyrolacton in 93 %iger Ausbeute.[6]
Die asymmetrische Hydrierung von Diketen mit einem Ruthenium-BINAP-Katalysator zu optisch aktivem (R)- 4-Methyloxetan-2-on mit 97 % Selektivität und 92 % Enantiomerenüberschuss ist ebenfalls beschrieben.[7]
Mit dem aus einem modifizierten Aluminium-Salen-Komplex [(salph)AlCl und Natriumtetracarbonylcobaltat NaCo(CO)4] zugänglichen homogenen Carbonylierungskatalysator [(salph)Al(THF)2][Co(CO)4] nach Geoffrey Coates[8] wird bei 50 °C und ca. 60 bar CO-Druck (R)-Propylenoxid unter Retention der Konfiguration in 95 %iger Ausbeute zu (R)-BBL carbonyliert.[9]

Die Carbonylierung von 1,2-Epoxypropan in Gegenwart homogener Porphyrin-Carbonylcobaltat-Katalysatoren in Tetrahydrofuran gelingt auch bereits bei ca. 14 bar Kohlenmonoxid-Partialdruck und liefert 3-Methylpropiolacton in 97 %iger Ausbeute.[10]
Wegen der Probleme bei der Abtrennung und Recyclierung homogener Carbonylierungskatalysatoren wurden in neuerer Zeit auch heterogene Polymeranaloga bearbeitet, die bei 60 bar CO-Druck ähnlich hohe Ausbeuten (bis 96 %) liefern, aber bei drastisch niedrigerer katalytischer Aktivität in 50mmolaren Laboransätzen noch nicht als aussichtsreiche Kandidaten für eine industrielle Anwendung erscheinen.[11]
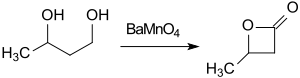
Der billige Ausgangsstoff 1,3-Butandiol kann mit dem Oxidationsmittel Bariummanganat BaMnO4 in Acetonitril unter Mikrowellenbestrahlung innerhalb 1h zu β-Butyrolacton (74 % Ausbeute) umgesetzt werden.[12]
Eigenschaften
β-Butyrolacton ist eine acetonartig bzw. nach Minze[1] riechende klare Flüssigkeit, die sich mit Wasser mischt und in vielen organischen Lösungsmitteln löslich ist. Nach einer Klassifizierung der IARC ist β-Butyrolacton der Gruppe 2B: „möglicherweise karzinogen“ zugeordnet.
Anwendungen
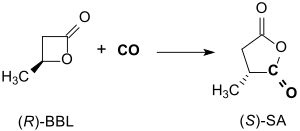
(R)-β-Butyrolacton reagiert in Toluol-Lösung bei ca. 14 bar CO-Druck und 55 °C in Gegenwart eines Salen-Komplexes innerhalb 24 h unter Inversion der Konfiguration in 94 %iger Ausbeute zu optisch reinem (> 99 % ee) (S)-Methylbernsteinsäureanhydrid.[13]
Homo- und Copolymere aus β-Butyrolacton
Die Kommerzialisierung der aus Bakterien isolierten Polyhydroxybuttersäure PHB bzw. der homo- und copolymeren Polyhydroxyalkanoate als aerob bioabbaubare thermoplastische Kunststoffe unter dem Markennamen Biopol® der Imperial Chemical Industries ICI im Jahr 1983 setzte den Startpunkt für die Suche nach synthetischen Alternativen, die Nachteile der PHB wie Sprödigkeit und Steifigkeit, thermische Zersetzung bereits bei Temperaturen knapp oberhalb der Schmelztemperatur (175 – 180 °C) und insbesondere nicht wettbewerbsfähige Kosten[14] wegen teurer Fermentierung, Isolierung und Reinigung vermeiden sollten.
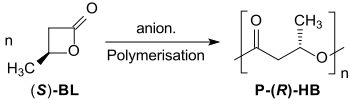
Die ringöffnende Polymerisation von (S)-β-Butyrolacton mit Diethylzink ZnEt2/Wasser erzeugt unter Retention der Konfiguration am chiralen Kohlenstoffatom Poly-(S)-3-hydroxybutyrat mit ee > 97 %.[15]
-beta-BL.svg.png.webp)
Mit Zinn-Verbindungen (Distannoxane) als Katalysatoren entstehen bei der Polymerisation von (R)-β-BL ebenfalls unter Retention hochmolekulare (Mn > 100,000) synthetische (R)-Polyhydroxybutyrate, die den natürlichen Polyhydroxyalkanoaten ähneln.[16]
Die anionische Polymerisation von optisch aktivem β-Butyrolacton führt unter Inversion zu kristallinen, isotaktischen Polyhydroxybutyraten, deren niedrige Polydispersität Mw/Mn ≈ 1,2 auf das Vorliegen einer lebenden Polymerisation hindeuten.[17][18]
Auch sehr starke Basen, wie z. B. Diazabicycloundecen DBU, 1,5,7-Triazabicyclo(4.4.0)dec-5-en TBD und dem Phosphazen BEMP sind imstande, die ringöffnende Polymerisation von β-Butyrolacton in Substanz bei 60 °C zu niedrigmolekularen (Mn < 21,000) PHBs mit enger Molmassenverteilung zu katalysieren.[19]
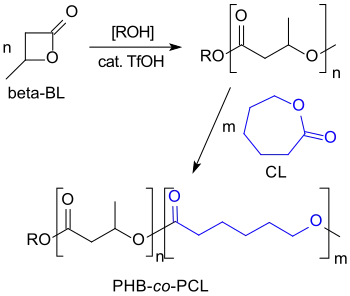
Die kationische ringöffnende Polymerisation von β-Butyrolacton mit sehr starken Säuren, wie z. B. Trifluormethansulfonsäure führt zu niedermolekularen PHBs (Mn < 8,200) mit lebenden Hydroxy-Kettenenden, an die z. B. Caprolacton-Blöcke anpolymerisiert werden können.[20]
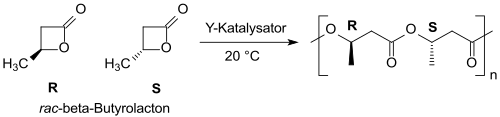
Mit Yttrium-basierten Katalysatoren kann racemisches β-Butyrolacton in (überwiegend) syndiotaktisches PHB mit enger Molmassenverteilung überführt werden.[21][22]
N-Heterocyclische Carbene (NHCs) vom Imidazol-2-ylidentyp sind starke Nukleophile und eignen sich auch als Initiatoren für die ringöffnende Polymerisation von Lactonen wie β-Butyrolacton.[23]

Synthetische PHB-Varianten, die als Homopolymere von β-Butyrolacton oder Copolymere mit anderen Lactonen entwickelt wurden, konnten bisher die Schwächen des biogenen Materials – insbesondere ungünstige mechanische und thermische Eigenschaften und hoher Preis – nicht ausgleichen. Stattdessen kamen neue Probleme mit toxischen Schwermetallen in den Katalysatoren (z. B. Zinn, Cobalt oder Chrom) und ataktische (flüssige und schwer abtrennbare) Polymeranteile mit unerwünschten Materialeigenschaften hinzu. Auch mehr als 30 Jahre nach Markteinführung ist der wirtschaftliche Erfolg des Biopolymeren Biopol® und seiner (bio)synthetischen Analoga bescheiden, und ihre Umsätze sind trotz ambitionierter Kapazitätsziele (tatsächliche globale Polyhydroxyalkanoate PHA-Kapazität 2018: ca. 30,000 to[24]) bisher weit hinter den optimistischen Prognosen der Hersteller zurückgeblieben.
Einzelnachweise
- Eintrag zu β-Butyrolactone bei TCI Europe, abgerufen am 20. Dezember 2018.
- Datenblatt β-Butyrolacton bei Sigma-Aldrich, abgerufen am 31. Oktober 2021 (PDF).
- H. Abe, I. Matsubara, Y. Doi, Y. Hori, A. Yamaguchi: Physical properties and enzymatic degradability of poly(3-hydroxybutyrate) stereoisomers with different stereoregularities. In: Macromolecules. Band 27, Nr. 21, 1994, S. 6018–6025, doi:10.1021/ma00099a013.
- Patent US2580714: Production of beta-hydroxy carboxylic acid lactones from ketene and aldehyde with clay catalyst. Angemeldet am 24. Mai 1949, veröffentlicht am 1. Januar 1952, Anmelder: Union Carbide and Carbon Corp., Erfinder: F.G. Young, J.T. Fitzpatrick.
- S.G. Nelson, W.S. Cheung, A.J. Kassick, M.A. Hilfiker: A de novo enantioselective total synthesis of (-)-laulimalide. In: J. Amer. Chem. Soc. Band 124, Nr. 46, 2002, S. 13654–13655, doi:10.1021/ja028019k.
- Patent US2763664: Process for manufacturing β-butyrolactone from diketene. Angemeldet am 6. Dezember 1952, veröffentlicht am 18. September 1956, Anmelder: Wacker-Chemie GmbH, Erfinder: J. Sixt.
- T. Ohta, T. Miyake, H. Takaya: An efficient synthesis of optically active 4-methyloxetan-2-one: asymmetric hydrogenation of diketene catalysed by binap–ruthenium(II) complexes [binap = 2,2′-bis(diphenylphosphino)-1,1′-binaphthyl]. In: J. Chem. Soc., Chem. Commun. Band 0, Nr. 23, 1992, S. 1725–1726, doi:10.1039/C39920001725.
- Catalysts for Carbonylation. In: Aldrich ChemFiles 2007, 7.5, 3. Sigma Aldrich, 2007, abgerufen am 20. Dezember 2018.
- Y.D.Y.L. Getzler, V. Mahadevan, E.B. Lobkovsky, G.W. Coates: Synthesis of β-lactones: a highly active and selective catalyst for epoxide carbonylation. In: J. Amer. Chem. Soc. Band 124, Nr. 7, 2002, S. 1174–1175, doi:10.1021/ja017434u.
- Patent US2012123137A1: Process for beta-lactone production. Angemeldet am 7. April 2010, veröffentlicht am 17. Mai 2012, Anmelder: Novomer, Inc., Erfinder: S.D. Allen, R.R. Valente, H. Lee, A.E. Cherian, D.L. Bunning, N.A. Clinton, O.S. Fruchey, B.D. Dombek.
- J. Jiang, S. Yoon: A metalated porous porphyrin polymer with [Co(CO)4]- anion as an efficient heterogeneous catalyst for ring expanding carbonylation. In: Nature Scientific Reports. Band 8, Nr. 13243, 2018, S. 1–6, doi:10.1038/s41598-018-31475-6.
- M.C. Bagley, Z. Lin, D.J. Phillips, A.E. Graham: Barium manganate in microwave-assisted oxidation reactions: synthesis of lactones by oxidative cyclization reactions. In: Tetrahedron Lett. Band 50, Nr. 49, 2009, S. 6823–6825, doi:10.1016/j.tetlet.2009.09.117.
- Y.D.Y.L. Getzler, V. Kundnani, E.B. Lobkovsky, G.W. Coates: Catalytic carbonylation of β-lactones to succinic anhydrides. In: J. Amer. Chem. Soc. Band 126, Nr. 22, 2004, S. 6842–6843, doi:10.1021/ja048946m.
- ICI reduces cost, ups capacity for Biopol. ICIS, 22. September 1991, abgerufen am 20. Dezember 2018.
- Y. Zhang, R.A. Gross, R.W. Lenz: Stereochemistry of the ring-opening polymerization of (S)-β-butyrolactone. In: Macromolecules. Band 23, Nr. 13, 1990, S. 3206–3212, doi:10.1021/ma00215a002.
- Y. Hori, M. Suzuki, A. Yamaguchi, T. Nishishita: Ring-opening polymerization of optically active β-butyrolactone using distannoxane catalysts: Synthesis of high molecular weight poly(3-hydroxybutyrate). In: Macromolecules. Band 26, Nr. 20, 1993, S. 5533–5534, doi:10.1021/ma00072a037.
- Z. Jedlinski, P. Kurcok: First facile synthesis of biomimetic poly (R)-3-hydroxybutyrate via regioselective anionic polymerization of (S)-β-butyrolactone. In: Macromolecules. Band 31, Nr. 19, 1998, S. 6718–6720, doi:10.1021/ma980663p.
- R. Kurcak, M. Smiga, Z. Jedlinski: β-Butyrolactone polymerization initiated with tetrabutylammonium carboxylates: a novel approach to biomimetic polyester synthesis. In: J. Polym. Sci.: Part A: Polym. Chem. Band 40, Nr. 13, 2002, S. 2184–2189, doi:10.1002/pola.10285.
- C.G. Jaffredo, J.-F. Carpentier, S.M. Guillaume: Controlled ROP of β-butyrolactone simply mediated by amidine, guanidine, and phophazene organocatalysts. In: Macromol. Rapid Comun. Band 33, Nr. 22, 2012, S. 1938–1944, doi:10.1002/marc.201200410.
- A. Couffin, B. Martin-Vaca, D. Bourissou, C. Navarro: Selective O-acyl ring-opening of β-butyrolactone catalyzed by trifluoromethane sulfonic acid: application to the preparation of well-defined block copolymers. In: Polym. Chem. Band 5, Nr. 1, 2014, S. 161–168, doi:10.1039/C3PY00935A.
- A. Amgoune, C.M. Thomas, S. Ilinca, T. Roisnel, J.-F. Carpentier: Highly active, productive, and syndiospecific yttrium initiators for the polymerization of racemic β-butyrolactone. In: Angew. Chem. Int. Ed. Band 45, Nr. 17, 2006, S. 2782–2784, doi:10.1002/anie.200600058.
- J.-F. Carpentier: Discrete metal catalysts for stereoselective ring-opening polymerization of chiral racemic β-lactones. In: Macromol. Rapid Commun. Band 31, Nr. 19, 2010, S. 1696–1705, doi:10.1002/marc.201000114.
- W.N. Ottou, H. Sardon, D. Mecerryes, J. Vignolle, D. Taton: Update and challenges in organo-mediated polymerization reactions. In: Progress in Polymer Science. Band 56, 2016, S. 64–115, doi:10.1016/j.progpolymsci.2015.12.001.
- Bioplastic Markt Daten, abgerufen am 20. Dezember 2018.


