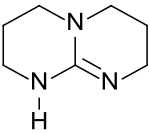
1,5,7-Triazabicyclo(4.4.0)dec-5-en
1,5,7-Triazabicyclo[4.4.0]dec-5-en ist als bicyclisches Guanidin eine sehr starke Base, die in einer Vielzahl von basenvermittelten Umsetzungen der Organischen Chemie Verwendung findet.[6]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,5,7-Triazabicyclo(4.4.0)dec-5-en | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C7H13N3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 139,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert |
26,2[3] | |||||||||||||||
| Löslichkeit |
löslich in Wasser, Acetonitril, Ethanol[2], in Dimethylsulfoxid, Dimethylformamid,[4] sowie in anderen organischen Lösungsmitteln, wie z. B. Toluol, Tetrahydrofuran oder Dichlormethan[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Eine umständliche, mehrstufigen Synthese geht von 1,3-Diaminopropan und Kohlenstoffdisulfid (CS2) aus.[7]
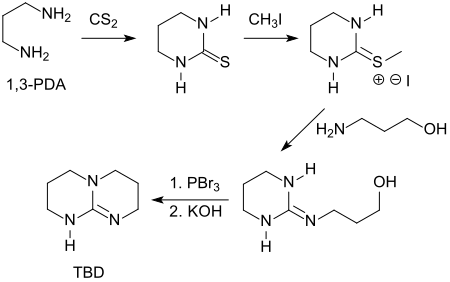
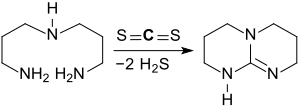
Eine jüngere Alternativroute[8] verwendet die teuren Ausgangsstoffe Tetramethylorthocarbonat und Bromwasserstoffsäure. Überlegen ist die Darstellung von Triazabicyclodecen aus Bis(3-aminopropyl)amin und Kohlenstoffdisulfid in Gegenwart einer starken Säure, wie z. B. para-Toluolsulfonsäure, die TBD in 86%iger Ausbeute liefert.[9]
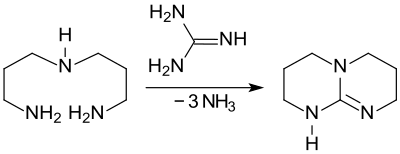
Der effizienteste Syntheseweg zu 1,5,7-Triazabicyclo[4.4.0]dec-5-en scheint die Umsetzung von Guanidin oder Cyanamid mit Bis(3-aminopropyl)amin in Gegenwart starker Säuren zu sein, wobei unter Abspaltung von Ammoniak TBD in 95- bis 97%iger Ausbeute gebildet wird.[10]
Eigenschaften
1,5,7-Triazabicyclo[4.4.0]dec-5-en ist ein weißes[1] bis hellgelbes[2] Kristallpulver, das sich in Wasser, Ethanol, Acetonitril und anderen Lösungsmitteln, wie Toluol, THF, DMSO und Dichlormethan löst.[5]
Als bicyclisches Guanidinderivat ist TBD eine sehr starke Base, deren Basizität (korrespondierender pKS-Wert = 26,2) zwischen dem der Aminbase 1,1,3,3-Tetramethylguanidin TMG (13,6) und dem Phosphazen P4-t-Bu (42,7) liegt.[11]
Anwendungen
1,5,7-Triazabicyclo[4.4.0]dec-5-en katalysiert den Isotopenaustausch H → D in Ketonen und Carbonsäureestern, wie Phenylessigsäuremethylester, bereits bei Raumtemperatur mit hohen Ausbeuten bis 97 %.[3]

Als starke Base katalysiert TBD Aldolkondensationen, wie z. B. die Reaktion von Benzaldehyd mit Heptanal zu Jasminaldehyd[12]

Die flüssige Base TBD kann durch Einleiten von CO2 ausgefällt, durch Filtrieren isoliert und durch Erhitzen auf 130 °C unter Schutzgas wiedergewonnen werden.
Die Aminolyse von Carbonsäureestern wird durch TBD katalysiert[5], wie z. B. bei der Umsetzung von Phenylessigsäuremethylester mit Benzylamin.[13]

Unter optimierten Bedingungen (30 % TBD, 75 °C) entsteht das Amid in 94%iger Ausbeute.
TBD katalysiert bereits bei niedriger Dosierung (0,1 %) die ringöffnende Polymerisation von Lactonen zu Polyestern, wie z. B. von Lactid mit dem Initiator Benzylalkohol in Methylenchlorid zu Polymilchsäure[5], in 99%iger Ausbeute innerhalb von 20 Sekunden.

Mit anderen cyclischen Estern, wie γ-Valerolacton und ε-Caprolacton können bei höheren TBD-Konzentrationen (0,3 oder 0,5 %) innerhalb von 0,5 h bzw. 8 h in hohen Ausbeuten Polymere mit brauchbaren Molmassen erhalten werden.[14]
Auch das sechsgliedrige δ-Valerolacton, nicht jedoch das erheblich reaktivere, viergliedrige β-Butyrolacton, liefert TBD-katalysiert den entsprechenden Polyester mit geringer Polydispersität (PDI) Q.[15]

Die niedrigen Q-Werte der erhaltenen Polymere weisen auf das Vorliegen einer lebenden Polymerisation hin.
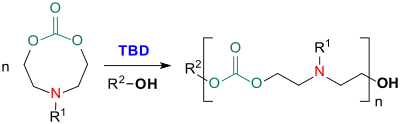
Cyclische Carbonate, wie z. B. 1,3-Dioxan-2-on (Trimethylencarbonat) oder stickstoffhaltige achtgliedrige Cyclocarbonate können mit Triazabicyclodecen zu funktionellen Polycarbonaten polymerisiert und copolymerisiert werden.[16]
Einzelnachweise
- Eintrag zu 1,5,7-Triazabicyclo[4.4.0]dec-5-ene bei TCI Europe, abgerufen am 30. Oktober 2018.
- Datenblatt 1,5,7-Triazabicyclo[4.4.0]dec-5-en, 98 % bei Sigma-Aldrich, abgerufen am 30. Oktober 2018 (PDF).
- C. Sabot, K.A. Kumar, C. Antheaume, C. Mioskowski: Triazabicyclodecene: An effective isotope exchange catalyst in CDCl3. In: J. Org. Chem. Band 72, Nr. 13, 2007, S. 5001–5004, doi:10.1021/jo070307h.
- Product Information: 1,5,7-Triazabicyclo[4.4.0]dec-5-ene bei Cayman Chemical, abgerufen am 30. Oktober 2018.
- M.K. Kiesewetter, M.D. Scholten, N. Kirn, R.L. Weber, J.L. Hedrick, R.M. Waymouth: Cyclic guanidine organic catalysts: What is magic about triazabicyclodecene? In: J. Org. Chem. Band 74, Nr. 24, 2009, S. 9460–9496, doi:10.1021/jo902369g.
- A. Huczynski, B. Brzezinsky, T. Furukawa: 1,5,7-Triazabicyclo[4.4.0]dec-5-ene. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2014, doi:10.1002/047084289X.rn00786.pub2.
- A.F. McKay, M.-E. Kreling: Δ8-Hexahydro-1,4,8-pyrimidazole, Δ9-1,5,9-Triazabicyclo(4.4.0)decene, and Δ9-1,4,9-Triazabicyclo(5.3.0)decene. In: Can. J. Chem. Band 35, Nr. 12, 1957, S. 1438–1445, doi:10.1139/v57-190.
- F.P. Schmidtchen: Synthese symmetrisch substituierter bicyclischer Guanidine. In: Chem. Ber. Band 113, Nr. 6, 1980, S. 2175–2182, doi:10.1002/cber.19801130612.
- Patent EP0198680A1: Guanidines preparation. Angemeldet am 11. April 1986, veröffentlicht am 22. Oktober 1986, Anmelder: BP Chemicals Ltd., Erfinder: R. A‘Court.
- S. Usachev, A. Gridnev: Convenient preparation of bicyclic guanidines. In: Synth. Commun. Band 41, Nr. 24, 2011, S. 3683–3688, doi:10.1080/00397911.2010.519848.
- T. Ishikawa: Superbases for Organic Synthesis: Guanidines, Amidines, Phosphazenes and Related Organocatalysts. John Wiley & Sons, Chichester, UK 2009, ISBN 978-0-470-51800-7.
- I. Cota, F. Medina, J.E. Sueiras, D. Tichit: 1,5,7-Triazabicyclo[4.4.0]dec-5-ene (TBD) an efficient homogeneous catalyst for aldol condensation reactions. Study of the catalyst recovery and reusability using CO2. In: Tetrahedron Lett. Band 52, Nr. 3, 2011, S. 385–387, doi:10.1016/j.tetlet.2010.11.032.
- C. Sabot, K.A. Kumar, S. Meunier, C. Mioskowski: A convenient aminolysis of esters catalyzed by 1,5,7-triazabicyclo[4.4.0]dec-5-ene (TBD) under solvent-free conditions. In: Tetrahedron Lett. Band 48, Nr. 22, 2007, S. 3863–3866, doi:10.1016/j.tetlet.2007.03.146.
- R.C. Pratt, B.G.G. Lohmeijer, D.A. Long, R.M. Weymouth, J.L. Hedrick: Triazabicyclodecene: A simple bifunctional organocatalyst for acyl transfer and ring-opening polymerization of cyclic esters. In: J. Amer. Chem. Soc. Band 128, Nr. 14, 2006, S. 4556–4557, doi:10.1021/ja060662+.
- L. Simón, J.M. Goodman: The mechanism of TBD-catalyzed ring-opening polymerization of cyclic esters. In: J. Org. Chem. Band 72, Nr. 25, 2007, S. 9656–9662, doi:10.1021/jo702088c.
- S. Venkataraman et al.: A simple and facile approach to aliphatic N-substituted functional eight-membered cyclic carbonates and their organocatalytic polymerization. In: J. Amer. Chem. Soc. Band 137, Nr. 43, 2015, S. 13851–138460, doi:10.1021/jacs.5b06355.
