Zöliakie
Die Zöliakie (Synonyme: glutensensitive oder gluteninduzierte Enteropathie, einheimische Sprue, nichttropische Sprue, selten auch intestinaler Infantilismus, Heubner-Herter-Krankheit) ist eine durch Glutenunverträglichkeit verursachte langfristige Autoimmunerkrankung, die hauptsächlich den Dünndarm betrifft.[1] Sie ist im eigentlichen Sinn keine Allergie,[2] sondern eine chronische Entzündung der Dünndarmschleimhaut aufgrund einer Überempfindlichkeit gegen Bestandteile von Gluten, dem vor allem in den Körnern (Samen) vieler Getreidesorten vorkommenden Klebereiweiß. Auch andere Organe können betroffen sein. Die Glutenunverträglichkeit ist zum Teil erblich, kann derzeit nicht ursächlich behandelt werden und bleibt lebenslang bestehen.
| Klassifikation nach ICD-10 | |
|---|---|
| K90.0 | Zöliakie |
| ICD-10 online (WHO-Version 2019) | |
Durch glutenhaltige Nahrungsmittel entsteht eine Entzündung der Dünndarmschleimhaut mit oft ausgedehnter Zerstörung der Darmepithelzellen. Dadurch können Nährstoffe nur schlecht aufgenommen werden, sie verbleiben großteils unverdaut im Darm. Die Symptome und die Schwere des Krankheitsbildes können sehr unterschiedlich sein, was das Erkennen erschwert. Mögliche Symptome sind Gewichtsverlust, Durchfall, Erbrechen, Appetitlosigkeit, Müdigkeit, Depressionen, Blutungsneigung (durch Vitamin-K-Mangel[3]) und im Kindesalter eine Gedeihstörung (verlangsamte körperliche Entwicklung); auch neurologische Störungen können auftreten.[4] Eine nicht therapierte Zöliakie erhöht die Gefahr eines Non-Hodgkin-Lymphoms (ein Lymphknoten-Krebs) sowie wahrscheinlich auch von Karzinomen des Verdauungstrakts. Zöliakie geht bei fünf bis zehn Prozent der Patienten mit einem Diabetes mellitus Typ 1 einher. Die Behandlung der Zöliakie besteht derzeit ausschließlich aus einer glutenfreien Ernährung.
Ähnliche Symptome wie bei der Zöliakie treten bei einer Weizenallergie auf. Als Ausschlussdiagnose „bei einer weizenabhängigen Klinik und negativer Serologie (für Zöliakie-spezifische Antikörper), normaler Dünndarmhistologie, negativem spezifischem IgE (Weizen) und negativem Prick-Test (Weizen) kann nach sorgfältigem Ausschluss anderer Diagnosen der Verdacht auf eine Nicht-Zöliakie-Nicht-Weizenallergie-Weizensensitivität gestellt werden.“[5]
Namensherkunft
Zöliakie ist die deutsche Entsprechung zur neulateinischen fachsprachlichen Bezeichnung coeliacia. Das Wort leitet sich vom lateinischen Adjektiv coeliacus her, mit der Grundbedeutung ‚den Unterleib betreffend‘, das aber in einer weiteren Bedeutung auch mit ‚unterleibskrank’ übersetzt wird (rein lat. ventriculosus). Das lateinische coeliacus geht wiederum auf das griechische Adjektiv κοιλιακός koiliakós, deutsch ‚an der Verdauung leidend‘ zurück, das sich von κοιλία koilía, deutsch ‚Bauchhöhle‘, ‚Bauch‘, ‚Unterleib‘ herleitet.[6][7][8]
Allergene
Die Allergene sind die Gliadine (die alkohollösliche Fraktion des Glutens) und Glutenine. Je nach Getreideart haben diese Allergene eine unterschiedliche Zusammensetzung:[9]
- Weizen, Dinkel (inkl. Grünkern), Khorasan, Durum: α-/β/ω-Gliadin und Glutenine,[10] C-C-Allergen (Bäckerasthma), CBP2
- Gerste: Hordenin Amylase-Inhibitoren IAM1 und CMb (beide Bäckerasthma)
- Hafer: Avenin A, E und F
- Roggen: Secalinin
Glutenfrei hingegen sind die folgenden Getreidearten:

- Mais
- Reis
- Hirse (auch: Teff, Braunhirse und geschälte „Goldhirse“)
Auch alle Pseudogetreidearten sind glutenfrei:
Da unterschiedliche Getreidearten oft im selben Betrieb verarbeitet werden, sind Kreuzkontaminationen nicht auszuschließen. Glutenfreie Ware signalisiert z. B. das gf-Logo (durchgestrichene Ähre), ansonsten meist der Warnhinweis „kann Spuren von Gluten enthalten“ (siehe Abschnitt EU-Verordnung).
Epidemiologie
Die Häufigkeit der Erkrankung schwankt in verschiedenen Ländern erheblich. Außerdem unterscheiden sich die Häufigkeitsangaben danach, ob die Diagnose erst aufgrund von klinischen Symptomen oder schon aufgrund eines Suchtests im Serum gestellt wird. Unter alleiniger Berücksichtigung der symptomatischen Fälle reicht die Häufigkeit (Prävalenz) von 1:10.000 (Dänemark, USA) bis zu 1:300 (Schweden, Großbritannien). Weltweit wird eine durchschnittliche Häufigkeit von etwa 1:3350 angegeben. Zieht man auch die durch Screeninguntersuchungen diagnostizierten Fälle hinzu, erhöht sich die Prävalenz auf 1:500 in Deutschland und Dänemark und etwa 1:110 in den USA und Großbritannien, im weltweiten Durchschnitt ungefähr auf 1:270.[11] Steigende Erkrankungszahlen in Schweden bei gleichzeitig konstant bleibender Häufigkeit im genetisch verwandten Norddänemark werden auf eine in Schweden übliche frühe Zufütterung von getreidehaltiger Beikost im Säuglingsalter zurückgeführt.[11] Allzu frühes Zufüttern scheint das Risiko für eine Zöliakie zu erhöhen.[12] Bei Menschen mit dem Down-Syndrom (Trisomie 21) wird das Auftreten einer Zöliakie zudem etwas häufiger beobachtet als bei Menschen ohne diese chromosomale Fehlbildung.
Die Zöliakie hat zwei Manifestationsgipfel: einen im Säuglingsalter und einen im vierten Lebensjahrzehnt. Frauen sind häufiger betroffen als Männer.
Eine Untersuchung von Blutkonserven, die um das Jahr 1950 angelegt wurden, und von Blutproben einer vergleichbaren Bevölkerungsgruppe aus dem Jahr 2005 zeigte auf, dass sich die Erkrankungsrate in diesem Zeitraum verfünffacht hat. Zudem ergab die Kohortenanalyse, dass langfristig betrachtet das Sterberisiko von Personen mit unerkannter und daher nicht mit glutenfreier Diät behandelter Zöliakie um ein Vielfaches höher lag als das von Personen ohne Zöliakie.[13]
Ursachen
Bei den betroffenen Personen können Proteine wie das Gliadin die Epithelzellschicht der Darmschleimhaut passieren. Das im Endomysium lokalisierte Enzym Tissue-Transglutaminase (tTG) modifiziert die Gliadinpeptide, die eine lokale Immunreaktion auslösen und intestinale T-Zellen aktivieren. Umweltfaktoren wie eine Infektion mit dem Pilz Candida albicans, Stress oder hoher Alkoholkonsum können eine erhöhte Aktivität der tTG bewirken und so die Entstehung der Zöliakie fördern.[14]
Eine familiäre Häufung bei Verwandten ersten Grades und insbesondere eineiigen Zwillingen legt einen erblichen Faktor bei der Entstehung einer Zöliakie nahe. Verwandte ersten Grades von Zöliakiepatienten sind zu 5 bis 15 Prozent ebenfalls betroffen; dieser Anteil liegt für eineiige Zwillinge bei 70 Prozent.[15] Tatsächlich findet sich bei mehr als 99 Prozent der betroffenen Menschen auch eine bestimmte Konstellation von sogenannten Histokompatibilitätsantigenen (HLA), nämlich HLA DQ2, DQ7 und DQ8. Allerdings haben insgesamt 25 Prozent aller Menschen diese HLA-Konstellation, wobei etwa 98 Prozent von ihnen das Klebereiweiß ohne Probleme vertragen, sie entwickeln eine Toleranz gegen die schädigenden Anteile, die von den übrigen zwei Prozent offenbar nicht erreicht wird. Warum das so ist, kann noch nicht sicher beantwortet werden. Die Forschungen richten sich auf weitere genetische Merkmale, aber auch auf Infektionen als mögliche mitauslösende Faktoren.[12]
Eine Zöliakie kann zu 99 Prozent ausgeschlossen werden, wenn bei einem symptomatischen Patienten kein entsprechender Genotyp nachgewiesen werden kann. Die genetische Diagnostik wird nur in Ausnahmesituationen wie z. B. im Rahmen genetischer Beratungen hinzugezogen, oder wenn bei typischer Symptomatik und positiven Antikörpern eine histologische Abklärung nicht möglich ist.[16]
Eine Studie legt nahe, dass Infektionen mit Reoviren in jungen Jahren die Krankheit triggern.[17]
Pathophysiologie
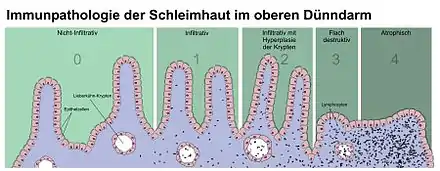
Inzwischen ist eine Reihe von schädigenden Abschnitten des Klebereiweißes genau identifiziert worden. Sie gehören alle der alkohollöslichen Fraktion an (sogenannte Prolamine), werden z. B. beim Weizen Gliadin, beim Roggen Secalin, bei der Gerste Hordein genannt und enthalten als Aminosäuren besonders viel Prolin und Glutamin. Bei entsprechend veranlagten Menschen führen diese Eiweißabschnitte (Peptide, Ketten aus 50–100 Aminosäuren) zu einer komplexen Reaktion der Darmschleimhaut und des Immunsystems. Schleimhautzellen des Dünndarmes (Enterozyten) produzieren vermehrt verschiedene HLA-Klassen (HLA I, DR und DQ). Bestimmte Abschnitte des Klebereiweißes (Gliadinpeptide) binden an die vermehrt gebildeten HLA-DQ2-Antigene. Diese Bindung wird dadurch verstärkt, dass aus der zahlreich im Peptid vorhandenen Aminosäure Glutamin Glutaminsäure gebildet wird. Diese Glutaminsäurebildung wird durch das Enzym Gewebstransglutaminase vermittelt. Mit dieser Veränderung passt der entsprechende Abschnitt des Gliadins besser in die „Taschen“ der HLA-Proteine. Der Komplex aus Gliadinpeptid und HLA-DQ2-Antigen bindet wiederum an spezielle Lymphozyten (CD4+-T-Helferzellen) und ruft in diesen eine vermehrte Produktion verschiedener entzündungsauslösender Botenstoffe (Interferon-γ, TNF-α, Interleukin-6 und Interleukin-2) hervor.
Im weiteren Prozess der Entzündung werden verschiedene Antikörper gebildet, von denen noch nicht bekannt ist, ob sie ursächlich an der Entstehung der Zöliakie oder anderen, mit Zöliakie assoziierten Autoimmunerkrankungen beteiligt sind. Neben Antikörpern gegen das Klebereiweiß selbst (Gliadin-Antikörper, AGA) treten auch sogenannte Autoantikörper gegen körpereigene Antigene auf. 1997 wurde die Gewebstransglutaminase als hauptsächlich verantwortliches Autoantigen identifiziert. Aufgrund dieser Befunde wird die Zöliakie aus pathophysiologischer Sicht als eine Mischform aus Allergie und Autoimmunerkrankung verstanden. Dabei stellt die allergische Komponente in Form der Überempfindlichkeit gegen das körperfremde Eiweiß Gliadin den auslösenden Faktor dar, während für die Ausprägung der Symptome die autoimmunologische Reaktion gegen körpereigene Strukturen verantwortlich ist. Letztlich endet der Entzündungsvorgang in einem programmierten Zelltod (Apoptose) der Enterozyten, der schließlich zu einem mehr oder weniger ausgeprägten Verlust von Dünndarmzotten (Zottenatrophie) führt.[12] Die so geschädigte Dünndarmschleimhaut ist nun wegen der verkleinerten Resorptionsfläche nicht mehr in der Lage, die zugeführten Nährstoffe in ausreichendem Umfang in die Blutbahn zu überführen.
Symptome
Die Ausprägung hinsichtlich der Empfindlichkeit gegen Gluten und der Intensität der Symptome ist individuell verschieden. Einige Menschen zeigen auch beim Verzehr größerer Mengen an glutenhaltigen Lebensmitteln nur leichte Symptome. Auf der anderen Seite gibt es Erkrankte, die selbst auf geringste Spuren von Gluten mit einer schweren Symptomatik reagieren.
Oft wird die Krankheit im frühen Kindesalter entdeckt, wenn die ersten getreidehaltigen Nahrungsmittel eingeführt werden. Dann zeigt sich meist das klassische Erscheinungsbild der Zöliakie mit auffälligen Gedeihstörungen. Die klassischen Symptome einer Zöliakie sind durch die Verdauungsstörung bedingte chronische Durchfälle, zum Teil mit großvolumigen, übelriechenden und durch die gestörte Fettverdauung auch glänzend-klebrigen Stühlen (Steatorrhoe). Betroffene Kinder haben keinen Appetit, erbrechen oft und nehmen nicht oder nicht ausreichend an Gewicht zu. Später kann auch das Längenwachstum beeinträchtigt sein, der Kinderarzt spricht von einer Gedeihstörung. Die Kinder sind missmutig und fallen durch dünne Arme und Beine und besonders durch einen vorgewölbten geblähten Bauch auf.
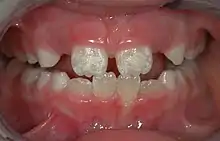
Vielfach wird die Verdachtsdiagnose Zöliakie im Kindesalter durch den Zahnarzt gestellt, wenn Eltern Schmelzdefekte an den Zähnen beim Zahndurchbruch bleibender Zähne beobachten. Sie umfassen Zahnverfärbungen mit weißen, gelben oder braunen Flecken auf den Zähnen, Schmelzhypoplasien, fleckige oder durchscheinend aussehende Zähne. Die Fehlentwicklungen der Zähne treten oft an den Schneidezähnen und Molaren symmetrisch auf. Sie sind von anderen Zahnschäden, die ähnliche Symptome aufweisen können, abzugrenzen. Die Zahnschäden sind bleibend und bilden sich auch nicht nach Beginn einer glutenfreien Diät zurück. Daneben treten häufig eine rezidivierende aphthöse Stomatitis sowie Ulzera und eine atrophische Glossitis auf, die durch eine rote, glatte, glänzende Zunge gekennzeichnet ist und mit Zungenbrennen (Burning-Mouth-Syndrom) verbunden sein kann. Sehr selten entsteht ein Plattenepithelkarzinom am Rachen oder der Mundschleimhaut.[18]
Bei Erwachsenen oder Jugendlichen sind die Symptome oft weniger deutlich ausgeprägt. Hier gibt es stumme Formen mit diffusen Beschwerden. Dazu gehören z. B. chronische Müdigkeit und allgemeines Krankheitsgefühl, Kraftlosigkeit, Nervosität, schmerzende Knochen, trockene Haut oder Blutarmut.
Seitdem die Untersuchung von zöliakiespezifischen Antikörpern im Blut in die Diagnostik eingeführt wurde, hat sich die Erkennung des Krankheitsbildes grundsätzlich gewandelt. Die S2k-Leitlinie zu Zöliakie 2014 unterscheidet die klassische, symptomatische, subklinische, potenzielle und refraktäre Zöliakie.[19] Menschen, bei denen die Zöliakie beispielsweise im Rahmen von Familienuntersuchungen gefunden wurde und die eine fast vollständige Zottenatrophie aufweisen, können die typischen Symptome zeigen (klassische Zöliakie), können aber auch nur schwache und teilweise auch unspezifische Symptome zeigen (symptomatische Zöliakie). Die Tatsache, dass nur ein Teil von ihnen die typischen Symptome der klassischen Zöliakie zeigt, ist unter dem Begriff „Eisbergphänomen“ in die Literatur eingegangen.[11] Bei ihnen treten Bauchschmerzen, paradoxerweise sogar Verstopfung, Wachstumsverzögerungen und verzögerte Pubertät bei Kindern, Verringerung des Kalkgehaltes der Knochen (Osteopenie) durch verminderte Calciumaufnahme (im Blutserum Hypokalzämie), Eisenmangelanämie durch verminderte Eisenresorption, Gelenkentzündungen, Atemwegsinfekte, Defekte des Zahnschmelzes und psychische Auffälligkeiten (Konzentrationsstörungen, Depression) auf.
Neben der klassischen und der symptomatischen Zöliakie werden weitere Verlaufsformen unterschieden: Bei der subklinischen Zöliakie weisen Patienten eine (fast) vollständige Zottenatrophie auf, haben jedoch keine oder nur geringe unspezifische Symptome, insbesondere keine Zeichen einer Ernährungsstörung. Bei der potentiellen Zöliakie bestehen zwar zöliakietypische immunologische Abweichungen, aber keine Zottenatrophie. (Vormals war dieser Begriff Menschen vorbehalten, die trotz zöliakietypischer immunologischer Abweichungen nie die klassischen Veränderungen der Dünndarmschleimhaut aufwiesen, wohingegen der Begriff latente Zöliakie angewandt wurde, wenn zwar früher einmal eine Zottenatrophie unter glutenhaltiger Nahrung bestanden hatte, diese sich aber unter glutenfreier Diät wieder normalisieren konnte und unter erneuter glutenhaltiger Ernährung normal blieb.[11])
| OSLO Klassifikation der Zöliakie (nach S2k Leitlinie 2014[19]) | |||||
|---|---|---|---|---|---|
| Malabsorptions- syndrom |
Unspezifische Symptome | Zöliakie spezif. AK tTG-AK |
HLA DQ2 DG8 |
Marsh[20] 2 oder 3 | |
| Klassische1 | + | +/- | + | + | + |
| Symptomatische2 | - | + | + | + | + |
| Subklinische3 | - | - | + | + | + |
| Potentielle4 | - | - | + | + | - |
| Refraktäre5 | + | +/- | + | + | + |
| Vormals: 1typische - 2atypische/overte - 3subklinische/asymptomatische/silente - 4potentielle/latente 5 nur bei Erwachsenen | |||||
Komorbiditäten
Als Autoimmunerkrankung ist die Zöliakie mit anderen Erkrankungen, bei denen sich das Immunsystem gegen körpereigenes Gewebe richtet, häufig vergesellschaftet. Die häufigsten Begleiterkrankungen einer Zöliakie sind verschiedene neurologische Beschwerden, die aufgrund ihrer selbständigen Pathogenese nicht als Symptom der Zöliakie zu sehen sind, wie beispielsweise die Gluten-Ataxie.[21][22] Die zweithäufigste Begleiterkrankung ist der Diabetes mellitus Typ 1, bei dem Antikörper gegen die insulinproduzierenden Zellen der Bauchspeicheldrüse gebildet werden. Etwa fünf bis zehn Prozent aller Personen mit Zöliakie sind auch an einem Typ-1-Diabetes erkrankt und umgekehrt ebenso etwa der gleiche Anteil Typ-1-Diabetiker an einer Zöliakie. Auch für eine entzündliche Erkrankung der Schilddrüse, die Hashimoto-Thyreoiditis, die ebenfalls als Autoimmunerkrankung gilt, wurde ein wechselseitig gehäuftes Auftreten zusammen mit einer Zöliakie beschrieben. Eher bei Erwachsenen kann es zu Dermatitis herpetiformis Duhring, einem bläschenbildenden Hautausschlag mit starkem Juckreiz, kommen, wobei nur etwa ein Zehntel dieser Patienten Symptome seitens des Magen-Darm-Traktes hat.
Diagnostik
Der Anfangsverdacht ergibt sich aus der Symptomatik (auch unspezifische Beschwerden), der Anamnese (Erhebung der Vorgeschichte) und der körperlichen Untersuchung. Zur weiteren Klärung erfolgt heute meist eine Bestimmung spezifischer Antikörper im Blutserum. Im Zweifelsfall wird zur Sicherung der Diagnose ggf. eine Gewebebiopsie (siehe Histologie) aus dem unteren Zwölffingerdarm entnommen.
Dass die Zöliakie in den Industrienationen heute schätzungsweise ein Prozent der Bevölkerung betrifft,[23] liegt unter anderem daran, dass es leistungsfähige serologische Tests gibt, mit deren Hilfe sich auch atypische Formen der Krankheit diagnostizieren lassen. Da es sich gezeigt hat, dass ein großer Teil der Zöliakie-Patienten nicht unter den klassischen gastrointestinalen Symptomen leidet, hat die European Society of Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN)[24] ihre Richtlinien zur Diagnose Gluten-induzierter Enteropathien erweitert und die spezifischen serologischen Tests aufgenommen.
Serologische Diagnostik
Bei einer Zöliakie kommt es zu immunologischen Reaktionen gegen ein Fremdantigen – das Gliadin aus dem Getreide (Weizen) – und gegen Autoantigene im Endomysium (das ist das zwischen den Skelettmuskelfasern als Gleitgewebe gelegene lockere, an Blutkapillaren reiche, kollagen- und gitterfaserige Bindegewebe), in erster Linie gegen das Enzym Tissue-Transglutaminase (tTg). Die Zöliakie ist also gleichzeitig eine Nahrungsmittelallergie und eine Autoimmunerkrankung und lässt sich mithilfe von Gliadin-Antikörpern und Autoantikörpern gegen Endomysium bzw. tTg nachweisen.
Eine Schwierigkeit beim serologischen Nachweis einer Zöliakie liegt darin, dass bei etwa zehn Prozent der betroffenen Patienten ein IgA-Mangel vorliegt. Das heißt, es lassen sich dann keine IgA-Antikörper nachweisen. Dieses Problem lässt sich jedoch umgehen, indem man nicht nur die IgA-Antikörper bestimmt, sondern zusätzlich den etwas weniger spezifischen IgG-Nachweis durchführt.
Anti-Endomysium
Autoantikörper gegen endomysiale Antigene sind hochspezifisch und lassen sich bei über 90 Prozent der Patienten mit einer Zöliakie nachweisen. Dazu dient ein indirekter Immunfluoreszenztest an Gewebeschnitten aus Affenösophagus (Ösophagus = Speiseröhre). Diese Technik erfordert besonders ausgebildetes Laborpersonal, das Erfahrung mit der Auswertung der Immunfluoreszenzmuster hat.
Die Anti-Endomysium-Konzentrationen spiegeln das histologische Erscheinungsbild wider: Je höher die Antikörpertiter sind, desto ausgeprägter ist auch die Zottenatrophie. Darüber hinaus gehen auch die Anti-Endomysium-Titer bei Einhaltung einer glutenfreien Diät deutlich zurück. Sie können also, wie auch die Gliadin-Antikörper (siehe Gliadin-Antikörper), ebenfalls bei der Therapieüberwachung hilfreich sein.
Anti-Tissue-Transglutaminase
Der Anti-Endomysium-Nachweis mittels der Immunfluoreszenz-Technik fordert besondere technische Fertigkeiten der Anwender, dauert lange und benötigt relativ rares biologisches Material. Deshalb war es ein großer Fortschritt, als man das Enzym Tissue-Transglutaminase (tTg, deutsch: Gewebe-Transglutaminase) als Hauptantigen im Endomysium identifizierte.
tTg gehört zu einer Familie calciumbindender Enzyme, die Glutamin- und Lysinreste in Polypeptidketten miteinander verbinden und so Proteine quervernetzen. Der Nachweis von tTG-Antikörpern im ELISA hat sich mittlerweile zum Goldstandard in der Zöliakie-Diagnostik entwickelt.
Aktuelle klinische Studien zeigen, dass ein Anti-Tissue-Transglutaminase-Screening im ELISA, das zugleich IgA- und IgG-Antikörper erfasst, eine sensitive und spezifische Alternative zum Nachweis von Endomysium-Antikörpern mit der Immunfluoreszenz darstellt, und favorisieren einen tTG-ELISA als diagnostisches Werkzeug für die Zöliakie.[25]
Gliadin-Antikörper
Der Nachweis von Antikörpern gegen Gliadin war historisch gesehen die erste Möglichkeit, um eine Zöliakie mithilfe eines Antikörper-Testverfahrens zu erkennen. Die Detektion von Gliadin-Antikörpern ist zwar sehr empfindlich, insbesondere wenn man sowohl IgG- als auch IgA-Antikörper bestimmt, der Nachweis ist aber nicht sehr spezifisch. Gliadin-Antikörper treten auch bei Allergikern (Atopikern) oder Personen mit anderen Autoimmunerkrankungen und bei etwa fünf Prozent der gesunden Bevölkerung auf.
Gliadinantikörper spielen deshalb bei der Diagnostik einer Zöliakie nur noch eine untergeordnete Rolle. Wichtig sind sie aber nach wie vor bei der Therapieüberwachung: Bei strikter Einhaltung einer glutenfreien Diät sinken die Anti-Gliadin-Konzentrationen gleichzeitig mit dem Abklingen der Krankheitssymptome ab.
Seit dem Jahr 2004 werden zahlreiche serologische Tests erprobt, in denen verschiedene Formen des Gliadins als Zielantigene verwendet werden.[26][27] Ob diese Tests, die meist aufwändig gentechnologisch hergestellt werden, ähnlich leistungsfähig und ähnlich spezifisch sind wie der etablierte Nachweis von Antikörpern gegen tTG, bleibt abzuwarten. Gemäß den Richtlinien der ESPGHAN muss das Ergebnis der serologischen Tests ohnehin immer durch eine Dünndarmbiopsie bestätigt werden, um die endgültige Diagnose stellen zu können.
Üblicherweise werden Antikörper gegen Gliadin vom IgA und IgG-Typ (AGA IgA und IgG), Endomysiumantikörper (EMA) vom IgA-Typ (= Autoantikörper gegen die Gewebstransglutaminase (tTG-A)) bestimmt. Letztere weisen mit 87,4–98,2 % die höchste Spezifität (bei positivem Testergebnis liegt auch tatsächlich eine Erkrankung vor) und mit 86,5 bis 97,2 Prozent die höchste Sensitivität (ein hoher Anteil der Erkrankten wird durch den Test erkannt) auf. Die tTG-Antikörper sind jedoch immer vom IgA-Typ. Da aber bis zu 11 Prozent der Zöliakie-Patienten gleichzeitig nicht in der Lage sind, ausreichend IgA zu produzieren (IgA-Mangel), muss immer auch die Gesamtkonzentration an IgA mitbestimmt werden, damit man falsch-negative Befunde nicht übersieht. Außerdem muss bedacht werden, dass bei Kindern unter zwei Jahren die Sensitivität der EMA nur etwa 80 Prozent beträgt. In diesem Alter haben deshalb die Gliadin-Antikörper (AGA vom IgA- und IgG-Typ) besondere diagnostische Bedeutung. Die Antikörperbestimmungen eignen sich auch zur Verlaufskontrolle unter glutenfreier Diät, da ihre Konzentrationen mit zunehmender Therapiedauer unter die Nachweisgrenze absinken.[28]
Histologie
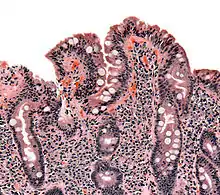
Wird der Verdacht auf das Vorliegen einer Zöliakie durch positive Antikörperbefunde erhärtet, kann die Diagnose entsprechend den Empfehlungen der Europäischen Gesellschaft für pädiatrische Gastroenterologie, Hepatologie und Ernährung (ESPGHAN) durch eine Dünndarmbiopsie gesichert werden. Dabei werden – heutzutage zumeist mittels einer Magen- und teilweisen Dünndarmspiegelung (Gastroduodenoskopie) – kleine Schleimhautproben aus dem absteigenden Duodenum entnommen. Es gelingt nicht immer, die geeignete Lokalisation zur Biopsie zu finden. Die entnommenen Gewebestücke werden von einem Pathologen feingeweblich am Mikroskop untersucht, wobei zunächst bei geringer Vergrößerung (50fach) der Aufbau der Dünndarmschleimhaut beurteilt wird. Bei stärkerer Vergrößerung wird anschließend untersucht, ob die Schleimhaut eine Vermehrung von Entzündungszellen aufweist. Für die Diagnose einer Zöliakie sind hierbei die innerhalb der Deckschicht (Epithel) gelegenen Lymphozyten entscheidend. Bei grenzwertigen Befunden kann die histologische Standardfärbung noch um eine Immunhistologie erweitert werden, mit der sich die intraepithelialen Lymphozyten besser quantifizieren lassen. Goldstandard für die Beurteilung der Dünndarmbiopsie sind die sogenannten Marsh-Kriterien: Zahl der in die Schleimhaut eingewanderten Lymphozyten, Zottenlänge im Verhältnis zu den Krypten, Zellteilungsrate, Anzahl der Entzündungszellen in der Lamina propria (Darmwandschicht direkt unterhalb des Epithels) und Beurteilung des Bürstensaums in einer speziellen Färbung (PAS-Färbung). Für die Diagnose Zöliakie sind die Marsh 2- oder Marsh 3-Kriterien erforderlich:
- Marsh 2: ≥ 25 intraepitheliale Lymphozyten / 100 Enterozyten + Hyperplasie der Lieberkühn-Krypten
- Marsh 3: ≥ 25[29][30] intraepitheliale Lymphozyten / 100 Enterozyten + Kryptenhyperplasie + Zottenatrophie.
Eine andere, beispielsweise infektiöse Ursache der Entzündung sollte durch eine Suche nach Mikroorganismen wie Tropheryma whipplei, Giardien und Kryptosporidien ausgeschlossen werden. Die 1990 revidierten diagnostischen Kriterien der ESPGHAN fordern zudem eine klare klinische Besserung nach Einleitung der Therapie. Kontrollbiopsien, die früher noch üblich waren, sind demnach nur bei spezieller Indikation angezeigt wie zweifelhaftem klinischem Erfolg unter glutenfreier Diät, Zweifel an der Initialdiagnose oder zur Abgrenzung gegen eine vorübergehende Glutenintoleranz.[11]
Differentialdiagnose
Obwohl das Krankheitsbild bei typischem Verlauf recht eindeutig ist, ergeben sich selbst aus einer anscheinend typischen, aber eben nicht spezifischen Histologie der Dünndarmschleimhaut noch einige mögliche Differentialdiagnosen. Auch Nahrungsmittelallergien (vor allem Kuhmilch- und Sojaeiweiß) oder verschiedene Infektionen des Darmtraktes können zu einer ähnlichen Schleimhautschädigung führen. Weitere seltene Ursachen für Nahrungsmittelunverträglichkeiten, Durchfallerkrankungen u. a. sind andere autoimmune Magen-Darm-Erkrankungen, Immundefekte, AIDS, Abstoßungsreaktionen nach Transplantation, Bestrahlung oder Behandlung mit Zytostatika, erhebliche Mangelernährung oder die sehr seltene Mikrovillusatrophie des Kleinkindes.
Eine weitere wichtige Differentialdiagnose ist die zystische Fibrose, die durch den Schweißtest (Pilocarpin-Iontophorese-Test) durch den gemessenen Chlorid-Gehalt im Schweiß, ausgeschlossen werden sollte. Weiterhin sollte an angeborene Pankreasinsuffizienz, angeborene intestinale Enzymdefekte (beispielsweise Laktase- oder Saccharasemangel), tropische Sprue, kollagene Sprue, Morbus Crohn und Morbus Whipple gedacht werden.[31]
Im Zweifelsfall kann probeweise eine glutenfreie Diät vorgeschlagen werden. Ein Erfolg mit Verschwinden der Beschwerden wäre ein Hinweis auf Zöliakie oder eine häufiger vorkommende Unverträglichkeit gegenüber anderen Proteinen.[32]
Risikopatienten
Bei folgenden Problemen ist besonderes Augenmerk darauf zu richten, ob eine Zöliakie vorliegen könnte: Verwandte 1. Grades von Zöliakiekranken, Diabetes mellitus Typ 1, selektiver IgA-Mangel, Morbus Down (Trisomie 21), Turner-Syndrom, Williams-Beuren-Syndrom, Dermatitis herpetiformis Duhring, Vitiligo, autoimmune Schilddrüsenerkrankungen, Autoimmunhepatitis, rheumatoide Arthritis.[16][33]
Prävention
Um das Risiko für das Auftreten einer Zöliakie zu minimieren, empfiehlt die Europäische Gesellschaft für pädiatrische Gastroenterologie, Hepatologie und Ernährung (ESPGHAN) auf der Basis von Studiendaten, Gluten in der Säuglingsernährung nicht vor Abschluss des vierten Lebensmonats einzusetzen.[34]
Eine Studie aus dem Jahr 2019 belegt, dass eine ballaststoffreiche Ernährung der werdenden Mutter in der Schwangerschaft das Zöliakie-Risiko des Kindes senken kann.[35]
Behandlung
Die einzige gesicherte Möglichkeit, die Krankheit zu behandeln, ist eine lebenslange glutenfreie Diät, wodurch sich die Darmschleimhaut wieder erholt und auch die Risiken der Langzeitfolgen sinken. Gleichzeitig sollte auf eine nährstoffreiche Ernährung geachtet werden, da es durch die Dünndarmschädigung leicht zu Mängeln an wichtigen Nährstoffen kommt. Strikt zu vermeiden sind alle Getreidesorten mit hohem Glutengehalt (Weizen, Gerste, Roggen wie auch deren botanisch verwandte Ursorten Dinkel, Grünkern, Kamut, Einkorn, Emmer sowie die Roggen-Weizen-Kreuzung Triticale). Bislang ist auch der Verzicht auf die Grasgattung Hafer empfohlen, obwohl sich die chemische Zusammensetzung der Prolamine von der bei Weizen unterscheidet und Hafer in Finnland und England für erwachsene Menschen mit Zöliakie in moderaten Mengen und unter ärztlicher Kontrolle freigegeben wurde.[36] Insbesondere bei verarbeiteten Lebensmitteln und Fertigprodukten muss genau darauf geachtet werden, dass keine glutenhaltigen Zutaten verwendet wurden. Da Gluten gerne als Emulgator, zum Gelieren, Stabilisieren und als Träger von Aromastoffen eingesetzt wird, ist dies nicht immer leicht zu erkennen. Eine Übersicht zu glutenfreien Lebensmitteln ist über die Deutsche Zöliakiegesellschaft e. V. (DZG) zu beziehen.[37]

Als Alternative zu glutenhaltigem Getreide geeignet sind Hirse, Mais, Reis, Wasserreis („Wildreis“),[38] Amarant, Tapioka, Buchweizen, Quinoa, Sojabohnen, Teff, Kastanie, Kochbanane. Ein Teil dieser Arten wird beispielsweise auch zur Herstellung von glutenfreiem Bier verwendet. Ohnehin erlaubt sind Gemüse und Kartoffeln, Salate, Früchte, Fleisch und Fisch, Eier, Milch und Milchprodukte.
Forscher konnten einen gentechnisch veränderten Weizen entwickeln, aus dessen Mehl weiterhin Brot gebacken werden kann, ohne dass die für Zöliakie relevanten Gluten-Proteine enthalten sind. Aus dem Genom der Weizensorte Chinese Spring wurden die relevanten Gensequenzen zur Proteinexpression von Gluten entfernt, so dass die Epitope der Klebereiweiße von den menschlichen Antikörpern nicht mehr erkannt werden können.[39]

Glutenfreie Speziallebensmittel erhielt man zunächst nur in Reformhäusern, später auch in Fachgeschäften für glutenfreie Ernährung und in einzelnen regulären Lebensmittelgeschäften. Inzwischen finden sich glutenfreie Frisch- und Fertigprodukte auch im allgemeinen Lebensmittelhandel.
Laut dem Codex Alimentarius Standard 118-1981 beträgt der Grenzwert für glutenfreie Produkte 20 ppm (= 20 mg/kg).[40] In Deutschland produzierte glutenfreie Lebensmittel halten in der Regel den 20 ppm-Grenzwert ein. Da zu Beginn der Therapie bei einigen Patienten durch die ausgedehnte Schädigung der Schleimhaut auch die Milchzucker-Verdauung beeinträchtigt sein kann (sekundäre Laktoseintoleranz), müssen diese vorübergehend auch auf eine milchzuckerarme Ernährung achten. Insbesondere Milch und Milchprodukte können durch Sojamilch ersetzt werden.[36]
Forschung
Ein 2006 vorgestellter Forschungsansatz zur Entwicklung einer weiteren Behandlungsmöglichkeit der Zöliakie bestand in einer Enzymersatztherapie. Aus keimendem Getreide oder einem Pilz isolierte Enzyme konnten das Gluten in kleine Stücke zerschneiden, so dass die Bruchteile vom Immunsystem nicht mehr erkannt und dementsprechend keine Entzündung mehr ausgelöst werden könne.[41] (Bis 2014 finden sich keine weiteren Publikationen zu dieser Therapie, und auch die AWMF-Leitlinie von 2009 erwähnt diese Therapieform nicht.[42])
Als eine Enzymkombination, die eine Glutenverdauung unter Darmbedingungen ermöglichen könnte, wird zum Beispiel eine Kombination aus einer glutaminspezifischen Endoprotease (EP-B2 aus Gerste) und einer Prolylendopeptidase (SC PEP aus Sphingomonas capsulata) genannt.[43]
Eine 2011 vorgestellte Labormethode erlaubt, die Bewertung verschiedener Enzyme (Prolylendopeptidase) hinsichtlich Stabilität und Wirkung im Verdauungstrakt in Echtzeit zu verfolgen. Dank dieses Verfahrens konnten einige entscheidende Unterschiede zwischen Enzymen ähnlicher Art festgestellt werden, die bei Untersuchungen im Reagenzglas verborgen geblieben sind.[44]
Einige der Behandlungsansätze sind Gegenstand klinischer Studien in Phase II.[45][46]
EU-Verordnung
Die Verordnung (EG) Nummer 41/2009 befasste sich mit der Zusammensetzung und Kennzeichnung von Lebensmitteln (Ausnahme: Säuglingsanfangs- und -folgenahrung), die für Menschen mit einer Glutenunverträglichkeit geeignet sind. Die EU-Verordnung ließ bestimmte Glutenhöchstgehalte in den betreffenden Lebensmitteln zu, da es technisch sehr schwierig ist, vollständig glutenfreie Lebensmittel zu produzieren. Mögliche Deklarationsstufen bei Lebensmitteln, die für Menschen mit Glutenunverträglichkeit angeboten werden, waren laut dieser Verordnung:
- „sehr geringer Glutengehalt“: Es dürfen höchstens 100 mg Gluten pro Kilogramm Lebensmittel enthalten sein
- „glutenfrei“: Der Höchstgehalt an Gluten beträgt 20 mg/kg
- „Lebensmittel mit Hafer“: maximal 20 mg/kg Gluten. Der Hafer muss so hergestellt sein, dass Verunreinigungen mit Gerste, Roggen, Weizen und deren Kreuzungen ausgeschlossen sind.
Diese Verordnung trat zum 1. Januar 2012 in Kraft,[47] wurde aber durch die Verordnung (EU) Nr. 609/2013 vom 12. Juni 2013[48] außer Kraft gesetzt.
Geschichte
Der Ausdruck Zöliakie leitet sich vom altgriechischen κοιλία koilia, deutsch ‚Bauch‘, ‚Unterleib‘ (von κοίλος koilos, deutsch ‚hohl‘) ab. Die „bauchige Krankheit“ wurde von Aretaios von Kappadokien schon im zweiten Jahrhundert nach Christus erwähnt. Im Jahr 1725 starb Christian Henrich Heineken nach mehrmonatiger Leidensphase vermutlich an der seinerzeit unbekannten Zöliakie. Allgemein gilt Samuel Gee als Erstbeschreiber der Krankheit. Er berichtete 1888 von der „coeliac affection“ und meinte damit eine Verdauungsstörung, die vor allem Kleinkinder betraf. Erst 1950 wurde schließlich von Willem Karel Dicke das Weizengliadin als entscheidender schädlicher Faktor identifiziert.[49] Erste Untersuchungen publizierte Dicke bereits 1941, nachdem ihm plötzliche Verbesserungen des Zustands an Zöliakie (seinerzeit als Gee-Herter-Syndrom bezeichnet) leidender Kinder aufgefallen waren, nachdem sie infolge der Mangelversorgung während des Krieges kaum mehr Getreideprodukte erhielten.[50] Die Zottenatrophie wurde von Margot Shiner aus London 1957 erstmals beschrieben. Ein Jahr später erfolgte mit der Erstbeschreibung der Gliadin-Antikörper durch E. Berger aus Basel die Einführung der serologischen Diagnostik.
Die neuen Erkenntnisse über das Krankheitsbild führten erstmals 1969 zur Verabschiedung der diagnostischen Kriterien für die Zöliakie durch die Europäische Gesellschaft für pädiatrische Gastroenterologie, Hepatologie und Ernährung (ESPGHAN), die sogenannten „Interlaken-Kriterien“. Diese gelten heute in der revidierten Fassung von 1990. Aus den 1980er Jahren datiert die Entdeckung der Endomysium-Antikörper als hochspezifischem serologischem Marker. Schließlich wurde 1997 die Gewebetransglutaminase (tTG) als entscheidendes Antigen für diese Antikörper erkannt.[11]
Sonstiges
Im Jahre 2016 startete das Projekt „Focus IN CD“ - Innovative patient centered health care services - advantages of establishing a close CE network in celiac disease patient health care, das überwiegend aus Mitteln des Europäischen Regionalentwicklungsprogramms "Interreg Central Europe" und anderer gemeinnütziger Träger über einen Zeitraum von 36 Monaten gefördert wird (Projektnummer CE111).[51] Das Insgesamt sind 12 Partnerinstitutionen aus den Bereichen Medizin und Forschung, Patientenselbsthilfe, Projektentwicklung und Verwaltung beteiligt, die das Projekt in Slowenien, Deutschland, Ungarn, Kroatien und Italien umsetzen. Projektpartner in Deutschland sind das Klinikum der Universität München (Dr. von Haunersches Kinderspital) sowie die Stiftung Kindergesundheit. Hauptziel von Focus IN CD ist es, anhand von verschiedenen Teilprojekten die Versorgung von Patienten mit Zöliakie in Zentraleuropa wesentlich und nachhaltig zu verbessern. Insbesondere die Wissensvermittlung zu Zöliakie und glutenfreier Ernährung steht dabei im Mittelpunkt, um sowohl Ärzte und medizinisches Personal als auch die Patienten selbst besser über Zöliakie zu informieren und so mehr Sicherheit für die Zöliakiebetroffenen zu schaffen. Dazu wurde 2018 ein erster Online-Kurs für Patienten mit Zöliakie mit dem Titel Zoeliakie-verstehen.de veröffentlicht, der ausführliche, unabhängige und aktuelle Informationen zu Zöliakie anschaulich darstellt.[52]
Seit 2002 findet in der Regel am dritten Wochenende im Mai der Welt-Zöliakie-Tag (WZT) statt. Er ist von der Dachorganisation der Europäischen Zöliakie-Gesellschaften (AOECS – Association of European Coeliac Societies) ins Leben gerufen worden. Mit vielfältigen Aktionen soll an diesem Tag das Thema „Zöliakie und glutenfreie Ernährung“ einer möglichst breiten Öffentlichkeit näher gebracht werden. In Deutschland wird der WZT von der Deutschen Zöliakie-Gesellschaft (DZG) veranstaltet.[53]
Darüber hinaus findet im Wechsel mit dem Welt-Zöliakie-Tag jedes zweite Jahr das glutenfreie Oktoberfest statt, das ebenfalls von der Deutschen Zöliakie-Gesellschaft (DZG) ausgerichtet wird.[54]
Siehe auch
- Gluten-Ataxie, neurodegenerative Autoimmunerkrankung charakterisiert durch Bewegungsstörungen
- Dermatitis herpetiformis Duhring, bläschenbildende Hauterkrankung mit Juckreiz
- Nicht-Zöliakie-Nicht-Weizenallergie-Weizensensitivität, noch weitgehend eine Ausschlussdiagnose
Literatur
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS): Zöliakie, Weizenallergie und Weizensensitivität; Stand: 30. April 2014, gültig bis 30. April 2019
- W. Holtmeier, W. F. Caspary: Celiac disease. In: Orphanet Journal of Rare Diseases. London 1.2006, 3. doi:10.1186/1750-1172-1-3 PMID 16722573 ISSN 1750-1172 (Open Access).
- Alessio Fasano: Autoimmunkrankheiten. Fatale Darmkrankheit Zöliakie. In: Spektrum der Wissenschaften Mai 2010 (pdf, abgerufen am 11. Juni 2018).
- W. Kiess: Therapie in der Kinder- und Jugendmedizin. Urban & Fischer, Elsevier, München 2007, ISBN 978-3-437-23200-8.
- S2K-Leitlinie Zöliakie: S2K-Leitlinie Zöliakie (Stand: 04/2014)
Weblinks
- Mikroskopisches Präparat bei Sprue auf PathoPic
- Wissenschaftlicher Übersichtsartikel der American Academy of Family Physicians (englisch)
- Website der Deutschen Zöliakie-Gesellschaft
- Website der Österreichischen Arbeitsgemeinschaft Zöliakie
- Website der Gesellschaft für Pädiatrische Gastroenterologie und Ernährung
- Website des Deutschen Ernährungsberatungs- und -informationsnetzes (DEBInet)
Einzelnachweise
- https://www.niddk.nih.gov/health-information/digestive-diseases/celiac-disease?dkrd=hispf0095
- https://nationalceliac.org/celiac-disease-questions/gluten-allergy/
- www.netdoktor.de: Zoeliakie.
- J.F. Ludvigsson, F. Zingone, T. Tomson, A. Ekbom, C. Ciacci: Risk of epilepsy in celiac disease. In: Neurology. Band 78, Nr. 18, 1. Mai 2012, S. 1401–1407, doi:10.1212/WNL.0b013e3182544728 (englisch).
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS): Zöliakie, Weizenallergie und Weizensensitivität; Leitlinie; Stand: 30. April 2014, gültig bis 30. April 2019, S. 42.
- Zöliakie, duden.de
- coeliacus, zeno.org
- Celiaki och gluten, kotus.fi (auf Schwedisch)
- Jacqueline Coutts, Richard Fielder: Management of Food Allergens. Wiley-Blackwell, ISBN 1-4051-6758-0, S. 157 ff.
- https://www.gen-ethisches-netzwerk.de/zukunft-kleine-brotchen
- R. Keller: Klinische Symptomatik „Zöliakie, ein Eisberg“. In: Monatsschrift Kinderheilkunde. Heidelberg 151.2003, 706–714. ISSN 0026-9298
- K. P. Zimmer: Pathophysiologie der Zöliakie. In: Monatsschrift Kinderheilkunde. Heidelberg 151.2003, 698–705. ISSN 0026-9298
- Alberto Rubio–Tapia, Robert A. Kyle, Edward L. Kaplan, Dwight R. Johnson, William Page, Frederick Erdtmann, Tricia L. Brantner, W. Ray Kim, Tara K. Phelps, Brian D. Lahr, Alan R. Zinsmeister, L. Joseph Melton, Joseph A. Murray: Increased Prevalence and Mortality in Undiagnosed Celiac Disease. In: Gastroenterology. Vol. 137, Nr. 1, 2009, S. 88–93, ISSN 0016-5085, doi:10.1053/j.gastro.2009.03.059
- M. F. Kagnoff: Celiac disease: pathogenesis of a model immunogenetic disease. In: J Clin Invest. 2007; 117(1), S. 41–49.
- Jürgen F. Riemann: Gastroenterologie: das Referenzwerk für Klinik und Praxis. Georg Thieme Verlag, 2007, ISBN 978-3-13-141201-0, S. 681.
- Diagnostik und Therapie der Zöliakie. In: Deutsches Ärzteblatt Online. 2013, abgerufen am 3. Februar 2014.
- Romain Bouziat, Reinhard Hinterleitner, Judy J. Brown, Jennifer E. Stencel-Baerenwald, Mine Ikizler: Reovirus infection triggers inflammatory responses to dietary antigens and development of celiac disease. In: Science. Band 356, Nr. 6333, 7. April 2017, ISSN 0036-8075, S. 44–50, doi:10.1126/science.aah5298, PMID 28386004 (sciencemag.org [abgerufen am 11. April 2017]).
- Dental Enamel Defects and Celiac Disease (Memento vom 5. März 2016 im Internet Archive), The National Institutes of Health Celiac Disease Awareness Campaign. NIH Publication No. 11–7397, April 2011. Abgerufen am 17. Juni 2016.
- S2k Leitlinie Zöliakie: Neue Leitlinie 2014. DGVS, abgerufen am 14. Dezember 2014. S. 15.
- Klassifizierung der Zöliakie nach Marsh. DZG, abgerufen am 14. Dezember 2014.
- Elizabeth Mearns, Aliki Taylor, Kelly Thomas Craig, Stefanie Puglielli, Daniel Leffler: Neurological Manifestations of Neuropathy and Ataxia in Celiac Disease: A Systematic Review. In: Nutrients. Band 11, Nr. 2, 12. Februar 2019, ISSN 2072-6643, S. 380, doi:10.3390/nu11020380, PMID 30759885, PMC 6412791 (freier Volltext) – (mdpi.com [abgerufen am 20. Juli 2020]).
- Giovanni Casella, Bianca M. Bordo, Renzo Schalling, Vincenzo Villanacci, Marianna Salemme: Neurological disorders and celiac disease. In: Minerva Gastroenterologica E Dietologica. Band 62, Nr. 2, Juni 2016, ISSN 1827-1642, S. 197–206, PMID 26619901 (nih.gov [abgerufen am 20. Juli 2020]).
- P. H. Green, C. Cellier: Celiac disease. In: N Engl J Med. 2007; 357(17), S. 1731–1743.
- espghan.med.up.pt (Memento des Originals vom 9. September 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Website European Society of Pediatric Gastroenterology and Nutrition
- D. Villalta, M. G. Alessio, M. Tampoia u. a.: Testing for IgG class antibodies in celiac disease patients with selective IgA deficiency. A comparison of the diagnostic accuracy of 9 IgG anti-tissue transglutaminase, 1 IgG anti-gliadin and 1 IgG anti-deaminated gliadin peptide antibody assays. In: Clin. Chim. Acta. Band 382, Nr. 1-2, Januar 2007, S. 95–99, doi:10.1016/j.cca.2007.03.028, PMID 17490629.
- Schwertz u. a.: Serological assay based on gliadin-related nonapeptides as a highly sensitive and specific diagnostic aid in celiac disease. In: Clin Chem. 2004; 50, S. 2370–2375.
- D. Agardh: Antibodies against synthetic deamidated gliadin peptides and tissue transglutaminase for the identification of childhood celiac disease. In: Clin Gastroenterol Hepatol. 2007; 5(11), S. 1276–1281.
- S. Buderus, M. J. Lentze: Serologische Diagnostik der Zöliakie. In: Monatsschrift Kinderheilkunde. Heidelberg 151.2003, S. 715–718. ISSN 0026-9298
- Vincenzo Villanacci, Paola Ceppa, Enrico Tavani, Carla Vindigni, Umberto Volta: Coeliac disease: The histology report. In: Digestive and Liver Disease. Band 43, März 2011, S. S385–S395, doi:10.1016/S1590-8658(11)60594-X (elsevier.com [abgerufen am 15. Dezember 2020]).
- S. Pellegrino, V. Villanacci, N. Sansotta, R. Scarfì, G. Bassotti: Redefining the intraepithelial lymphocytes threshold to diagnose gluten sensitivity in patients with architecturally normal duodenal histology: Mild enteropathy coeliac disease. In: Alimentary Pharmacology & Therapeutics. Band 33, Nr. 6, März 2011, S. 697–706, doi:10.1111/j.1365-2036.2011.04578.x (wiley.com [abgerufen am 15. Dezember 2020]).
- Säuren – Basen – Schlacken. Springer, Wien 2007, ISBN 978-3-211-29133-7.
- Monika Kovacsics: Ursachen der Gluten-Unverträglichkeit. Odysso, 29. September 2011; 3sat Nano, 8. Februar 2012.
- awmf.org (Memento vom 24. Mai 2012 im Internet Archive)
- Hania Szajewska et al.: Gluten Introduction and the Risk of Coeliac Disease: A Position Paper by the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. In: Journal of Pediatric Gastroenterology and Nutrition 2016 Mär; 62(3):507–513. doi:10.1097/MPG.0000000000001105, PMID 26815017, http://www.espghan.org/fileadmin/user_upload/guidelines_pdf/Hep_Nutr/Gluten_Introduction_and_the_Risk_of_Coeliac.32.pdf.
- James Butcher: High fiber during pregnancy reduces risk of celiac disease in children, research finds. In: EurekAlert! 6. Juni 2019, abgerufen am 16. Juni 2019 (englisch).
- A. van Teeffelen-Heithoff: Diätetische Grundlagen der Zöliakiebehandlung. In: Monatsschrift Kinderheilkunde. Heidelberg 151.2003, S. 719–725. ISSN 0026-9298, doi:10.1007/s00112-003-0750-x
- Übersicht zur Auswahl glutenfreier Lebensmittel (PDF). Abgerufen am 28. August 2019
- DZG aktuell. 2005,1, S. 29. ISSN 0947-5222
- Hetty C van den Broeck, Teun WJM van Herpen, Cees Schuit, Elma MJ Salentijn, Liesbeth Dekking, Dirk Bosch, Rob J Hamer, Marinus JM Smulders, Ludovicus JWJ Gilissen, Ingrid M van der Meer: Removing celiac disease-related gluten proteins from bread wheat while retaining technological properties: a study with Chinese Spring deletion lines. In: BMC Plant Biology. 9, 2009, S. 41, doi:10.1186/1471-2229-9-41
- CODEX STANDARD FOR FOODS FOR SPECIAL DIETARY USE FOR PERSONS INTOLERANT TO GLUTEN. (PDF; 39 kB) CODEX STAN 118-1979. (Nicht mehr online verfügbar.) In: Codex Alimentarius. Archiviert vom Original am 15. September 2012; abgerufen am 16. November 2012 (englisch).
- Süddeutsche Zeitung. München 176.2006, S. 16. ISSN 0174-4917
- Zöliakie. (Memento vom 24. Mai 2012 im Internet Archive) Leitlinien der Gesellschaft für Pädiatrische Gastroenterologie und Ernährung 2009, abgerufen am 3. Februar 2014.
- Jonathan Gass, Michael T. Bethune, Matthew Siegel, Andrew Spencer, Chaitan Khosla: Combination Enzyme Therapy for Gastric Digestion of Dietary Gluten in Patients With Celiac Sprue. In: Gastroenterology. Vol. 133, Nr. 2, 2007, S. 472–480, ISSN 0016-5085, PMID 17681168, doi:10.1053/j.gastro.2007.05.028
- G. Fuhrmann, J. C. Leroux: In vivo fluorescence imaging of exogenous enzyme activity in the gastrointestinal tract. In: Proceedings of the National Academy of Sciences. 108 (2011), S. 9032–9037 (online)
- Rohini R. Vanga: Novel Therapeutic Approaches for Celiac Disease. In: Discovery Medicine. 22. Mai 2014.
- Marja-Leena Lähdeaho, Katri Kaukinen, Kaija Laurila, Pekka Vuotikka, Olli-Pekka Koivurova, Tiina Kärjä-Lahdensuu, Annette Marcantonio, Daniel C. Adelmanm Markku Mäki: Glutenase ALV003 Attenuates Gluten-Induced Mucosal Injury in Patients With Celiac Disease. In: Gastroenterology. Vol. 146, Nr. 7, 2014, S. 1649–1658, ISSN 0016-5085, PMID 24583059, doi:10.1053/j.gastro.2014.02.031
- Verordnung (EG) Nr. 41/2009
- Verordnung (EU) Nr. 609/2013
- Willem Karel Dicke: Een onderzoek naar de nadelige invloed van sommige graansoorten op de lijder aan Coeliakie. Dissertation. Utrecht 1950.
- Willem Karel Dicke: Simple dietary treatment for the syndrome of Gee-Herter. In: Nederlands Tijdschrift voor Geneeskunde. Band 85 (1941), S. 1715–1716.
- Focus IN CD: Focus IN CD - a project to improve the management of celiac disease care in central Europe. (Nicht mehr online verfügbar.) Focus IN CD, ehemals im Original; abgerufen am 22. Januar 2019 (englisch). (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Focus IN CD: Zöliakie verstehen. Abgerufen am 22. Januar 2019.
- DZG: Welt-Zöliakie-Tag - Aktionen der DZG in Deutschland. Abgerufen am 22. Januar 2019.
- Glutenfreies Oktoberfest. Abgerufen am 22. Januar 2019.
