Zahnfluorose
Zahnfluorose, (auch: Dentalfluorose, Colorado Brown Stain oder Texas Teeth; aus Fluor und -ose altgriechisch -ωσις, Medizin: meist eine nichtentzündliche Erkrankung; engl.: Mottled teeth bzw. Mottling, gesprenkelte Zähne), entsteht durch chronische, zu hohe Fluoridzufuhr während der ontogenetischen Entwicklung der Zähne.
| Klassifikation nach ICD-10 | |
|---|---|
| K00.3 | Schmelzflecken [Mottled teeth]; Dentalfluorose; Gefleckter Zahnschmelz |
| ICD-10 online (WHO-Version 2019) | |
.png.webp)
Während Fluorid in einer Dosierung von ca. 1 mg/Tag als ein wirksames Mittel zur Prophylaxe der Karies (Fluoridierung) angesehen wird, kann es in höheren Dosen (über 2 mg/Tag) eine Zahnfluorose erzeugen, bei der sich – je nach Schwere – weiße bis braune Verfärbungen in Form von Flecken oder Streifen auf der Zahnschmelzoberfläche bis zu massiven Defekten mit Substanzverlust bilden.[1] Hierbei sind insbesondere die bukkalen Zahnflächen betroffen. In stärkerer Ausprägung ist dies nicht nur kosmetisch störend, sondern auch schädlich für die Zähne, da die Zahnschmelzoberfläche dadurch weniger widerstandsfähig wird.[2]
Grundlagen
Hydroxylapatit bildet die Grundlage der Hartsubstanz aller Wirbeltiere. Es ist in Knochen zu einem Anteil von etwa 40 %, im Zahnbein (Dentin) zu 70 % und im Zahnschmelz (Enamelum) zu 97 % enthalten. Zahnschmelz wird von Adamantoblasten (Ameloblasten, schmelzbildenden Zellen) gebildet. Diese Zellen sezernieren zunächst eine bindegewebige Substanz (Präenamelum). Nach dem Zahndurchbruch vollzieht sich der Hauptteil der Mineralisation: Durch Einlagerung von Ca2+-Ionen und Phosphaten in Form von Apatit erlangt der Zahnschmelz seine endgültige Härte.
Wird Zahnschmelz bei einem pH < 5,5 in Lösung gebracht, so demineralisiert er. Dies geschieht im Mund durch bakterielle Säuren und Fruchtsäuren, wobei aus Hydroxylapatit unter Einfluss von Säuren ionisches Calcium, Phosphat und Wasser entstehen:
Ca5(PO4)3(OH) + H3O+ → 5 Ca2+ + 3 (PO4)3- + 2H2O
Intoxikation mit Spurenelementen
Die professionelle Exposition gegenüber Phosphor, Blei, Wismut, Strontium und Fluor kann toxische Osteopathien mit Hyperostose und Spongiosklerose auslösen. In Tierversuchen hat man auch mit Gabe von Cadmium-Salzen Zahnveränderungen wie bei der Fluorose sowie Einflüsse auf den Eisen-Stoffwechsel (wie auch nach Fluorid-Fütterung) festgestellt.[3][4][5][6][7][8][9] Beim Menschen können permanente Zahnschäden durch diese Stoffe aber nur bei Einwirkung während der Entwicklung der Zähne in Frage kommen. Damit begrenzen sich Intoxikationen auf Strontium und Fluor im Trinkwasser sowie auf Überdosierung von Fluoridpräparaten. Der dosisabhängige Einfluss des Strontiumgehalts im Trinkwasser ist bisher wenig untersucht worden. Bei steigendem Gehalt von 0‚2–34,0 mg/l Strontium zeigt sich eine Korrelation zur Zunahme von linienförmigen Hypoplasien (horizontale Schmelzstreifung) auch dann, wenn eine Fluorose ausgeschlossen werden kann.[10][11]
Fluoridierung
Bei der Fluoridierung wird Hydroxylapatit zu Fluorapatit umgewandelt:
Ca5(PO4)3(OH) + F- → Ca5(PO4)3 F + OH-
Fluorapatit besitzt bei gleichem pH-Wert ein viel geringeres Löslichkeitsprodukt, d. h., es dissoziieren weitaus weniger Fluorapatitmoleküle in einer Lösung als Hydroxylapatitmoleküle. Dies ist der Grund, weshalb Fluorapatit beständiger ist als das körpereigene Hydroxylapatit.
Ursache
Die genaue Ursache ist nicht vollständig geklärt.[1] Fluorid ist ein (glykolytischer) Enzyminhibitor,[12] das in zu hohen Konzentrationen die Matrixsekretion, den Matrixabbau, die Schmelzreifung und Schmelzmineralisation stört. Als besonders empfindlich zeigen sich die Ameloblasten, die nur während der Zahnentwicklung aktiv sind. Diese ist bis zum achten Lebensjahr abgeschlossen.[13] Bei erhöhter Fluoridzufuhr kommt es zu einer mangelhaften Syntheseleistung der Ameloblasten und dadurch zu einer fleckförmigen Unterentwicklung des Zahnschmelzes. Die Folge davon sind hypo- und hypermineralisierte Bereiche im Schmelz und Dentin.[1] Je länger und höher konzentriert die Fluoride eingenommen werden, desto größer werden die hypomineralisierten Zonen.[1] Klinisch manifestiert sich diese Störung der Schmelzbildung durch eine erhöhte Porosität und Farbveränderungen.[1]
Diagnose
Die Diagnose der Zahnfluorose erfolgt vor allem durch das klinische Bild, das heißt durch die sichtbaren Schmelzveränderungen. Die Erhebung einer präzisen Fluoridanamnese, gerade bei Kindern, wird empfohlen, um die Gefahr der Ausbildung von Dentalfluorosen zu vermeiden.[12]
Differentialdiagnose
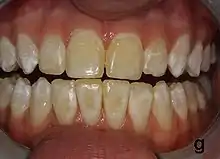
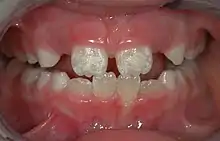
Die Zahnfluorose ist abzugrenzen von folgenden Zahnerkrankungen:
- Amelogenesis imperfecta
- Molaren-Inzisiven-Hypomineralisation
- Regionale Odontodysplasie
- Tetracyclin-Zähne
- Schmelzdefekte bei Zöliakie
- Dilazeration
- Turner-Zahn
- Erythrodontie bei kongenitaler erythropoetische Porphyrie (Morbus Günther)
- Chlorodontie bei
Verschiedene Theorien, wie zum Beispiel Bisphenol-A-Belastungen, Dioxine und Furane aus der Umwelt, ein bestehender Vitamin-D-Mangel und auch Infektionen mit Windpocken werden als weitere Ursachen für Schmelzveränderungen diskutiert.
Therapie
Je nach Schweregrad und ästhetischer Beeinträchtigung kommen nachfolgende Therapien in Betracht:
- Zahnaufhellung (Bleaching)
- Odontoplastik
- Compositfüllungen
- Veneers
- Zahnkronen
- ICON Infiltration
Geschichte
Schon bald nachdem Jakob Berzelius 1822 als Kurgast in Carlsbad zum ersten Mal gebundene Flusssäure im dortigen Sprudelwasser nachgewiesen hatte,[14] zeigten sich Kurgäste besorgt, dass diese Säure, die auch das benutzte Trinkglas anzuätzen schien, ihren Zähnen schaden könnte. Sie wurden beschwichtigt mit dem Hinweis, dass im Zahnschmelz kein Silikat enthalten sei, das von der Flusssäure angelöst werden könne.[15][16] Ca. 110 Jahre später wurde Fluorid im Trinkwasser als Ursache der endemischen Zahnfluorose erkannt und die Fluoridwirkung irrtümlich zunächst auf einen Ätzeffekt zurückgeführt, der die betroffenen Zahnflächen wie korrodiert aussehen ließ.[17]
Der Erstbeschreiber der Zahnfluorose war höchstwahrscheinlich der Zahnarzt C. Kühns, der 1888 in einem Vortrag über schwarz gefleckte Zähne bei einer Familie berichtete, die aus Durango (Mexiko) herübergekommen war und dann zu seinem Patientenkreis gehörte. Von dieser Familie erfuhr er, dass derartige Verfärbungen in Durango sehr häufig seien. Er machte Eisen- oder Manganablagerungen für die Verfärbung verantwortlich, die der „caries nigra“ ähnelte.[18] Dieser frühe Bericht ist ungewöhnlich, denn spätestens seit Carl Wedl 1870 in seinem Buch Pathologie der Zähne braune Schmelzverfärbungen unbekannter Herkunft als Anzeichen für Zahnkaries ansah, dürften Vorkommen von Zahnfluorose oft fehlinterpretiert worden sein. Ansonsten hätten Versuche des Münchner Chirurgen Ludwig von Stubenrauch bereits 1904 einen wichtigen Hinweis auf die Ursache bieten können. Der Chirurg hatte Hunde während der Zahnentwicklung mit Natriumfluorid gefüttert und stellte neben den für Fluorose typischen Skelettveränderungen fest, dass sie „ausnahmslos eine typische Caries der Zähne mit falschen Stellungen der Zähne“ bekamen.[19] In dem Gebiet um Neapel (Italien) hatten die Bewohner „denti neri“ (schwarze Zähne) bzw. „denti scritti“ (die aussahen, als ob sie beschriftet wären) was von den Einheimischen auf den Gasausstoß des Vesuvs zurückgeführt wurde. John Eager, ein in Neapel stationierter Arzt des United States Public Health Service (USPHS) hatte darüber 1901 berichtet, wo die Zahnschäden „Denti di Chiaie“ (nach einem Ortsteil von Neapel, Chiaia) genannt wurden.[20][21][22] Elf Jahre zuvor hatte der italienische Arzt und Mineraloge Arcangelo Scacchi über den Fluoridgehalt der vulkanischen Exhalationen und der Böden der Gegend geschrieben[23] – an einen Zusammenhang mit den dort später berichteten Zahnschäden dachte aber niemand.

Die Verfärbungen wurden seit 1923 auch in den trockenen Küstenregionen von Nordafrika beschrieben, wo sowohl Einheimische, aber insbesondere Pflanzenfresser, davon betroffen waren. Dort wurde das Phänomen von dem marokkanischen Tiermediziner Henri Velu (1887–1973) „Le darmous“ genannt, der es 1922 erstmals beschrieb und experimentell nachweisen konnte, dass die Ursache ein sehr hoher Fluoridanteil im Trinkwasser war, nachdem es fluorhaltiges Phosphorit passiert hatte. Die Erkrankung wird auch Velu-Charnot-Spéder Syndrom genannt.[24][25][26][27] Velu fand heraus, dass ungewaschene Proben von Stroh und Gerste einen höheren Fluorid-Gehalt hatten als gewaschene Proben. Die deutliche Fluorose bei Pflanzenfressern resultierte eher aus dem staubkontaminierten Futter mit hohem Fluoridgehalt, als durch das Einatmen von fluoridhaltigen Staub. Im Gegensatz resultierte die endemische menschliche Fluorose in der Region meist durch Einatmen von fluoridhaltigen Phosphatstaub.[28] Ähnliche Symptome der Fluorose fand man in Holland, Mexiko und vielen Städten in den Vereinigten Staaten.
Fluorose-Forschung durch Frederick Sumner McKay
Im Kurort und Goldsucher-Paradies Colorado Springs machte Frederick Sumner McKay eine Beobachtung. Die Zähne vieler Einwohner hatten unschöne braune Flecken, die örtlichen Zahnärzte und Ärzte maßen dem jedoch keine große Bedeutung bei, zumal die Verfärbungen keine offensichtlichen Auswirkungen auf die Gesundheit hatten. McKay wollte jedoch die Ursache herausfinden und widmete 30 Jahre seines Lebens dieser Suche. Er vermutete, dass ein Zusammenhang mit dem Trinkwasser bestehen müsse, wobei zunächst unklar war, ob diesem Wasser etwas Bestimmtes fehlte oder ob ein unerwünschter Bestandteil verantwortlich zu machen sei. Als erstes testete er die Wasserquelle in Colorado Springs, auch auf Arsen, aber er fand nichts Ungewöhnliches. Er hatte auch andere Gewässer getestet. Konkretere Hinweise fand Mckay, als er einige portugiesischen Familien aufsuchte, die von den Inseln Brava und Fogo auf den Kapverdischen Inseln nach Nantucket, Massachusetts, eingewandert waren. McKay stellte fest, dass die Brava-Eingeborenen Zähne mit den ominösen braunen Flecken hatten, die Fogo-Eingeborenen jedoch nicht. Bei gleicher Umgebung und Ernährung auf den Kapverdischen Inseln mutmaßte McKay, dass der einzige Unterschied nur ihr Trinkwasser liege. Ähnliche Erfahrungen machte er mit anderen Bevölkerungsgruppen.
Bereits 1925 war McKay so von der Idee überzeugt, dass irgendein Zusammenhang mit der Zusammensetzung des regionalen Trinkwassers bestehen müsse. Seine Erfahrungen ab 1927 mit der Stadt Lake Elsinore (Kalifornien), ca. 100 Meilen südöstlich von Los Angeles, waren dagegen gedämpfter. Alle nativen Einwohner dort hatten Zahnfluorose. Die Stadt lebte aber vom Tourismus, die heißen Quellen, die die Stadt auch mit Trinkwasser versorgten, dienten den Kurgästen für Trink- und Badekuren. Die Besitzer der Kurhäuser wandten sich gegen einen Wechsel der Wasserquellen, obwohl solche nach McKays Ansicht in größerer Zahl zur Auswahl standen.[29] Das Problem wurde erst Jahrzehnte später nach heftigen (auch politischen) Auseinandersetzungen und großem Druck gelöst.[30]
Eine ähnlich hitzige Debatte um die Trinkwasserversorgung wie in Elsinore entwickelte sich während der 1930er Jahre in Chetopa, Kansas, wo ein lokaler Zahnarzt, James Scott Walker, als Anführer der Befürworter eines Wechsels zu einer fluoridärmeren Wasserversorgung eine entscheidende Rolle spielte.[31] Der Wechsel der Quelle, für den Walker bis 1939 kämpfen musste, kam aber hier erst zustande, nachdem Sicherheitsprobleme aufgeworfen worden waren. Als nach diesem Erfolg Zahnärzte in Kansas weitere Quellen als problematisch erkannten, wurde vom Leiter der zahnärztlichen Abteilung des Kansas State Board of Health, Leon Kramer, gefordert, den Grenzwert für Fluorid möglichst hoch anzusetzen, um die Wasserversorgung der Städte auch unter wirtschaftlichen Aspekten zu gewährleisten. Als Grenzwert wurden von ihm 3 ppm vorgeschlagen.[30]
Der Durchbruch
Für McKays Projekt kam der Durchbruch 1931 durch Wasseruntersuchungen, die Harry V. Churchill (1886–1960), Chefchemiker in den Forschungslabors der Aluminium Company of America (ALCOA) in New Kensington ausführen ließ.[32] Churchill war auf Umwegen mit McKay in Kontakt gekommen und veranlasste eine Prüfung des Trinkwassers von Bauxite (Arkansas) auf Spurenelemente. Grund war der Verdacht, dass Kochgeschirr aus Aluminium, das diese Firma herstellte, für die braunen Flecken verantwortlich sein könnte. Unterstützung fand diese These in dem Umstand, dass in den betroffenen Gebieten in Colorado das Wasser aus dem Kryolith-haltigen Boden Aluminium aufnehmen konnte, ebenso wie aus dem Bauxit-Erz, das in der Stadt Bauxite abgebaut wurde. Churchill stellte jedoch einen erhöhten Fluoridgehalt des jeweiligen Wassers fest. Er ließ sich dann, unter dem Siegel der Verschwiegenheit, über McKay Wasserproben aus verschiedenen Gebieten zuschicken, deren Fluoridgehalt er untersuchte. Während der Fluoridgehalt des Wassers einiger Städte grob mit dem Schweregrad der dort von McKay gefundenen Dentalfluorose korrelierte, war bei einem Fluoridgehalt von unter 1 ppm keine endemische Schädigung beobachtet worden. Mit Hilfe der Ergebnisse des Chemikers hatte McKay endlich als Ursache der Dentalfluorose die lang gesuchten Unterschiede im Trinkwasser gefunden. Daraus resultierte auch die Bezeichnung Colorado brown stain für die Zahnfluorose.
Diesen Zusammenhang quantitativ darzustellen oblag dem Zahnarzt Henry Trendley Dean, der sich im USPHS ab Ende 1931 mit dem Problem befasste. Dean hatte sich vor dem Aufgreifen seiner neuen Aufgabe mit McKay getroffen und sich bei ihm über Details informiert.
In den 1950er Jahren wurde erstmals auch in Deutschland über das endemische Auftreten von Zahnfluorose berichtet. Walter Hoffmann-Axthelm, damals Oberarzt im Institut von Wolfgang Rosenthal an der Humboldt-Universität Berlin, untersuchte ab 1951 betroffene Kinder im Kneipp-Kurort Berggießhübel.[33]
Epidemiologische Studien
In epidemiologischen Studien gewinnt zunehmend die Fluoridausscheidung an Bedeutung. Dabei wird davon ausgegangen, dass etwa 50 % der aufgenommenen Fluoridmenge über den Urin ausgeschieden wird. Säuglinge weisen sehr niedrige Werte der Fluoridausscheidung auf. Für Kleinkinder waren ernährungsbedingte Faktoren sowie die Zahnpflegeprodukte als Einflussfaktoren der Fluoridausscheidung von Bedeutung. Bei 3-jährigen Probanden hatten die Zahnpflegegewohnheiten einen Einfluss auf die Fluoridausscheidung. Das häufige Zähneputzen mit fluoridhaltiger Zahnpasta ist eine relevante Fluoridquelle. Mittel der systemischen Prophylaxe spielen bei den über 3-Jährigen eher eine untergeordnete Rolle. Bei der systemischen Prophylaxe fanden sich die höchsten Werte der individuellen Fluoridausscheidung bei den Probanden, welche reine Fluoridpräparate erhielten. Wenn die Fluoridausscheidung beim Kombinationspräparat am niedrigsten war, so erklärt sich dies wohl durch eine überdurchschnittliche Retention bei den schnell wachsenden Säuglingen, die diese Kombination erhalten. Auch aus der regelmäßigen und langfristigen systemischen Prophylaxe resultierten höhere Werte der Fluoridausscheidung.[34][35]
Fluorose-Indices
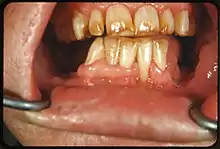
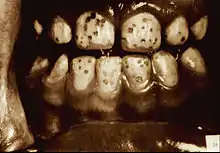
Fluorose-Indices wurden entwickelt, um einerseits die Ausprägung der Fluorose je nach Schweregrad zu erfassen und andererseits mittels epidemiologischen Studien Grenzwerte zur Fluorid-Zufuhr zur Kariesprävention zu ermitteln, bei denen keine oder tolerierbare Fluorose-Zahnschäden auftreten. Bei der Ermittlung der individuellen Fluoridzufuhr ist die Gesamtmenge zu bestimmen, die aus Fluoridtabletten, Nahrung, Trinkwasser, sonstigen Getränken (grüner und schwarzer Tee (auch Eistee), manche Mineralwässer, fluoridierte Milch), fluoridiertem Speisesalz und fluoridhaltigen Zahnpasten täglich aufgenommen wird.
Fluoroseindex nach Dean
H. Trendley Dean veröffentlichte erstmals einen Fluoroseindex im Jahr 1934. Der Index erfuhr zwei Änderungen und wurde in seiner endgültigen Form im Jahre 1942 veröffentlicht.[36] Der Schweregrad richtet sich nach den gravierendsten Befunden an zwei oder mehr Zähnen.[37]
| Schweregrad | Klassifikation | Symptome | Wichtung |
|---|---|---|---|
| 0 | Normal | Keine Veränderungen | 0 |
| 1 | Fraglich | Der Zahnschmelz zeigt leichte Abweichungen in der Transluzenz, mit gelegentlichen weißen Flecken. | 0,5 |
| 2 | Sehr mild | Kleine, undurchsichtige, weißliche Bereiche, unregelmäßig über den Zahn verstreut. Es sind nicht mehr als 25 Prozent der Zahnoberfläche beteiligt. Hierunter fallen auch Zähne, die nicht mehr als etwa 1–2 mm einer weißen Opazität an den Höckerspitzen der ersten oder zweiten Molaren aufweisen. | 1 |
| 3 | Mild | Kleine, undurchsichtige, weißliche Bereiche, unregelmäßig über den Zahn verstreut. Es sind nicht mehr als 50 Prozent der Zahnoberfläche beteiligt | 2 |
| 4 | Mittelschwer | Alle Schmelzoberflächen der Zähne sind betroffen. Sie zeigen Abrasionszeichen und sind durch braune Flecken unästhetisch im Aussehen. | 3 |
| 5 | Schwer | Alle Schmelzoberflächen sind betroffen. Die Schmelzhypoplasien sind ausgeprägt und erscheinen löchrig. Die Zähne zeigen großflächige braune Schmelzflecken. | 3 |
Community Index of Dental Fluorosis
Der Community Index of Dental Fluorosis (FCI) wird häufig bei epidemiologischen Studien zur Fluoroseprävalenz angegeben und berechnet sich nach folgender Formel, wobei die Wichtung im oben aufgezeigten Index nach Dean verwendet wird:[38]
n = Fluorose-Erkrankte. w = Wichtungsfaktor (Schweregrad), N = Gesamtzahl aller Untersuchten
Fluoroseindex nach Thylstrup und Fejerskov
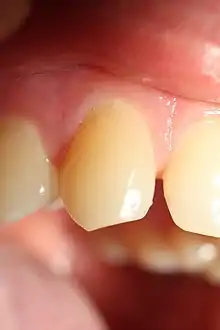
Thylstrup und Fejerskov entwickelten 1978 einen Fluoroseindex, der auf Deals Index aufbaut. Sie bezogen die zugrunde liegende Pathologie der Fluorose mit ein. Der Index erfasst Veränderungen im Schmelz in einer Skala von 0 bis 9, so dass eine genauere Definition von leichten und schweren Fällen ermöglicht wird.[39][40]
| Schweregrad | Symptome |
|---|---|
| 0 | Keine Veränderungen |
| 1 | Schmale weiße Linien, die den Perikymatien folgen |
| 2 | Schmale weiße Linien, die den Perikymatien folgen. An wenigen Stellen konferierend (snowcapping) |
| 3 | Ausgeprägte weiße Linien, an wenigen Stellen konfluierend. |
| 4 | Ausgeprägte weiße Linien, an den meisten Stellen konfluierend. |
| 5 | Stark verschmelzende Linien mit unregelmäßigen wolkig-opaken Arealen auf der gesamten Zahnoberfläche. |
| 6 | Ganze Fläche mit deutlichen Opazitäten oder kalkig-weißem Aussehen < 2 mm. |
| 7 | Opak weiße oder bräunliche Oberfläche mit einzelnen lokalen Hypoplasien |
| 8 | Oberflächenschmelzverlust in größeren Bereichen. Der übrige Bereich des Zahnschmelzes ist von opaker Farbe. |
| 9 | Oberflächenschmelzverlust in größeren Bereichen. Die Zahnform ist verändert. |
TSIF-Index
Horowitz entwickelte auf den beiden vorherigen Indices den TSIF-Index (Tooth Surface Index of Fluorosis, engl.: Zahnoberflächenindex bei Fluorose) der sieben Schweregrade vorsieht.[41][42]
| Schweregrad | Symptome |
|---|---|
| 0 | Keine Veränderungen |
| 1 | Der Zahnschmelz zeigt deutliche Hinweise auf Fluorose mit Bereichen mit Pergament-weißer Farbe, die weniger als ein Drittel der sichtbaren Zahnschmelzoberfläche umfassen. Zu dieser Kategorie gehören auch Zähne, deren Schneidekanten der Frontzähne oder Höckerspitzen der Seitenzähne betroffen sind („snowcapping“). |
| 2 | Pergament-weiße Fluorose die mindestens ein Drittel aber weniger als zwei Drittel der sichtbaren Oberfläche umfasst. |
| 3 | Pergament-weiße Fluorose die mehr als zwei Drittel umfasst. |
| 4 | Zusätzlich zu den Erscheinungen der vorherigen Schweregrade sind die Zähne hellbraun bis dunkelbraun verfärbt |
| 5 | Die Zähne weisen kleine, löchrige, raue, verfärbte Defekte auf, die von gesundem Zahnschmelz umgeben sind |
| 6 | Die Zähne weisen sowohl die beschriebenen Defekte als auch umfangreiche Verfärbungen auf. |
| 7 | Die Zähne weisen eine konfluierende Grübchenbildung der Schmelzoberfläche auf sowie große Zahnschmelzdefekte. Dunkelbraune Flecken sind in der Regel vorhanden. |
Fluorose Risiko Index
Der Fluorosis Risk Index (FRI; engl.: Fluorose Risiko Index) wurde 1990 von Pendrys vorgeschlagen, um in analytischen epidemiologischen Studien verwendet zu werden. Er dient zur genaueren Identifizierung von altersspezifischen Forderungen an Fluoridgaben und der sich daraus entwickelnden Entwicklung der Zahnfluorose. Dieser Index unterteilt die Schmelzoberflächen der Zähne im bleibenden Gebisses in 2 Gruppen.[43]
| Kategorie | Zahnschmelzbildung | Betroffene Zähne |
|---|---|---|
| 1 | während des ersten Lebensjahres | Inzisalkanten bzw. Okklusalflächen der Zähne 16, 11, 21, 26, 36, 31, 41, 46 (Sechsjahrmolaren und mittlere Schneidezähne) |
| 2 | zwischen dem dritten und sechsten Lebensjahr | Zervikales Drittel der Schneidezähne, Mittleres Drittel der Eckzähne 13, 23, 33, 43 und das inzisale und mittlere Drittel der Prämolaren und Molaren. |
In den jeweiligen Kategorien werden die Befunde nach dem TFI-Fluoroseindex nach Thylstrub und Fejerskov erfasst.
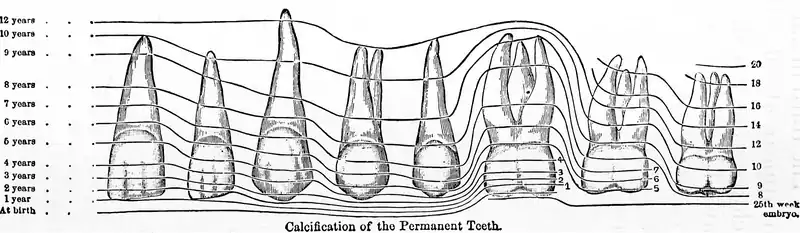
Kalzifikation
In nachfolgender graphischer Übersicht ist erkennbar, zu welchen Zeiten die Kalzifikation der bleibenden Zähne erfolgt. Bis zur vollständigen Schmelzbildung des jeweiligen Zahnes kann die Ausbildung einer Zahnfluorose durch die Einlagerung von Fluoriden bei Überdosierung erfolgen. Die Perikymatien (s. o.) sind über den gesamten Schmelzmantel verteilte Wachstumslinien des Zahnschmelzes. An deren Verlauf kann man gegebenenfalls die Fluoridierungsschäden altersentsprechend klassifizieren. Die Graphik zeigt die Zähne des oberen linken Gebissquadranten, beginnend links mit dem mittleren Schneidezahn (Zahn 21) und rechts endend mit dem linken oberen Weisheitszahn (Zahn 28). Als erstes kalzifiziert der Sechsjahrmolar (Zahn 26).
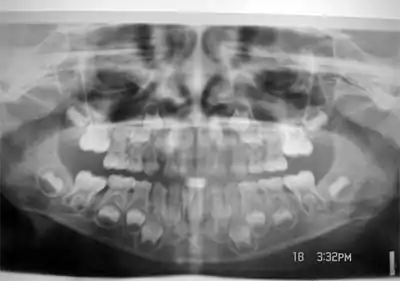
Modifizierter DDE-Index
1982 schlug die Commission on Oral Health, Research and Epidemiology die Verwendung eines Developmental defects of enamel-Index (DDE) vor (engl.: Index der Zahnschmelzentwicklungsstörungen). Auf Grund seiner Kompliziertheit wurde er 1989 von J. Clarkson und D. O‘Mullane modifiziert[44] und ist seit 1999 durch die Fédération Dentaire Internationale (FDI), dem Zahnärzteweltverband, anerkannt.[45]
| Schweregrad | Symptome |
|---|---|
| 0 | Normal |
| 1 | Begrenzte Opazitäten |
| 2 | Diffuse Opazitäten |
| 3 | Hypoplasien |
| 4 | Hypoplasien mit weiteren Defekten |
| 5 | Gleichzeitig begrenzte und diffuse Opazitäten |
| 6 | Begrenzte Opazitäten mit Hypoplasien |
| 7 | Diffuse Opazitäten mit Hypoplasien |
| 8 | Gleichzeitig begrenzte und diffuse Opazitäten mit Hypoplasien |
Neuere Untersuchungsmethoden
Die Visuelle Analogskala (VAS) (Visual Analogue Scale) wurde 2005 von Antonio Carlos Pereira entwickelt. Die Laborstudie zeigte eine bessere Korrelation zwischen der Fluoridkonzentration und dem VAS für die Zahnfluorose als zwischen Fluoridkonzentration und dem TFI.[46] Pretty und McGrady experimentieren mit quantitativer Fluoreszenz (Quantitative Light Fluorescence, QLF) und seit 2012 mit polarisiertem Licht mit Hilfe eines Digital-Imaging-Systems zum Erfassen von Bildern. Das Verfahren soll eine automatisierte Software-Analyse ermöglichen und für epidemiologische Studien geeignet sein.[47]
Literatur
- Markus Schaffner, Peter Hotz, Adrian Lussi: Thema des Monats:Zahnfluorose. In: Swiss Dental Journal. SSO, Volume 125, Heft 6, 2015, S. 710–711. Abgerufen am 4. Juni 2016.
Einzelnachweise
- Markus Schaffner et al.: Zahnfluorose. (PDF) In: Swiss Dental Journal. 2015, abgerufen am 8. September 2020.
- Hendrik Meyer-Lückel, Kim Ekstrand, Sebastian Paris: Karies: Wissenschaft und Klinische Praxis. Georg Thieme Verlag, 2012, ISBN 978-3-13-169321-1, S. 200– (google.com).
- Robert H. Wilson, Floyd DeEds: Experimental chronic cadmium poisoning. Science 90 (1939) 498
- Robert H. Wilson, Floyd deEds, Alvin J. Cox: Effects of continued cadmium feeding. J. Pharmacol. Exp. Ther. 71 (1941) 222
- Peter Dale, James T. Ginn, Joseph F. Volker: Some observations on the effect of cadmium on the dentition of the rat. J. dent. Res. 21 (1942) 302
- J. T. Ginn, Joseph F. Volker: Effect of cadmium and fluorine on the rat dentition. Proc. Soc. Exp. Biol. Med. 57 (1944) 189
- E. V. Pindborg, J. J. Pindborg, C. M. Plum: Studies on incisor pigmentation in relation to liver iron and blood picture in the white rat. II. The effect of fluorine on the iron metabolism. Acta pharmacol. 2 (1946) 294
- E. V. Pindborg, J. J. Pindborg, C. M. Plum: Studies on incisor pigmentation in relation to liver iron and blood picture in the white rat. IV. The relation between cadmium poisoning and iron metabolism. Acta pharmacol. 2 (1946) 302
- Joel Wisotzky, John W. Hein: The effects of solutions of cadmium sulphate and lead acetate on the incisor pigmentation, fur color, and blood in male and female Syrian Hamsters. J. dent. Res. 34 (1955) 768
- Peter Gängler: Konservierende Zahnheilkunde und Parodontologie: 66 Tabellen. Georg Thieme Verlag, 2005, ISBN 3-13-593702-X, S. 74 (google.com).
- Eckhart Buddecke: Biochemische Grundlagen der Zahnmedizin. Walter de Gruyter, 1981, ISBN 3-11-008738-3, S. 53–54 (google.com).
- Christian Splieth: Zwischen Kariesprävention und Dentalfluorose. In: Zahnärztliche Mitteilungen. 1. September 2019, abgerufen am 8. September 2020.
- Eckhart Buddecke: Biochemische Grundlagen der Zahnmedizin. Walter de Gruyter, 1981, ISBN 3-11-085820-7, S. 83–84 (google.com).
- Jakob Berzelius: Extrait d'une lettre de M. Berzelius à M. Berthollet. In: Ann. de Chimie. 21, 1822, S. 246.
- Joseph Ernest Ryba: Karlsbad und seine Heilquellen. Ein Handbuch für Kurgäste. Verlag Kronberger und Weber, Prag 1828, S. 127–128.
- Buchbesprechung: Ryba: Carlsbad und seine Heilquellen. In: Medicinische Jahrbücher des kaiserlich-königlichen österreichischen Staates. N.F. 1. Band, 1829, S. 271.
- F. S. McKay: Schreiben vom 29. Januar 1931 an H. V. Churchill; ALCOA papers, Wisconsin State Historical Society, Madison, Wisconsin
- Dtsch. Mschr. Zahnheilk. 6, 1888, S. 446, zit. in: F. J. McClure: Water Fluoridation. The search and the victory. NIDR, Bethesda, MD, 1970, S. 1–3. Abgerufen am 4. Juni 2016.
- Ludwig von Stubenrauch: Experimentelle Untersuchungen über die Wirkung des Fluornatriums auf den Knochen, speziell den Kieferknochen. In: Verhandl Dtsch Ges für Chhirurgie. 33. Kongr., Berlin, 6. April 1904, S. 20.
- J. M. Eager: Denti di Chiaie (Chiaie Teeth). In: Publ Health Rep. Volume 16, 44, 1. November 1901, S. 2576–2577.
- J. M. Eager: Chiaie Teeth. In: Periscope, Dental Cosmos. Volume 44, März 1902, S. 300–303.
- F. J. McClure: Water Fluoridation. The search and the victory. NIDR, Bethesda, MD, 1970, S. 1–3. Abgerufen am 4. Juni 2016.
- Arcangelo Scacchi: La regione vulcanica fluorifera della Campania. G. Barbera, Firenze 1890.
- Gaston Compain: ‚El Darmous‘– Lésions des dents et ostéite déformante du maxillaire inférieur chez les animaux domestiques de la région du Gantour (Maroc). Thèse, Lyon 1926.
- Albert Claudon: Le Darmous. Dystrophie dentaire des espèces domestiques de la Haute-Chaouia. Thèse, Lyon 1931.
- Henri Velu: Le Darmous (ou Dermes) – Fluorose spontanée des zones phosphatées. In: Archives de l'institut Pasteur d'Algérie. 10:1, März 1932, S. 41–118.
- André Chambionnat: La lutte contre le Darmous. Le dosage du fluor dans les eaux. Son élimination en vue de la potabilité des eaux à Darmous. undatiert (ca. 1938)
- Y. Haikel, J. C. Voegel, R. M. Frank: Fluoride content of water, dust, soils and cereals in the endemic dental fluorosis area of Khouribga (Morocco). In: Archives of Oral Biology. 31, 1986, S. 279, doi:10.1016/0003-9969(86)90041-5.
- F. S. McKay: Schreiben an Grover Kempf, USPHS, vom 29. März 1927; Ruth Roy Harris papers
- Hans Ludigs: Fluorid und die Geschichte der US-amerikanischen Zahnmedizin. ca. 1900–1950; Masterarbeit. Universität Konstanz, 2013.
- J. Scott Walker: One Man’s Battle Against Mottled Enamel. In: Oral Hygiene. 24, März 1934, S. 340–347.; American Journal of Public Health. 23, Januar 1933, S. 47–48.
- P. Meiers: The Bauxite Story. A look at Alcoa. Abgerufen am 1. Juni 2016.
- W. Hoffmann-Axthelm, R. Wohinz: Erste Beobachtungen über das Auftreten von Dentalfluorose in Deutschland. Deutsche Stomatologie 2 (1952) S. 59
- Natasha Diller: Fluoridexposition 0-6-jähriger Kinder in Deutschland. Analysen der Urinproben von Teilnehmern am Kinder- und Jugendgesundheitssurvey. (KiGGS), Dissertation. 2011. Abgerufen am 14. Juni 2016.
- Gisoo Khorrami: Vergleich der Karies- und Fluoroseprävalenz in zwei Gebieten mit unterschiedlichem Trinkwasserfluoridgehalt im Iran. Dissertation. FU Berlin, 2009. Abgerufen am 13. Juni 2016.
- Dean HT ( 1942). The investigation of physiological effects by the epidemiological method. In: Moulton FR , editor. Fluorine and dental health. Pub. No. 19. Washington (DC): American Association for the Advancement of Science , 23–31.
- H. Shelton, D. Browne, P. Felicia, J. Shelton: E-training for Dean’s Index Version 2. Oral Health Services Research Centre, University College Cork, Ireland., archiviert vom Original am 4. Juni 2016; abgerufen am 2. Juni 2016.
- Thomas Weber: Zahnfluorose. In: Memorix Zahnmedizin. 3. Auflage. Thieme Verlag, 2010. Abgerufen am 5. Juni 2016.
- A. Thylstrup, O. Fejerskov: Clinical appearance of dental fluorosis in permanent teeth in relation to histologic changes. In: Community dentistry and oral epidemiology. Band 6, Nummer 6, November 1978, S. 315–328. PMID 282114.
- Elmar Hellwig, Joachim Klimek, Thomas Altin: Einführung in die Zahnerhaltung. Deutscher Ärzteverlag, 2009, ISBN 978-3-7691-3371-4, S. 70 (google.com).
- Michael Bonnet: Diagnostik criteria for fluorosis: The TSIF Tooth Surface Index of Fluorosis. Fluoride Action Network, July 2012. Abgerufen am 4. Juni 2016.
- H. S. Horowitz u. a.: A new method for assessing the prevalence of dental fluorosis–the Tooth Surface Index of Fluorosis. In: Journal of the American Dental Association. 109 (1), 1984, S. 37–41.
- D. G. Pendrys: The fluorosis risk index: a method for investigating risk factors. In: Journal of public health dentistry. Band 50, Nummer 5, 1990, S. 291–298. PMID 2231522 (Review).
- J. Clarkson, D. O'Mullane: A modified DDE Index for use in epidemiological studies of enamel defects. In: Journal of dental research. Band 68, Nummer 3, März 1989, S. 445–450. PMID 2921385.
- A review of developmental defects of enamel index (DDE). Federation Dentaire Internationale, Commission on Oral Health Research and Epidemiology. In: International Dental Journal. 42, 1992, S. 411–426.
- A. P. Vieira, H. P. Lawrence u. a.: A visual analog scale for measuring dental fluorosis severity. In: Journal of the American Dental Association (1939). Band 136, Nummer 7, Juli 2005, S. 895–901. PMID 16060470.
- Iain A Pretty, Michael McGrady u. a.: Quantitative Light Fluorescence (QLF) and Polarized White Light (PWL) assessments of dental fluorosis in an epidemiological setting. In: BMC Public Health. 12, 2012, S. 366, doi:10.1186/1471-2458-12-366.