Reaktionsgleichung
Eine Reaktionsgleichung ist in der Chemie eine Beschreibung einer chemischen Reaktion im stöchiometrisch richtigen Verhältnis. Sie gibt in Symbolschreibweisen die Reaktionspartner (Reaktanten und Produkte) einer Stoffumwandlung an.
| |||
| Titel | Symbolische Beschreibung chemischer Reaktionen | ||
| Letzte Ausgabe | Januar 1992 | ||
| Zurückgezogen | ja, Datum nicht bekannt | ||
Eine Reaktionsgleichung wird als Gleichung betrachtet, da auf beiden Seiten der Gleichung die gleiche Anzahl der Atome des jeweiligen chemischen Elements vertreten sein müssen und die Ladungssumme auf beiden Seiten gleich sein muss.
Die beiden Seiten der Gleichungen werden in der Regel nicht durch ein Gleichheitszeichen (=) verbunden, sondern durch einen Pfeil, der die Umsatzrichtung (→) oder durch einen Doppelpfeil (), der eine Gleichgewichtsreaktion anzeigt. Zur Erfüllung der Stöchiometrie enthalten Reaktionsgleichungen Reaktionsstöchiometriezahlen. Diese Zahlen sind in der Regel ganzzahlig und möglichst klein, wobei die Zahl 1 meist weggelassen wird. Nach DIN 32642 „Symbolische Beschreibung chemischer Reaktionen“ spricht man dann von einer Kardinalgleichung.
Häufig werden auch nichtstöchiometrische Darstellungen für Reaktionen verwendet. Diese qualitativen Darstellungen werden nach DIN 32642 nicht Reaktionsgleichungen, sondern Reaktionsschemata genannt. Diese Norm legt außerdem noch die Begriffe Umsatzvariable, Formelumsatz und molare Reaktionsenthalpie fest.
Aufbau einer Reaktionsgleichung
Auf der linken Seite einer Reaktionsgleichung stehen die chemischen Formeln der Ausgangsstoffe (Reaktanten) – auf der rechten die der Produkte. Dazwischen wird ein Reaktionspfeil geschrieben (z. B. ), der in Richtung auf die Produkte hin zeigt. Vor die Molekülformeln oder Formeleinheiten der Reaktionspartner setzt man zudem groß geschriebene Zahlen, die angeben, in welchem Verhältnis zueinander die Stoffe verbraucht oder erzeugt werden. Man bezeichnet die Zahlen als Reaktionsstöchiometriezahlen (normgerecht: Betrag der stöchiometrischen Zahl) der beteiligten Stoffe. Sie müssen so gewählt werden, dass die Stoffmengen-Verhältnisse der Reaktionspartner – ihre stöchiometrischen Bedingungen – korrekt wiedergegeben werden: Für jedes chemische Element müssen auf der linken Seite einer Reaktionsgleichung gleich viele Atome, wie auf der rechten Seite vorhanden sein. Die Zahl „Eins“ als Reaktionsstöchiometriezahl wird nicht geschrieben.
Beispielsweise wird die Verbrennung von Methan (CH4) mit Sauerstoff (O2) zu Kohlenstoffdioxid (CO2) und Wasser (H2O) durch die Gleichung
beschrieben. In diesem Beispiel sind für Kohlenstoff C je ein Atom (links in CH4 und rechts in CO2), für Wasserstoff H je vier Atome (links in CH4 und rechts je 2 in beiden H2O), sowie für Sauerstoff O ebenfalls je vier Atome (links je zwei in beiden O2 und rechts zwei in CO2 und je eines in beiden H2O) vorhanden.
Reaktionsschema
Ein Reaktionsschema berücksichtigt dagegen stöchiometrische Verhältnisse der Reaktionspartner nicht oder nur teilweise und gibt nur an, welche Edukte zu welchen Produkten reagieren. In der organischen Chemie werden dabei oft nur die kohlenstoffhaltigen Moleküle aufgeführt und die Formeln beteiligter niedermolekularer anorganischer Teilchen (z. B. Wasser) nicht graphisch dargestellt. Als Beispiel für ein solches Reaktionsschema soll die säurekatalysierte Wasserabspaltung aus 2-Pentanol sein:

Ein anderes Beispiel für ein Reaktionsschema ist folgende Wortgleichung:
Symbole
Pfeile
In Reaktionsgleichungen werden verschiedene Pfeile mit folgenden Bedeutungen verwendet:
- Reaktionspfeil ()
- mehrere Reaktionspfeile () beschreiben eine Reaktionssequenz, also eine Abfolge mehrerer Einzelreaktionen zwischen Edukt und Produkt
- Hin- und Rückreaktion (), die Reaktion kann durch veränderte Reaktionsbedingungen in die eine oder andere Richtung ablaufen.
- Gleichgewichtspfeil (), wird verwendet, wenn sich bei den vorgegebenen Bedingungen ein Reaktionsgleichgewicht einstellt.
- Retrosynthesepfeil ()
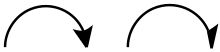
- zur Kennzeichnung von Ein- oder Zweielektronenverschiebungen (Beschreibung von Reaktionsmechanismen, oft gebraucht in der Organik):
- Geschwungener Pfeil mit ganzer Spitze () symbolisiert die Verschiebung eines Elektronenpaars (= zwei Elektronen).
- Geschwungener Pfeil mit halber Spitze symbolisiert die Verschiebung eines einzelnen Elektrons.
Anmerkungen: Der Mesomeriepfeil () beschreibt keine chemische Reaktion und wird insofern nicht in Reaktionsgleichungen verwendet. Von diesen Pfeilen sind nur der Reaktionspfeil und die Gleichgewichtspfeile (zwei parallele, entgegengesetzt gerichtete Pfeile mit Halbspitzen) normgerecht nach DIN 32642; soll zum Ausdruck kommen, dass die Gleichgewichtskonstante einer Reaktion sehr groß oder sehr klein ist, kann dies durch unterschiedliche Pfeillängen der Gleichgewichtspfeile ausgedrückt werden.
Zustandsangaben
Zur Verdeutlichung können hinter den chemischen Symbolen oder Formeln in runden Klammern Modifikationen, Aggregatzustände oder Lösungszustände angegeben werden. Hierfür sind nach DIN 32642 folgende Abkürzungen gebräuchlich:
- g für gasförmig (engl.: gaseous)
- l für flüssig (engl.: liquid)
- s für fest (engl.: solid)
- aq für 'in Wasser gelöst' (engl.: aqueous)
Entstehende Feststoffe bzw. Gase dürfen normgerecht auch mit einem nachgestellten nach unten () bzw. oben () gerichteten Pfeil gekennzeichnet werden.
Weitere Angaben
Über den Reaktionspfeil schreibt man gegebenenfalls die Reaktionsbedingungen und den eingesetzten Katalysator. Werden die Stoffe für die Reaktion erhitzt, wird dies durch ein großes Delta (Δ) über dem Reaktionspfeil gekennzeichnet. Die entstehende oder aufgewendete Reaktionsenergie wird auf die Seite geschrieben, wo sie anfällt bzw. aufgewendet werden muss.
Für thermodynamische Berechnungen wird häufig die molare Reaktionsenthalpie (ΔHR) mit angegeben, beispielsweise bei der Reaktionsgleichung der Knallgasreaktion
Bei dem Formelumsatz von zwei Mol gasförmigen H2 und einem Mol gasförmigen O2 zu zwei Mol flüssigem H2O werden also 572 kJ Energie frei. Hier ist es wesentlich, dass die Phase der an der Reaktion beteiligten Stoffe mit angegeben wird, da bei den Phasenübergängen ebenfalls Energie umgesetzt wird. Die Reaktionsenthalpie wird üblicherweise bei 25 °C angegeben. Ein positiver Wert von ΔHR bezeichnet endotherme Reaktionen, ein negativer Wert exotherme Reaktionen.
Verkürzte Form
An Stelle der Vollschreibweise mit kompletten Summenformeln kann man unbeteiligte Reaktionspartner weglassen, z. B.:
- statt:
- oder:
Es macht bei dieser Fällungsreaktion keinen Unterschied, ob Lithium- oder Natriumsulfat eingesetzt wird, da beide Salze in Wasser löslich sind und weder Lithium- noch Natriumchlorid ausfallen. Das an dieser Reaktion unbeteiligte Kation (Li+ oder Na+) kann daher weggelassen werden.
Eine andere Verkürzung, welche in Systemen mit mehreren auftretenden Reaktionen genutzt wird, ist die Stöchiometrische Matrix, welche die Stöchiometrie mehrerer Reaktionsgleichungen kompakt zusammenfasst.
Nutzen von Reaktionsgleichungen: Umsatzberechnungen
Um den Stoffumsatz bei einer Reaktion zu berechnen, wird die Reaktionsgleichung mit Hilfe von Stoffmengen-Angaben in Mol benutzt. Grundlagen dieser Rechenmethode finden sich im Artikel Stöchiometrie (Fachrechnen Chemie). Als Beispiel wird hier die oben beschriebene Reaktionsgleichung der Verbrennung von Methangas genommen. Das Reaktionsschema lautet:
Es besagt qualitativ: Methan und Sauerstoff reagieren zu Kohlenstoffdioxid und Wasser.
Es besagt quantitativ: 1 Mol Methan und 2 Mol Sauerstoff ergeben 1 Mol Kohlenstoffdioxid + 2 Mol Wasser.
Da 1 Mol C 12 g wiegt, 1 Mol Methan 16 g, 1 Mol Sauerstoff 32 g, 1 Mol Wasser 18 g und 1 Mol Kohlenstoffdioxid 44 g, so besagt es auch:
- 16 g Methan + 64 g Sauerstoff ergeben 44 g Kohlenstoffdioxid + 36 g Wasser.
- Aus 80 g Ausgangsstoffen (Edukten) entstehen 80 g Endstoffe (Produkte). Je 16 g oxidiertes Methan entstehen 44 g Kohlenstoffdioxid.
Da 1 Mol Gas unter Normalbedingungen 22,4 L Raum einnimmt, besagt das Reaktionsschema auch:
- 22,4 L Methan + 44,8 L Sauerstoff ergeben 22,4 L Kohlenstoffdioxid + 44,8 L Wasserdampf.
Ähnliche Umsatzberechnungen sind für jede andere chemische Reaktion möglich, deren Reaktionsschema erstellt worden ist. So lassen sich erforderliche Rohstoffmengen oder theoretisch erzielbare Produktmengen (bei 100%iger Ausbeute) über Reaktionsschemen und molare Massen berechnen. Beispielaufgabe: Wie viel Wasserstoff entsteht bei der Reaktion von 1 g Lithium mit Wasser?[1]
Literatur
- Michael Wächter: Stoffe, Teilchen, Reaktionen. Verlag Handwerk und Technik, Hamburg 2000, ISBN 3-582-01235-2, S. 154–169.
- Quantities, Units and Symbols in Physical Chemistry („Green Book“; PDF; 2,0 MB), IUPAC.
Weblinks
- Online-Rechner zum Bestimmen der Koeffizienten einer stöchiometrischen Gleichung, inklusive der Beschreibung des mathematischen Hintergrunds
- Online-Rechner zum Bestimmen der Koeffizienten einer stöchiometrischen Gleichung, mit Angabe der Massen, die miteinander reagieren. (Aufgerufen am 7. April 2013)