Emulsionspolymerisation
Die Emulsionspolymerisation ist ein Verfahren der radikalischen Polymerisation von Monomeren in einer wässrigen Phase. Die für eine Emulsionspolymerisation notwendigen Komponenten sind Wasser, ein wasserlöslicher Initiator sowie die Monomere, die eine geringe Wasserlöslichkeit besitzen müssen. Das Ergebnis ist eine Polymerdispersion, d. h. eine Dispersion der aus dem Monomer gebildeten Polymerpartikel in Wasser. Bei der praktischen Durchführung werden der wässrigen Phase häufig noch Tenside und/oder Schutzkolloide zugesetzt, welche für eine kolloidale Stabilität der gebildeten Dispersion sorgen, aber auch durch Einwirkung auf die Teilchenbildungsprozesse den Teilchendurchmesser und die Anzahl der gebildeten Polymerpartikel beeinflussen. Im Gegensatz zur Suspensionspolymerisation findet bei der Emulsionspolymerisation die Teilchenbildung in der wässrigen Phase statt. Für die Teilchenbildung existieren mehrere Theorien, die bekanntesten sind die micellare Nukleierung nach Harkins, Smith und Ewart sowie die homogene Nukleierung nach Fitch und Tsai.
Reaktionsprinzip
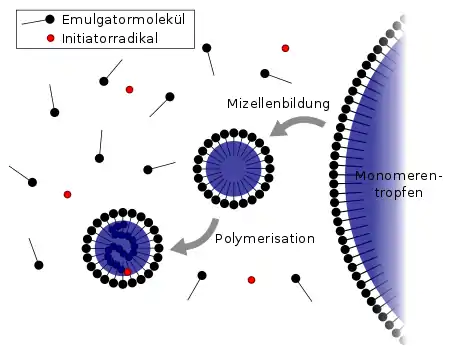
Wichtig zur Lösungsvermittlung des hydrophoben Monomers ist der Emulgator. Mit Hilfe solcher amphiphiler Verbindungen wird die Stabilisierung des Monomers in Wasser erst ermöglicht. Ein gebräuchlicher Emulgator ist z. B. SDS (englisch sodium dodecyl sulfate ‚Natriumdodecylsulfat‘). Des Weiteren wird bei der radikalischen Emulsionspolymerisation ein wasserlöslicher Initiator eingesetzt.
Zunächst löst man den Emulgator in Wasser. Bei einer bestimmten Konzentration (kritische Mizellbildungskonzentration) des Emulgators bilden sich Mizellen aus, in denen später die Polymerketten wachsen können. Man gibt anschließend das Monomer zu und erzeugt zum Schluss reaktive Radikale. Dies kann dadurch geschehen, dass man einen thermisch zerfallenden Radikalbildner (meist Peroxide oder Azoverbindungen) zugibt und die Mischung über dessen Zerfallstemperatur erwärmt. Alternativ kann man Radikale auch ohne thermische Anregung durch photochemische Zersetzung (z. B. AIBN) oder geeignete Redoxreaktionen (z. B. zwischen Ammoniumperoxodisulfat und Ascorbinsäure) erzeugen.
Zunächst bilden sich kleine Polymerradikale in der Wasserphase, die nach Anlagerung einiger der schwer wasserlöslichen Monomeren eine Affinität zu dem hydrophoben Mizellinneren entwickeln und dahin diffundieren, sodass die Reaktion dann dort fortschreitet. Auch kann ein anfänglich erzeugtes Polymerteilchen Emulgator anlagern und so um sich herum eine Mizelle bilden. Die Mizellenwand aus Emulgator wirkt im Prinzip wie eine Membran, sodass weitere Monomere in die Mizelle hineindiffundieren können, wodurch die Polymerisation weiter fortschreitet. Weitere Emulgatormoleküle treten hinzu und lassen die Mizellenwand gleichsam mitwachsen. Unter der Voraussetzung, dass Initiator im Überschuss vorhanden ist, kommt die Polymerisation erst zum Erliegen, wenn das Monomer vollständig verbraucht ist. Es ist zwar theoretisch denkbar, dass auch in den Monomerentröpfchen im Reaktionsansatz eine Polymerisation stattfindet, jedoch ist deren Gesamtoberfläche, und damit die Eintrittswahrscheinlichkeit der Radikale, im Gegensatz zu den Mizellen um einige Größenordnungen kleiner. So ist diese Reaktion sehr unwahrscheinlich, da es nur selten zu einem Kontakt eines Polymerradikals oder Initiatorradikals kommt.
Kinetik
Die Kinetik solcher Verfahren ist kompliziert.
Für die Bruttoreaktionsgeschwindigkeit gilt bei Umsätzen unter 60 % annähernd:
Mit
- : Micellenzahl,
- : Geschwindigkeitskonstante der Wachstumsreaktion und
- : Monomerenkonzentration.
Die Reaktionsgeschwindigkeit hängt also von der Mizellenzahl und damit von der Emulgatorkonzentration ab.
Der zeitliche Verlauf einer Emulsionspolymerisation lässt sich in drei Phasen unterteilen.
- in Phase 1 steigen die Zahl der Reaktionsorte schnell an und damit auch die Reaktionsgeschwindigkeit. In dieser Phase gehorcht die Reaktionsgeschwindigkeit einer Kinetik 1. Ordnung.
- in Phase 2 werden sehr wenige oder keine neue Reaktionsorte gebildet, die Reaktionsgeschwindigkeit und Teilchenzahl bleiben konstant. In dieser Phase gehorcht die Reaktionsgeschwindigkeit einer Kinetik 0. Ordnung.
- in Phase 3 ist das Monomer weitestgehend verbraucht, die Zahl der Reaktionsorte nimmt ab. In dieser Phase gehorcht die Reaktionsgeschwindigkeit wieder einer Kinetik 1. Ordnung.[1]
Polymerisationsgrad
Genähert kann der Polymerisationsgrad angegeben werden zu . Mit als der Geschwindigkeit aller Abbruchreaktionen.
Somit ist der Polymerisationsgrad über die Anzahl der Latexpartikel und damit über die Emulgatorkonzentration steuerbar.
Vor- und Nachteile
Die Vorteile der Emulsionspolymerisation sind:
- Die Prozessführung erfolgt in Wasser, organische Lösemittel werden nicht benötigt.
- Die Reaktionswärme kann durch die Wasserphase sehr gut kontrolliert werden (geringerer Gel-Effekt)
- Die Viskosität ist sehr gering, Rühren wird erleichtert.
- Die erhaltene Dispersion ist meist bereits gebrauchsfertig.
Dem gegenüber stehen folgenden Nachteile:
- Hilfsstoffe (z. B. Emulgatoren) verbleiben im Produkt und können ggf. bei der Anwendung zu Problemen führen, oder müssen aufwändig entfernt werden.
Verwendung
Dieses Polymerisationsverfahren hat industriell eine große Bedeutung. Beispielsweise werden PVC, Polystyrol-, Polyacrylat- und Polyvinylacetatcopolymere sowie Fluorpolymeren wie PTFE und PFA auf diese Art hergestellt. PVC wird hieraus durch Ausfällung isoliert, während die anderen Polymeren meist direkt in Form der erhaltenen Dispersion eingesetzt werden, z. B. als Bindemittel für wässrige Dispersionsfarben.
Literatur
- Artikel in der ChemgaPedia
- Burkart Philipp, Gerhard Reinisch: Grundlagen der makromolekularen Chemie. 2. bearbeitete Auflage. Vieweg, Braunschweig 1976, ISBN 3-528-06811-6, (Reihe Wissenschaft).
- Erich Fitzer, Werner Fritz, Gerhard Emig: Technische Chemie. Einführung in die chemische Reaktionstechnik. Mit 34 Rechenbeispielen. 4. vollständig überarbeitete und erweiterte Auflage. Springer, Berlin u. a. 1995, ISBN 3-540-59311-X, (Springer-Lehrbuch).
- Erik Kissa: Fluorinated Surfactants and Repellents. 2. Auflage. CRC Press, 2001, ISBN 978-0-8247-0472-8 (Google Books).
- Patent WO2004067588: Emulsion polymerization of fluorinated monomers. Angemeldet am 5. Dezember 2003, veröffentlicht am 12. August 2004, Anmelder: 3M Innovative Properties Company, Erfinder: Lian S. Tan, Richard S. Buckanin.
Einzelnachweise
- Alisa Gapchenko: Styrol-Butylacrylat-Emulsion: Aspekte der Hochtemperatur-Copolymerisation und neue Anwendungsgebiete Dissertation des Fachbereich Chemie der Fakultät für Mathematik, Informatik und Naturwissenschaften der Universität Hamburg 2018, abgerufen am 29. August 2020