Sulfurylchlorid
Sulfurylchlorid ist eine farblose, in Gegenwart von Wasser ätzend wirkende Flüssigkeit, die zur Gruppe der anorganischen Säurechloride gezählt wird. Es ist das Dichlorid der Schwefelsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
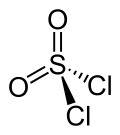 | ||||||||||||||||
| Keile zur Verdeutlichung der räumlichen Struktur | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Sulfurylchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | SO2Cl2 | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 134,97 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
69 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
langsame Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Es bildet sich aus Schwefeldioxid und Chlor am Aktivkohlekatalysator oder durch Zersetzung von Chlorsulfonsäure:[3]
Eigenschaften
Physikalische Eigenschaften
Sulfurylchlorid ist eine leichtbewegliche, an feuchter Luft rauchende Flüssigkeit, die aufgrund ihres recht niedrigen Siedepunkts von 69 °C leicht verdampft und problemlos durch Destillation gereinigt werden kann. Es hat eine für viele Halogenverbindungen typische hohe Dichte von 1,6674 g·cm−3
Sulfurylchlorid ist bisphänoid (verzerrt tetraedisch) aufgebaut, das Schwefelatom sitzt hierbei in der Tetraedermitte. Die Bindungslängen der Atombindungen sind im Bild dargestellt.
Verwendung
Aus Sulfurylchlorid können durch elektrophile aromatische Substitution aromatische Sulfonsäurechloride (Sulfochloride) hergestellt werden. Weiterhin kann es in Gegenwart eines Radikalstarters zur radikalischen Chlorierung von Alkanen und Cycloalkanen verwendet werden. Bei letzterer Reaktion entstehen als gasförmige Nebenprodukte Schwefeldioxid und Chlorwasserstoff.
Sicherheitshinweise
Sulfurylchlorid ist stark ätzend und greift Haut und besonders Schleimhäute und Augen heftig an. Beim Arbeiten ist ein gut ziehender Abzug zu verwenden und persönliche Schutzausrüstung zu tragen (Kittel, Schutzbrille, Schutzhandschuhe).
Reste von Sulfurylchlorid müssen unter größter Vorsicht in kleinen Portionen in eine Eis/Wasser-Mischung eingetragen werden. Die dann erhaltene Schwefelsäure-Salzsäure-Mischung wird mit einer geeigneten Base vorsichtig neutralisiert, bevor sie der fachgerechten Entsorgung zugeführt wird.
Einzelnachweise
- Eintrag zu Sulfurylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Sulphuryl dichloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. Auflage 2, Band 1, Academic Press 1963, S. 383–385.
Weblinks
- Datenblatt Sulfurylchlorid (PDF) bei Merck, abgerufen am 19. Januar 2011.


