Remdesivir
Remdesivir (Hersteller: Gilead Sciences) ist ein Arzneistoff, der wegen der virostatischen Eigenschaften seines Stoffwechselprodukts zum Einsatz gegen Ebolafieber und Marburgfieber entwickelt wurde. Es erreichte dort nicht die Reife für den therapeutischen Einsatz.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
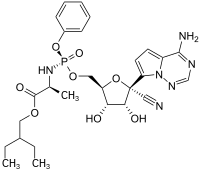 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Remdesivir | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C27H35N6O8P | ||||||||||||||||||
| Kurzbeschreibung |
Weißer bis cremefarbener oder gelber, nicht hygroskopischer, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 602,585 g·mol−1 | ||||||||||||||||||
| pKS-Wert |
3,3[1] | ||||||||||||||||||
| Löslichkeit |
Leicht löslich in Methanol, löslich in Ethanol, praktisch unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Zur Behandlung der durch SARS-CoV-2 ausgelösten Krankheit COVID-19 wurde Remdesivir zunächst im Compassionate-Use angewendet, es folgten Sonderzulassungen in den USA, Japan und in der EU. Für diese Indikation wird es seit Mitte 2020 unter der Marke Veklury vertrieben. Remdesivir ist seit Oktober 2020 die erste in den Vereinigten Staaten zugelassene reguläre Behandlung für COVID-19 bei bestimmten Patienten.[4] Die Zulassungen in der EU und den USA basieren hauptsächlich auf den Ergebnissen der NIAID-ACTT-1-Studie, die gezeigt hatte, dass Remdesivir bei einigen Patienten die Zeit bis zur Erholung zu verkürzen vermochte. Eine Senkung der Sterblichkeit war tendenziell erkennbar, aber statistisch nicht sicher nachweisbar. Hingegen ergab eine im Juli 2021 publizierte Studie, die retrospektiv die Daten einer Kohorte von US-Veteranen ausgewertet hatte, dass eine geringere Sterblichkeit mit Remdesivir nicht festgestellt wurde – egal ob es allein oder in Kombination mit Dexamethason angewendet wurde. Die Verweildauer in Kliniken war doppelt so hoch wie ohne Remdesivir (sechs statt drei Tage im Durchschnitt).[5] Aus Sicht der Arzneimittelkommission der deutschen Ärzteschaft ist der Zusatznutzen von Remdesivir bei Patienten mit einer COVID-19-Pneumonie, die eine zusätzliche Sauerstoffzufuhr erfordert (Low-Flow-Sauerstofftherapie [LFO] oder High-Flow-Sauerstofftherapie [HFO]/nichtinvasive Beatmung [NIV]), nicht belegt.[6]
Pharmakologie
Wirkungsspektrum
Die Substanz Remdesivir wurde von Gilead Sciences erstmals synthetisiert. In der Ebolafieber-Epidemie 2014 bis 2016 erprobte man die Substanz an Primaten in Labors der biologischen Schutzstufe IV des USAMRIID. Dabei fiel auf, dass der Wirkstoff in die der Virusreplikation als Rückzugsort dienenden Gewebe des Gehirns, Auges und Hodens vordringt. Bei Tests an mit dem Ebolavirus infizierten Affen wurde durch intravenöse Gabe des Wirkstoffs in sechs von sechs Fällen die Replikation des Virus unterdrückt. Laborchemische und klinische Symptome gingen zurück. Es kam zu keinem tödlichen Verlauf der Erkrankung.[7] Im Jahr 2019 folgte eine weitere Studie an Primaten. Der Wirkstoff verhinderte eine Infektion durch das Nipah-Virus, während die Tiere der Kontrollgruppe daran starben.[8] In Zellkulturen zeigte Remdesivir eine Aktivität gegen andere humanpathogene RNA-Viren. Darunter waren das Marburgvirus, Lassavirus, MERS-CoV, SARS-CoV, das Influenzavirus A,[7][9] Paramyxoviridae (wie Humanes Parainfluenzavirus 3, Nipah-Virus, Hendra-Virus, Masernvirus und Mumpsvirus) und Pneumoviridae (wie Respiratory-Syncytial-Virus[10]).[11] Daneben wirkt es gegen das Murine Hepatitis-Virus (MHV), das Mäuse infiziert.[9]
Wirkmechanismus
Remdesivir ist ein 1′-Cyano 4-aza-7,9-didesazaadenosin-C-Analogon des Adenosins.[12][9] Es stellt ein Monophosphoramidat-Prodrug („ProTide“) dar, das vom Stoffwechsel in die aktive Triphosphatform des Moleküls GS-441524 überführt wird.[9] Dieses Nukleosidtriphosphat konkurriert mit Adenosintriphosphat (ATP) in der durch die RNA-abhängige RNA-Polymerase (RdRp) katalysierte Synthese der viralen RNA. Es hemmt die virale RNA-Polymerase und verhindert durch Kettenabbruch bei der RNA-Replikation die weitere Vermehrung des Virus in den infizierten Zellen.[7][10] Der Kettenabbruch wird durch die 1´-Cyanogruppe mittels sterischer Hinderung der RdRp an der Insertionsstelle+5 herbeigeführt; Remdesivir ist somit ein sogenannter „delayed chain terminator“.[13][14] Es werden weitere Wirkmechanismen angenommen.[15] Die Selektivität gegenüber der menschlichen RNA-Polymerase ist gering, d. h. von der humanen mitochondrialen RNA-Polymerase (h-mtRNAp) wird ATP stark bevorzugt eingebaut. Die EC50 von Remdesivir liegt bei 0,03 μM für das murine Hepatitis-Virus (MHV) in Zellkultur von DBT-Zellen (delayed brain tumor cells).[9]
Chemie
Eigenschaften
Remdesivir hat sechs chirale Zentren. Es wird als einzelnes Stereoisomer hergestellt. Bei der von Gilead angewendeten Synthese sind zwei Stereoisomere als potentielle Verunreinigungen möglich. Die Wasserlöslichkeit der Substanz ist pH-abhängig. Sie steigt mit abnehmendem pH-Wert an. In reinem Wasser ist sie praktisch unlöslich, in mit Salzsäure auf pH 2 eingestelltem Wasser ist sie sehr schwer löslich. Wegen der äußerst schlechten Wasserlöslichkeit wird Remdesivir für die medizinische Anwendung mit einem Lösungsvermittler wie etwa Sulfobutylbetadex-Natrium (SBECD-Natrium,[1] Hexakis- und Heptakis-O-(4-sulfobutyl)cyclomaltoheptaose-Natriumsalz) versetzt.
Synthese
Die Synthese wird in der Literatur beschrieben:[16] Remdesivir entsteht in einem mehrstufigen Prozess, dessen wesentliche Prozessschritte die Glykosylierung der 4-Amino-pyrrolo[2,1-f][1,2,4]triazin-Base, die Einführung der Cyanogruppe durch stereoselektive Addition an die 1'-Position des entstandenen Ribosids, die Entfernung von Schutzgruppen und eine Kupplungsreaktion sind. Es gibt verschiedene Prozessvarianten.[16][1] Das ursprüngliche Schema war aufgrund der Variabilität der Ausbeute, der unzureichenden Selektivität, häufig kryogener Reaktionstemperaturen und der Notwendigkeit der chromatographischen Abtrennung des Remdesivirs vom mitentstehenden Diastereomer für eine Großproduktion ungeeignet. Ein abgewandeltes Syntheseschema ermöglicht die diastereoselektive Synthese von Remdesivir und eine gleichbleibende und höhere Ausbeute.[16] Neben den von Gilead entwickelten Synthesen existieren Ansätze, die durch Organokatalyse den Ertrag sowie das Diastereomerenverhältnis im Kupplungschritt vom Nucleosid mit dem Phosphoramidat deutlich verbessern.[17] Der Vorteil jener Katalysatoren ist, dass das Phosphoramidat, bevor es mit dem Nucleosid zur Reaktion gebracht wird, nicht mehrfach rekristallisiert werden muss und beide Diastereomere verwendet werden können.[18]
Analytik
Die qualitative und quantitative Bestimmung von Remdesivir gelingt nach entsprechender Probenvorbereitung durch Kopplung der HPLC mit der Massenspektrometrie.[19][20]
Therapeutischer Einsatz
Ebolafieber
2016 wurde eine schottische Pflegekraft, die sich in Westafrika mit dem Ebolavirus infizierte, mit Remdesivir erfolgreich behandelt. Nach neun Monaten hatte sie einen Rückfall mit erneuter Virusreplikation in Form einer Meningoenzephalitis. Das nur in zwei nicht-codierenden Basen mutierte Virus wurde erneut erfolgreich mit der Substanz und Kortikosteroiden behandelt.[21]
In einer randomisiert-kontrollierten Studie, die während eines Ebolaausbruchs in der Demokratischen Republik Kongo zwischen November 2018 und August 2019 stattfand, zeigte sich eine Kombination aus ZMapp und Remdesivir gegenüber der Kombination der Antikörper MAb114 und REGN-EB3 deutlich unterlegen. In der ZMapp/Remdesivir-Gruppe starb rund die Hälfte der Patienten, in der Gruppe mit den beiden Antikörpern rund ein Drittel. Daher führte man aus ethischen Gründen die Studie nur mit den beiden Antikörpern weiter.[22]
In der Ebolafieber-Epidemie 2014 bis 2016 wurde dem Medikament in den USA[23] und Anfang 2016 in der EU[24] der Status eines Orphan-Arzneimittels („Arzneimittel für seltene Leiden“) zugewiesen.
Klinische Prüfungen
Remdesivir war Teil der im März 2020 begonnenen „Solidarity“-Studie der Weltgesundheitsorganisation (WHO), in deren Rahmen auch Chloroquin/Hydroxychloroquin, Lopinavir/Ritonavir (teils in Kombination mit Beta-Interferon) getestet werden.[25] Laut im Oktober 2020 vorgelegten Zwischenergebnissen wurden keine oder allenfalls geringfügige Heilwirkungen durch Remdesivir belegt.[26][27] Von 11.266 Erwachsenen in 30 Staaten erhielten 2750 Patienten Remdesivir.[26][28]
Ergebnisse einer vom US-amerikanischen National Institute of Allergy and Infectious Diseases (NIAID) koordinierten, Placebo-kontrollierten Studie wurden Ende April 2020 vorgelegt.[29] Die Studie hatte zu diesem Zeitpunkt laut Angaben von Gilead ihren primären Endpunkt erreicht.[30] Am 29. April 2020 veröffentlichte das NIAID eine Pressemitteilung über vorläufige Ergebnisse der ACTT-Studie.[31] Am 8. Oktober 2020 erschienen die Endergebnisse der Studie an 1062 überwiegend schwer erkrankten Patienten. 541 erhielten Remdesivir und 521 ein Placebo.[32] In der Remdesivir-Gruppe erholte man sich um rund 29 % schneller als in der Placebo-Gruppe. Die mediane Erholungszeit betrug 10 Tage in der Remdesivir-Gruppe gegenüber 15 in der Placebo-Gruppe. In den 15 Tagen ab Behandlungsbeginn starben 6,7 % der Patienten mit Remdesivir und 11,9 % in der Kontrollgruppe.[32]
Remdesivir ist Teil der "Discovery"-Großstudie, die ab Ende März 2020 Remdesivir, Hydroxychloroquin und Lopinavir/Ritonavir mit der bisherigen Behandlung an mehr als 3000 Covid-19-Patienten in acht Ländern Europas vergleicht.[25]
Remdesivir soll nicht zugleich mit Chloroquin bzw. Hydroxychloroquin angewendet werden, da In-vitro-Untersuchungen antagonistische Effekte von Chloroquin auf die intrazelluläre Stoffwechselaktivierung und antivirale Aktivitäten von Remdesivir ergaben.[33]
In Deutschland genehmigte das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) am 10. März 2020 zwei Phase-III-Prüfungen mit Remdesivir als Prüfpräparat an Patienten mit schwerer bzw. mittelschwerer COVID-19-Erkrankung.[34] In Deutschland sind daran acht klinische Zentren beteiligt, darunter die München Klinik Schwabing, das Universitätsklinikum Hamburg-Eppendorf und das Universitätsklinikum Düsseldorf.[35][36]
Die Cochrane Collaboration wertete im Jahre 2021 verfügbare randomisierte kontrollierte Studien (RCTs) zur Remdesivir-Wirkung in Bezug auf die Sterblichkeit und die Schwere des Krankheitsverlaufs nach Einweisung in ein Krankenhaus aus – anhand der Evidenzsynthesen des vom Bundesministerium für Bildung und Forschung geförderten COVID-19-Evidenzökosystems CEOsys. Festgestellt wurden nur geringe oder gar keine Effekte in Bezug zur Sterblichkeit (4 Studien, 7142 Personen). Von 1000 Patienten sterben nur acht weniger mit Remdesivir gegenüber einem Placebo oder der Standardbehandlung. Auch für die Länge notwendiger Beatmungen wurde kein oder nur ein kleiner Effekt belegt.[37]
Compassionate Use
Abseits klinischer Studien stellt der Hersteller, Gilead Sciences, Remdesivir seit dem 25. Januar 2020[38] für geeignete Covid-19-Patienten auf Compassionate-Use-Basis als Notfallbehandlung bereit.[39] Der Wirkstoff wird dabei für einen bestimmten Patienten für eine zehntägige Behandlung freigegeben.[40][38] Am 22. März 2020 gab das Unternehmen bekannt, angesichts der vielen Einzelfallanfragen auf ein breiteres Programm („expanded access“) umstellen zu wollen, um den Zugang zu Remdesivir zu erleichtern.[41] Damit sollen medizinische Einrichtungen und behandelnde Ärzte Remdesivir für mehrere Patienten gleichzeitig beantragen können.[42] Am 23. März gewährte die FDA in den USA den Status eines Orphan-Arzneimittels, der seltenen Krankheiten vorbehalten ist.[43] Nach öffentlichen Gegenreaktionen bat Gilead kurz darauf die FDA, diesen Status wieder zurückzunehmen.[44] Am 27. März gingen mehrere „expanded access“-Standorte in den Vereinigten Staaten in Betrieb, weitere sollen folgen.[42] Neue Compassionate-Use-Anträge dürfen vorübergehend nur noch für schwere Covid-19-Fälle bei Minderjährigen und Schwangeren gestellt werden.[41] Bis Anfang April gab der Hersteller Remdesivir für über 1.700 Patienten auf Compassionate-Use-Basis ab.[45] Das deutsche BfArM genehmigte ein entsprechendes Härtefallprogramm für Remdesivir mit Wirkung ab 3. April 2020 für ein Jahr.[46]
Am 3. April gab die Europäische Arzneimittel-Agentur Empfehlungen für Kriterien und Randbedingungen von Compassionate-Use-Programme in den Mitgliedsstaaten heraus.[47] Sie empfiehlt darin die Anwendung bei beatmungspflichtigen Patienten mit noch ausreichender Nierenfunktion und weiteren Kriterien.[48] Am 11. Mai erweiterte die EMA die Genehmigung auf hospitalisierte Patienten, die u. a. lediglich zusätzlichen Sauerstoff, eine nichtinvasive Beatmung oder ECMO erhalten.[49]
Das Fachjournal New England Journal of Medicine veröffentlichte am 10. April 2020 erste Erfahrungen zum Compassionate use. Von 61 behandelten Patienten zeigten im Beobachtungszeitraum 36 Patienten verbesserte Sauerstoffwerte, 25 wurden entlassen und sieben starben. Acht Patienten fielen aus anderen Gründen aus der Studie. Von 30 Patienten mit mechanischer Beatmung befanden sich noch 13 zum Ende der Studie weiter an der Beatmung.[38] Die Aussagekraft ist wegen der kleinen Patientenzahl, des Fehlens einer Kontrollgruppe und der Hersteller-Beteiligung umstritten.[50]
Bei US-Präsident Donald Trump wurde Anfang Oktober 2020 eine Remdesivir-Behandlung begonnen, obwohl keine Sauerstoffgabe erforderlich gewesen sei.[51]
Zulassungen
Die US-amerikanische FDA ließ Remdesivir am 1. Mai 2020 für den Notfallgebrauch zu.[52] Die Notfallgebrauchszulassung (EUA) umfasste Kinder und Erwachsene, die an COVID-19 leiden, im Krankenhaus behandelt werden und eine schwere Verlaufsform aufweisen; dies war definiert als dass die Sauerstoffsättigung unter Raumluft weniger als 95 % beträgt oder eine Sauerstoffgabe erforderlich ist oder eine künstliche Beatmung oder eine extrakorporale Membranoxygenierung (ECMO) notwendig ist.[33] Die unter die EUA fallende Verteilung in den Vereinigten Staaten erfolgt unter Kontrolle der US-Regierung.[53] Am 28. August 2020 wurde die Indikation für die erteilte EUA erweitert auf alle hospitalisierten Patienten mit Covid-19,[54] am 22. Oktober 2020 erfolgte die reguläre Zulassung für mindestens 12 Jahre alte Patienten ab 40 Kilogramm. Um auch pädiatrische Patienten weiterhin behandeln zu können, hat die FDA die bisherige Notfallgebrauchszulassung überarbeitet. Sie gilt nun für Patienten unter 12 Jahren mit 3,5 bis unter 40 Kilogramm.[4]
Am 7. Mai 2020 erteilte das japanische Ministerium für Gesundheit, Arbeit und Soziales eine Schnellzulassung für das Veklury genannte Arzneimittel.[55][56] Das südkoreanische Ministerium für Ernährung und Arzneimittelsicherheit ließ Remdesivir im Juni 2020 zu.[57]
Am 3. Juli 2020 beschied die Europäische Kommission für die Mitgliedstaaten die bedingte Zulassung von Remdesivir zur Behandlung von COVID-19 bei Erwachsenen und Jugendlichen ab 12 Jahren mit Lungenentzündung, die zusätzlichen Sauerstoff benötigen,[58] die die Europäische Arzneimittelagentur im Juni empfohlen hatte.[59] Anfang Juni war der Zulassungsantrag eingegangen,[60] die Beurteilung des Präparates hatte jedoch bereits Ende April 2020 als Rolling review („fortlaufende Überprüfung“) begonnen. Im Juni 2021 wurde die Zulassung verlängert.[61]
Laut Herstellerangaben war Remdesivir Mitte Oktober 2020 in etwa 50 Staaten vorläufig zur Behandlung von COVID-19 zugelassen.[62] Ende Oktober teilte der mexikanische Unterstaatssekretär Hugo López-Gatell mit, dass man der Entscheidung der FDA nicht folge. Die mexikanische Zulassungsbehörde Cofepris habe zwei Genehmigungsanträge für Remdesivir mangels Wirkung abgelehnt. Da Gilead Briefe an mexikanische Mediziner sandte, in denen Gilead den Ergebnissen der Solidarity-Studie widersprach, prüfe man, ob die Schreiben zu einem nicht zugelassenen Medikament Anlass für Sanktionen seien.[63] Nach den früheren ablehnenden Bescheiden, mit denen die Behörde auch weitere Daten von Gilead gefordert hatte, erteilte Cofepris am 12. März 2021 eine Notfallzulassung für Remdesivir zur Behandlung von COVID-19.[64][65]
Remdesivir gibt es als Konzentrat und als Lyophilisat zur Herstellung einer Lösung für die intravenöse Gabe.[66]
Verwendung im Zusammenhang mit Impfstoffbelastungsstudien
In Großbritannien sind ab Anfang 2021 Impfstoffstudien geplant, bei denen man Freiwillige mit SARS-CoV-2-Viren infiziert. Die Probanden sollen direkt nach der Infektion mit Remdesivir behandelt werden.[67]
Nebenwirkungen
Als häufigste Nebenwirkungen bei gesunden Probanden traten erhöhte Werte für Leberenzyme (ALT, AST) auf, die bei 14 % beobachtet wurden. Die häufigste Nebenwirkung bei COVID-19-Patienten ist Übelkeit. Ferner können häufig Hautausschläge und Kopfschmerzen auftreten.[68]
Die EMA gab Anfang Oktober 2020 bekannt, Hinweisen über akute Nierenschäden bei mit Remdesivir behandelten Patienten nachzugehen.[69]
Produktion und Verfügbarkeit
Im April 2020 waren laut Hersteller 1,5 Millionen Dosen Remdesivir verfügbar oder kurz vor Fertigstellung.[45][29] Soweit erforderlich könnten 2021 mehrere Millionen Patienten behandelt werden.[70] Da laut Herstellerangaben von Ende April eine fünftägige Behandlung ausreichend sei, könnten mehr Patienten behandelt werden.[29]
Die Produktion von Remdesivir nahm laut Herstellerangaben anfangs neun bis zwölf Monate in Anspruch. Später wurde sie auf etwa sechs Monate verkürzt.[70] Weitere Optimierungen seien in Arbeit.[45] Geprüft würden veränderte Rezepturen, Verabreichungsformen und Kombinationstherapien.[29]
Gilead Sciences investierte im Jahre 2020 mehr als eine Milliarde US-Dollar in die Remdesivir-Produktion.[71] Laut Unternehmensaussage von Anfang August 2020 umfasse das Produktionsnetzwerk mehr als 40 Unternehmen in Nordamerika, Europa und Asien. Gegenüber Januar 2020 wurde die Produktion verfünfzigfacht. Bis Ende 2020 sollen Dosen für mehr als zwei Millionen Behandlungen produziert werden.[72] Der britische Pharmakologe Andrew Hill schätzte im April 2020 die minimalen Produktionskosten einer Tagesdosis auf 0,93 US-Dollar[73] bzw. 93 Cent.[74]
Das Unternehmen gab im Mai 2020 seinen Vorrat an Remdesivir unentgeltlich ab, wobei etwa 40 Prozent (Dosen zur Behandlung von 78.000 Patienten) an die Vereinigten Staaten ging.[75] Das Unternehmen erwägt nach eigenen Angaben, kostenlose Lizenzen zur Produktion von Remdesivir für den Zeitraum bis mindestens 2022 zu erteilen, einschließlich des notwendigen Technologietransfers. Über diesen Zeitraum hinaus sollen indische und pakistanische Generikahersteller Remdesivir zum Einsatz in Entwicklungsländern produzieren.[76] Bis August 2020 hatte das Unternehmen neun Generikaherstellern die Produktion von Remdesivir erlaubt, um 127 Entwicklungs- und Schwellenländer zu versorgen.[72] Die EU-Kommission schloss im Juli 2020 einen Rahmenvertrag zur Bereitstellung von Remdesivir zur Behandlung von 30.000 Patienten. Im Oktober folgte eine Reservierung über 500.000 Dosen, auf deren Grundlage Mitgliedsstaaten bestellen könnten. Die EU-Kommission plane den Abschluss weiterer Verträge über gemeinsame Bezugsrechte mit Gilead.[77]
Therapiekosten
Am 30. Juni 2020 nannte Gilead Sciences einen Verkaufspreis von 390 US-Dollar pro Ampulle für eine fünftägige Behandlung schwer an COVID-19 Erkrankter in den USA[78] – mit 2340 Dollar (umgerechnet etwa 2000 Euro).[79] Dieser Nettopreis sei auch für Deutschland geplant.[80] Für privat Versicherte liegt der Preis in den USA bei 3120 US-Dollar. Für bedürftigere Länder ist eine preisgünstigere Variante geplant.[79] Lizenzen erhielten neun Generika-Hersteller in Indien, Pakistan und Ägypten, die den Verkaufspreis selbst festlegen können. Die Lizenzen sind kostenlos, bis die WHO das Ende der Pandemie erklärt oder alternativ ein anderes Arzneimittel zur Behandlung von oder Vorbeugung gegen COVID-19 eine Zulassung erhält.[80][81]
Kombination mit Baricitinib
Im NEJM beschrieb ein Artikel eine Kombinationstherapie von Baricitinib plus Remdesivir für Erwachsene im Krankenhaus mit Covid-19. Die Kombination war Remdesivir allein überlegen, da es die Erholungszeit verkürzte und die Verbesserung des klinischen Status bei Patienten beschleunigte, besonders bei Patienten, die Sauerstoff mit hohem Durchfluss oder eine nichtinvasive Beatmung erhielten. Die Kombination war mit weniger schwerwiegenden unerwünschten Wirkungen verbunden.[82]
Einzelnachweise
- Assessment report Veklury, Europäische Arzneimittelagentur, 25. Juni 2020 (PDF).
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2-Ethylbutyl-(2S)-2-{[(S)-{[(2R,3S,4R,5R)-5-(4-aminopyrrolo[2,1-f][1,2,4]triazin-7-yl)-5-cyan-3,4-dihydroxytetrahydro-2-furanyl]methoxy}(phenoxy)phosphoryl]amino}propanoat im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. September 2020.
- Remdesivir, Sicherheitsdatenblatt
- FDA Approves First Treatment for COVID-19. In: fda.gov. Food and Drug Administration, 22. Oktober 2020, abgerufen am 22. Oktober 2020 (englisch).
- Ohl ME, Miller DR, Lund BC, et al. Association of Remdesivir Treatment With Survival and Length of Hospital Stay Among US Veterans Hospitalized With COVID-19. Auf: jamanetwork.com/; abgerufen am 19. Juli 2021.
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zu Remdesivir (COVID-19, ≥ 12 Jahre, Erfordernis zusätzlicher Sauerstoffzufuhr) (Veklury®) – frühe Nutzenbewertung § 35a SGB V. - News 2021-29, vom 10. August 2021.
- Travis K. Warren et al.: Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys. In: Nature. Band 531, Nr. 7594, 2016, S. 381–385; doi:10.1038/nature17180.
- Michael K. Lo et al.: Remdesivir (GS-5734) protects African green monkeys from Nipah virus challenge. In: Science Translational Medicine. Band 11, Nr. 494, 29. Mai 2019, Artikel eaau9242; doi:10.1126/scitranslmed.aau9242.
- M. L. Agostini, E. L. Andres, A. C. Sims u.a.: Coronavirus Susceptibility to the Antiviral Remdesivir (GS-5734) Is Mediated by the Viral Polymerase and the Proofreading Exoribonuclease. In: mBio. Band 9, Nummer 2, 03 2018, S. , doi:10.1128/mBio.00221-18, PMID 29511076, PMC 5844999 (freier Volltext).
- E. P. Tchesnokov, J. Y. Feng, D. P. Porter, M. Götte: Mechanism of Inhibition of Ebola Virus RNA-Dependent RNA Polymerase by Remdesivir. In: Viruses. Band 11, Nummer 4, April 2019, S. , doi:10.3390/v11040326, PMID 30987343, PMC 6520719 (freier Volltext).
- M. K. Lo, R. Jordan, A. Arvey, J. Sudhamsu: GS-5734 and its parent nucleoside analog inhibit Filo-, Pneumo-, and Paramyxoviruses. In: Scientific Reports. Band 7, März 2017, S. 43395, doi:10.1038/srep43395, PMID 28262699, PMC 5338263 (freier Volltext).
- E. De Clercq: New Nucleoside Analogues for the Treatment of Hemorrhagic Fever Virus Infections. In: Chemistry, an Asian Journal. Band 14, Nummer 22, November 2019, S. 3962–3968, doi:10.1002/asia.201900841, PMID 31389664.
- Calvin J. Gordon, Egor P. Tchesnokov, Emma Woolner, Jason K. Perry, Joy Y. Feng: Remdesivir is a direct-acting antiviral that inhibits RNA-dependent RNA polymerase from severe acute respiratory syndrome coronavirus 2 with high potency. In: Journal of Biological Chemistry. Band 295, Nr. 20, Mai 2020, S. 6785–6797, doi:10.1074/jbc.RA120.013679, PMID 32284326, PMC 7242698 (freier Volltext).
- Egor P. Tchesnokov, Joy Y. Feng, Danielle P. Porter, Matthias Götte: Mechanism of Inhibition of Ebola Virus RNA-Dependent RNA Polymerase by Remdesivir. In: Viruses. Band 11, Nr. 4, April 2019, S. 326, doi:10.3390/v11040326, PMID 30987343, PMC 6520719 (freier Volltext).
- Lu Zhang, Dong Zhang, Xiaowei Wang, Congmin Yuan, Yongfang Li: 1′-Ribose cyano substitution allows Remdesivir to effectively inhibit nucleotide addition and proofreading during SARS-CoV-2 viral RNA replication. In: Physical Chemistry Chemical Physics. Band 23, Nr. 10, 18. März 2021, ISSN 1463-9084, S. 5852–5863, doi:10.1039/D0CP05948J.
- D. Siegel et al.: Discovery and Synthesis of a Phosphoramidate Prodrug of a Pyrrolo[2,1-f][triazin-4-amino] Adenine C-Nucleoside (GS-5734) for the Treatment of Ebola and Emerging Viruses. In: Journal of Medicinal Chemistry. Band 60, 2017, S. 1648–1661, doi:10.1021/acs.jmedchem.6b01594.
- Mo Wang, Lu Zhang, Xiaohong Huo, Zhenfeng Zhang, Qianjia Yuan: Catalytic Asymmetric Synthesis of the anti-COVID-19 Drug Remdesivir. In: Angewandte Chemie. Band 132, Nr. 47, 2020, ISSN 1521-3757, S. 21000–21005, doi:10.1002/ange.202011527.
- Veeranjaneyulu Gannedi, Bharath Kumar Villuri et al.: Practical Remdesivir Synthesis through One-Pot Organocatalyzed Asymmetric (S)-P-Phosphoramidation. In: The Journal of Organic Chemistry. Band 86, Nr. 7, 2. April 2021, ISSN 0022-3263, S. 4977–4985, doi:10.1021/acs.joc.0c02888.
- J. C. Alvarez, P. Moine, I. Etting, D. Annane, I. A. Larabi: Quantification of plasma remdesivir and its metabolite GS-441524 using liquid chromatography coupled to tandem mass spectrometry. Application to a Covid-19 treated patient. In: Clinical Chemistry and Laboratory Medicine. Band 58, Nr. 9, Juni 2020, S. 1461–1468, doi:10.1515/cclm-2020-0612, PMID 32573468.
- V. Avataneo, A. de Nicolò, J. Cusato u.a.: Development and validation of a UHPLC-MS/MS method for quantification of the prodrug remdesivir and its metabolite GS-441524: a tool for clinical pharmacokinetics of SARS-CoV-2/COVID-19 and Ebola virus disease. In: Journal of Antimicrobial Chemotherapy. Band 75, Nr. 7, 1. Juli 2020, S. 1772–1777, PMID 32361744.
- Michael Jacobs et al.: “Late Ebola virus relapse causing meningoencephalitis: a case report.” The Lancet (London, England) Band 388,10043 (2016): S. 498–503; doi:10.1016/S0140-6736(16)30386-5.
- Sabue Mulangu: A Randomized, Controlled Trial of Ebola Virus Disease Therapeutics. In: New England Journal of Medicine. (NEJM) Band 381, 12. Dezember 2019, S. 2293–2303; doi:10.1056/NEJMoa1910993.
- Orphan Drug Designations and Approvals Database. Auf: accessdata.fda.gov; abgerufen am 6. Oktober 2020.
- EU/3/16/1615. European Medicines Agency, 7. April 2016, abgerufen am 5. Oktober 2020.
- Julia Koch: Irres Tempo. In: Der Spiegel. Nr. 14, 2020, S. 106 (online – 28. März 2020).
- Hongchao Pan, Richard Peto, Quarraisha Abdool Karim et al.: Repurposed antiviral drugs for COVID-19; interim WHO SOLIDARITY trial results. Weltgesundheitsorganisation, 15. Oktober 2020, abgerufen am 15. Oktober 2020.
- Repurposed antiviral drugs for COVID-19–interim WHO SOLIDARITY trial results. (PDF) In: medrxiv.org. WHO Solidarity trial consortium, 15. Oktober 2020, S. 15, abgerufen am 17. Oktober 2020 (englisch, Preprint).
- “Solidarity” clinical trial for COVID-19 treatments. In: who.int. Weltgesundheitsorganisation, 16. Oktober 2020, abgerufen am 16. Oktober 2020 (englisch).
- Daniel O'Day: An Open Letter from our Chairman & CEO. In: gilead.com. Gilead Sciences, 29. April 2020, abgerufen am 30. April 2020 (englisch).
- Gilead Sciences Statement on Positive Data Emerging From National Institute of Allergy and Infectious Diseases’ Study of Investigational Antiviral Remdesivir for COVID-19. In: gilead.com. Gilead Sciences, 29. April 2020, abgerufen am 30. April 2020 (englisch).
- NIH Clinical Trial Shows Remdesivir Accelerates Recovery from Advanced COVID-19. In: niaid.nih.gov. National Institutes of Health, 29. April 2020, abgerufen am 2. Mai 2020 (englisch).
- John H. Beigel, Kay M. Tomashek et al.: Remdesivir for the Treatment of Covid-19 — Final Report. In: New England Journal of Medicine. 8. Oktober 2020, doi:10.1056/NEJMoa2007764.
- FACT SHEET FOR HEALTH CARE PROVIDERSEMERGENCY USE AUTHORIZATION (EUA) OF REMDESIVIR (GS-5734™). (PDF) In: fda.gov. Food and Drug Administration, abgerufen am 2. Mai 2020 (englisch).
- Coronavirus SARS-CoV-2. In: bfarm.de. Bundesinstitut für Arzneimittel und Medizinprodukte, 2020, abgerufen am 10. April 2020 (die Seite wird regelmäßig aktualisiert, siehe auch Versionen vom 25. März und 10. April im Web Archive).
- Ulla Thiede: Haben wir bald ein Medikament gegen Covid-19? In: general-anzeiger-bonn.de. 10. April 2020, abgerufen am 13. April 2020.
- Münchener Klinik testet Remdesivir, apotheke adhoc, 24. März 2020.
- / Ansems K, Grundeis F, Dahms K, Mikolajewska A, Thieme V, Piechotta V, Metzendorf M-I, Stegemann M, Benstoem C, Fichtner F.: Remdesivir for the treatment of COVID‐19. Cochrane Database of Systematic Reviews 2021, Issue 8. Art. No.: CD014962. DOI: 10.1002/14651858.CD014962. cochranelibrary.com, 5. August 2021.
- J. Grein et al.: Compassionate Use of Remdesivir for Patients with Severe Covid-19. In: The New England Journal of Medicine. 10. April 2020, doi:10.1056/NEJMoa2007016.
- Gilead Sciences Initiates Two Phase 3 Studies of Investigational Antiviral Remdesivir for the Treatment of COVID-19. Gilead Sciences, Pressemitteilung vom 26. Februar 2020.
- Emergency Access to Remdesivir Outside of Clinical Trials. Gilead Sciences, abgerufen am 13. April 2020 (englisch).
- Gilead Sciences Statement on Access to Remdesivir Outside of Clinical Trials. In: gilead.com. Gilead Sciences, 22. März 2020, abgerufen am 27. März 2020 (englisch).
- Daniel O’Day: An Open Letter from our Chairman and CEO. In: gilead.com. 28. März 2020, abgerufen am 3. April 2020 (englisch).
- FDA Grants Experimental Coronavirus Drug Benefits For Rare Disease Treatments. In: npr.org. 24. März 2020, abgerufen am 12. April 2020 (englisch).
- In rare move, Gilead gives up 'orphan' status for experimental coronavirus drug. 25. März 2020, abgerufen am 25. September 2020 (amerikanisches Englisch).
- Daniel O’Day: An Update on COVID-19 from our Chairman & CEO. In: gilead.com. Gilead Sciences, 4. April 2020, abgerufen am 7. April 2020 (englisch).
- Härtefallprogramme/ Compassionate Use. In: bfarm.de. Bundesinstitut für Arzneimittel und Medizinprodukte, 2013, abgerufen am 6. April 2020.
- EMA provides recommendations on compassionate use of remdesivir for COVID-19. In: ema.europa.eu. Europäische Arzneimittelagentur, 3. April 2020, abgerufen am 5. April 2020 (englisch).
- Janet König, Filip Josephson: Summary on compassionate use. (PDF) Remdesivir Gilead. In: ema.europa.eu. Europäische Arzneimittelagentur, 3. April 2020, S. 4, 6 f., abgerufen am 5. April 2020 (englisch).
- EMA recommends expanding remdesivir compassionate use to patients not on mechanical ventilation. In: ema.europa.eu. Europäische Arneizmittelagentur, 11. Mai 2020, abgerufen am 16. Mai 2020 (englisch).
- Josh Farkas: PulmCrit – Eleven reasons the NEJM paper on remdesivir reveals nothing. In: emcrit.org. 11. April 2020, abgerufen am 16. April 2020 (englisch).
- With Trump hospitalized, more Covid cases emerge in White House and campaign Maeve Reston. In: cnn.com. 3. Oktober 2020, abgerufen am 3. Oktober 2020 (englisch).
- Coronavirus (COVID-19) Update: FDA Issues Emergency Use Authorization for Potential COVID-19 Treatment. In: fda.gov. Food and Drug Administration, 1. Mai 2020, abgerufen am 2. Mai 2020 (englisch).
- Denise M. Hinton: Dear Ms. Rhoades:. In: fda.gov. Food and Drug Administration, 1. Mai 2020, S. 2, abgerufen am 4. Mai 2020.
- Office of the Commissioner: COVID-19 Update: FDA Broadens Emergency Use Authorization for Veklury (remdesivir) to Include All Hospitalized Patients for Treatment of COVID-19. 31. August 2020, abgerufen am 25. September 2020 (englisch).
- Gilead Announces Approval of Veklury® (remdesivir) in Japan for Patients With Severe COVID-19. In: gilead.com. Gilead Sciences, 7. Mai 2020, abgerufen am 7. Mai 2020 (englisch).
- Special Approval for Emergency on Remdesivir for COVID-19, PMDA, 7. Mai 2020 (PDF)
- Seoul approves use of remdesivir as virus treatment. In: The Korea Times. 3. Juni 2020, abgerufen am 3. Juni 2020 (englisch).
- EU-Kommission lässt Covid-19-Medikament Remdesivir zu – unter Auflagen. Auf: welt.de, vom 3. Juli 2020.
- First COVID-19 treatment recommended for EU authorisation. Pressemitteilung der Europäischen Arzneimittelagentur vom 25. Juni 2020. Abgerufen am 26. Juni 2020.
- EMA receives application for conditional authorisation of first COVID-19 treatment in the EU. In: ema.europa.eu. Europäische Arzneimittel-Agentur, 8. Juni 2020, abgerufen am 11. Juni 2020 (englisch).
- Veklury | European Medicines Agency (europa.eu), abgerufen am 25. Juli 2021.
- Gilead Sciences Statement on the Solidarity Trial. (PDF) In: gilead.com Katherine Vince. Gilead Sciences, 16. Oktober 2020, abgerufen am 17. Oktober 2020 (englisch).
- Mexico will not follow FDA in approving Gilead's COVID-19 drug. 24. Oktober 2020, abgerufen am 25. Oktober 2020 (englisch).
- COVID-19: Aprueba Cofepris a remdesivir como tratamiento emergente. In: Revista Merca2.0. 12. März 2021, abgerufen am 20. März 2021 (sp).
- Karina Suárez: México autoriza el medicamento remdesivir para tratar casos tempranos de covid-19. In: El País. 12. März 2021, abgerufen am 29. Juni 2021 (mexikanisches Spanisch).
- Veklury: EPAR - All authorised presentations (PDF, 56 kB), Europäische Arzneimittelagentur, abgerufen am 14. Juli 2020.
- Human-Challenge-Studie Großbritannien plant Corona-Impfstoffstudie mit freiwillig Infizierten. In: wiwo.de. 20. Oktober 2020, abgerufen am 24. Oktober 2020.
- Europäische Arzneimittelagentur, Ausschuss für Humanarzneimittel: Veklury. Zusammenfassung der Merkmale des Arzneimittels. (Fachinformation) vom 3. Juli 2020 (PDF).
- Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC) 28 September - 1 October 2020. Abgerufen am 3. Oktober 2020 (englisch).
- Working to Supply Remdesivir for COVID-19. In: gilead.com. Gilead Sciences, abgerufen am 7. April 2020.
- Gilead Sciences Statement on State Attorneys General Letter on Remdesivir. In: gilead.com. Gilead Sciences, 5. August 2020, abgerufen am 15. August 2020 (englisch).
- Gilead Sciences Update on Veklury® (Remdesivir) Manufacturing Network. In: gilead.com. Gilead Sciences, 6. August 2020, abgerufen am 12. August 2020 (englisch).
- A. Hill et al.: Minimum costs to manufacture new treatments for COVID-19, Journal of Virus Eradication, Band 6 (2020), S. 61–69.
- Hersteller nennt Preise für Remdesivir in den USA. Auf: aerzteblatt.de vom 30. Juni 2020.
- Dozens of coronavirus drugs are in development — what happens next? Heidi Ledford. In: nature.com. 14. Mai 2020, abgerufen am 6. Mai 2020 (englisch).
- Gilead Sciences Statement on Expanding Global Supply of Investigational Antiviral Remdesivir. In: gilead.com. Gilead Sciences, 5. Mai 2020, abgerufen am 10. Mai 2020 (englisch).
- Christopher Stolz: So wirkt das Corona-Medikament, das auch Trump einnahm. In: tagesspiegel.de. 8. Oktober 2020, abgerufen am 17. Oktober 2020.
- F. Rötzer: Pharmakonzern legt Preis für Remdesivir auf 390 US-Dollar pro Ampulle fest. In: www.heise.de. 30. Juni 2020, abgerufen am 1. Juli 2020.
- Gilead gibt Preis für Remdesivir bekannt. In: www.deutsche-apotheker-zeitung.de. 30. Juni 2020, abgerufen am 1. Juli 2020.
- D. Hüttmann: Weg frei für Remdesivir in der EU. In: Pharmazeutische Zeitung. 3. Juli 2020, abgerufen am 4. Juli 2020.
- Voluntary Licensing Agreements for Remdesivir. Pressemitteilung Gilead, abgerufen am 8. Juli 2020.
- Andre C. Kalil, Thomas F. Patterson, Aneesh K. Mehta u.a.: Baricitinib plus Remdesivir for Hospitalized Adults with Covid-19. Auf: NEJM.org vom 11. Dezember 2020/ In: The New England Journal of Medicine. (NEJM) 2021, Nr. 384, S. 795-807, doi:10.1056/NEJMoa2031994.