Extrakorporale Membranoxygenierung
Die extrakorporale Membranoxygenierung (ECMO) und die extrakorporale Lungenunterstützung (oder extrakorporale Lungenassistenz, ECLA) sind in der Intensivmedizin eingesetzte Unterstützungssysteme, bei denen eine Maschine teilweise oder vollständig Atemfunktionsleistungen für den Patienten außerhalb seines Körpers übernimmt. Dabei wird zwischen veno-venösen und arterio-venösen Anschlüssen unterschieden. Angewendet werden die Verfahren bei Patienten mit schwerer Lungenschädigung (ARDS) oder eingeschränktem Lungenkreislauf, um einen Gasaustausch ähnlich der normalen Atemfunktion sicherzustellen.[1] Sie werden oft bei Neugeborenen eingesetzt, die an Lungenschäden (Atemnotsyndrom, Mekoniumaspiration, persistierende pulmonale Hypertonie) oder bestimmten angeborenen Herzfehlern leiden.
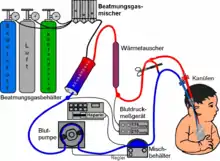
Die ECMO ist damit eine Form der extrakorporalen Organersatzverfahren und wird auch als extracorporeal life support (extrakorporale Lebensunterstützung, ECLS) bezeichnet.
Die ECMO kann über Tage oder Wochen eine ausreichende Oxygenierung gewährleisten und so auch schwer geschädigten Lungen Zeit verschaffen, sich ohne eine belastende Beatmung zu erholen. Wegen der hohen technischen und personellen Anforderungen, Kosten und Komplikationsrisiken (z. B. Blutungen) ist die ECMO dann eine letzte Therapiemöglichkeit (Ultima Ratio).[2] Auf Intensivstationen in Deutschland gab es am 4. November 2021 670 ECMO-Plätze.[3]
Technik
Ein ECMO-Gerät ist ein spezieller Oxygenator, und zwar ein Membranoxygenator. Technisch gleicht er einer Herz-Lungen-Maschine. Um eine ECMO aufzunehmen, werden Kanülen in zwei große Blutgefäße eingebracht. Um eine Blutgerinnung zu vermeiden, setzt man gerinnungshemmende Mittel (Antikoagulanzien) zu, in der Regel Heparin.[4] Das ECMO-Gerät pumpt Blut kontinuierlich durch einen Membran-Oxygenator, der den Gasaustausch in der Lunge ersetzt: Er entfernt Kohlendioxid aus dem Blut und reichert es mit Sauerstoff an. Das so aufbereitete Blut wird dann zum Patienten zurückgeführt.
Die ECMO wird als manuell eingestellte Therapie, in der ein Mediziner oder Kardiotechniker die nötigen Stellwerte vorgibt, betrieben. Als Gegenstand verschiedener Forschungsvorhaben wird eine patienten-individuell geregelte ECMO erarbeitet.[5][6]
Varianten der ECMO
_ECMO_for_isolated_respiratory_failure.jpg.webp)
_ECMO_for_cardiac_or_respiratory_failure.jpg.webp)
Es existieren verschiedene Formen der ECMO, die wichtigsten sind die veno-venöse ECMO (VV-ECMO), die veno-arterielle ECMO (VA-ECMO) und die pumpenlose arterio-venöse ECLA (pECLA). Entnommen wird das Blut bei den beiden ersten Versionen aus großen Venen (z. B. Vena femoralis oder Vena jugularis interna). Bei der VV-ECMO wird das oxygenierte Blut dann wieder in eine Vene eingeleitet, es ist bei schwerem Lungenversagen mit noch ausreichender Pumpfunktion des Herzens indiziert. Bei der VA-ECMO hingegen wird das Blut am Herzen vorbei in eine Arterie (Arteria femoralis) geleitet, so dass ein Parallelkreislauf entsteht.[7] Da dadurch das Herz entlastet ist, wird diese Methode bei Patienten mit schlechter Pumpfunktion des Herzens (Herzinsuffizienz) eingesetzt. Die pECLA wird bei Patienten mit ausreichender Herzfunktion eingesetzt, welche eine geringere Unterstützung beim Gasaustausch benötigen. Da keine Pumpe eingesetzt wird, findet bei der pECLA im Allgemeinen eine geringere Blutschädigung statt.[8][9]
CARL
Die Ende der 2010er Jahre in Freiburg entwickelte, kontrollierte automatisierte Ganzkörperreperfusion in Reanimationssituationen – genannt „Controlled Automated Reperfusion of the whoLe Body“ (CARL) – basiert auf einer minimalisierten Herz-Lungen-Maschine (ECLS), welche durch besondere Regelkreise und eine Kühlungsmöglichkeit erweitert wurde. Durch den Einsatz der CARL kann das Risiko eines Reperfusionsschadens nach Herz-Kreislaufstillstand bzw. Herzinfarkt verringert werden.[10][11]
Die Therapieziele einer individualisierten und kontrollierten Reperfusion werden durch Anwendung einer „Controlled Integrated Resuscitation Device“ (CIRD) genannten technischen Erweiterung erzielt, welches die Durchführung einer entsprechenden extrakorporalen Zirkulation ermöglicht. Es besteht aus einem Oxygenator, einem Wärmetauscher, mehreren Messinstrumenten, einer Spritzenpumpe zur kontinuierlichen parenteralen Verabreichung von Medikamenten und zwei Blutpumpen. Das CIRD ermöglicht der CARL:
- kontrollierte Oxygenierung des Blutes
- pulsatilen Blutfluss
- kontinuierliches Monitoring des Blutdrucks, arterieller und venöser Sauerstoffsättigung und der Körperkerntemperatur
- kontinuierliche Blutgasanalysen (pH, PCO2, PO2, K+, Na+; Ca++, Base Excess, Lactat, Glucose)
- Kontrollierte Etablierung einer moderaten Hypothermie von 32 °C
- laufende Anpassung der Medikationszusätze im Reperfusat
ECMO beim Erwachsenen
Die erste Anwendung eines kardiopulmonalen Bypasses zur Therapie eines Lungenversagens (ARDS) fand Anfang der 1970er Jahre statt.[12] Mit der Aussicht auf ein wirkungsvolles Therapieinstrument zur Behandlung des ARDS starteten die National Institutes of Health (Oberste Gesundheitsbehörde der USA) eine ARDS-Multicenterstudie. Die Ergebnisse waren ernüchternd: Die Gruppe mit ECMO-Behandlung zeigte kein besseres Behandlungsergebnis, die Studie wurde vorzeitig abgebrochen.[13] Die Studie war trotz methodischer Mängel ein Rückschlag für die ECMO-Entwicklung. Die Forschung konzentrierte sich infolgedessen wieder verstärkt auf die Verbesserung der herkömmlichen Beatmungsverfahren.
Erst in den 1980er Jahren gelang es einer italienischen Forschergruppe, mit verbesserten Methoden einen Nutzen der ECMO zu zeigen, allerdings in einer nicht-kontrollierten Studie zur Kohlendioxid-Elimination.[14] Bis heute gilt das Ergebnis dieser und anderer Folgeuntersuchungen, dass die ECMO beim ARDS des Erwachsenen von Nutzen sein kann, allerdings ohne bisher einen signifikanten Vorteil gegenüber einer Beatmungstherapie belegen zu können.[15] 2006 wurde in Großbritannien eine randomisierte Multicenterstudie mit 80 Zentren und 180 Patienten beendet, um den Stellenwert einer ECMO zur ARDS-Therapie festzustellen.[16] Vorab veröffentlichte Ergebnisse[17] scheinen für den Einsatz der extrakorporalen Membranoxygenierung beim Lungenversagen des Erwachsenen günstig zu sein.[18]
Die ersten erfolgreichen Anwendungen von extrakorporalem Gasaustausch (ECMO, ELA, ECLA, und der extrakorporalen CO2-Elimination ECCO2-R) in Deutschland wurden bei akutem Lungenversagen des Erwachsenen in den Jahren 1971 und 1983 an der Universität Düsseldorf[19][20] sowie bei Verbrennungen erstmals 1975 von Rommelsheim und Birtel an der Klinik für Anästhesiologie der Universität Bonn durchgeführt.[21][22]
ECMO beim Neugeborenen

.jpg.webp)
Bartlett berichtete 1975 über die erste erfolgreiche neonatale ECMO-Anwendung in Kalifornien. Dem folgte die erste richtungsweisende Studie, die ein erhöhtes Überleben durch die Behandlung zeigte.[23][24] Das im Vergleich zum Erwachsenen deutlich bessere Ansprechen einer ECMO-Therapie beim Neugeborenen führte zu einer zunehmenden Zahl an ECMO-Behandlungsfällen und ECMO-Zentren, zunächst in den USA und später auch weltweit.
Im Februar 1987 wurde in der Kinderklinik des Universitätsklinikums Mannheim die erste erfolgreiche ECMO-Anwendung bei einem Neugeborenen im deutschsprachigen Raum durchgeführt.[25] 1994 bis 1995 wurde in Großbritannien eine randomisierte Multicenterstudie bei Neugeborenen durchgeführt. Aufgrund der signifikant höheren Überlebensrate in der ECMO-Behandlungsgruppe wurde die Studie im November 1995 frühzeitig abgebrochen, da die Fortführung ethisch nicht vertretbar war.[26] Die Studie widerlegte auch in nachfolgenden Folgeuntersuchungen die Befürchtung, dass die höhere Überlebensrate in der ECMO-Behandlungsgruppe durch psychomotorische Defizite „erkauft“ würde. Stattdessen bleibt der Nutzen der ECMO auch in der Nachuntersuchung der Kinder erhalten.[27]
Extracorporeal Life Support Organization (ELSO)
| Gruppe | Fallzahl | überlebt | prozentual |
|---|---|---|---|
| neonatal respiratorisch | 28271 | 23791 | 84 % |
| neonatal kardial | 6046 | 3750 | 62 % |
| neonatal extrakorporale HLW | 1188 | 766 | 64 % |
| Pädiatrie respiratorisch | 9629 | 4579 | 66 % |
| Pädiatrie kardial | 7668 | 5084 | 66 % |
| Pädiatrie EHLW | 2583 | 1432 | 54 % |
| Erwachsene respiratorisch | 7922 | 5209 | 66 % |
| Erwachsene kardial | 6522 | 3661 | 56 % |
| Erwachsene EHLW | 1985 | 791 | 40 % |
| Total | 69114 | 49063 | 71 % |
| Kumulative Übersicht und Outcome der bis Juli 2015 der ELSO gemeldeten ECMO-Behandlungsfälle | |||
1989 wurde ein zentrales ECMO-Register in Ann Arbor, Michigan (USA), eingerichtet. Dort werden ECLS-Anwendungen zentral registriert und detailliert aufgeschlüsselt. Das erlaubt eine genaue Übersicht über die Effektivität und den Fallzahlverlauf der Therapie bei bestimmten Krankheitsbildern. Dadurch können therapiespezifische Verbesserungen oder Probleme im Bereich ECLS-Anwendungen rascher erkannt und an andere ECMO-Zentren weitergegeben werden. Bis Ende 2012 wurden weltweit mehr als 53.000 ECLS-Anwendungen der Extracorporeal Life Support Organization (ELSO) berichtet und statistisch ausgewertet. Derzeit (Stand: Januar 2013) sind der ELSO 200 aktive ECMO-Zentren weltweit gemeldet.[28]
Mobile ECMO
Die weltweit erste mobile Herz-Lungen-Maschine wurde am Universitätsklinikum Regensburg entwickelt und dort seit 2006 eingesetzt.[29] Das Universitätsklinikum Freiburg ist das einzige ECMO-Zentrum in Deutschland, das in Kooperation mit dem DRK Freiburg über ein eigenes Intensivtransportfahrzeug für ECMO-Transporte verfügt.[30] An der Charité in Berlin ist am Campus Virchow-Klinikum ein Fahrzeug stationiert, mit welchem ein Ärzteteam zum Patienten mitsamt der ECMO-Ausstattung fährt.[31] Nach dem Anschluss erfolgt der Transport des versorgten Patienten mit dem Regelrettungsdienst. In Hamburg wird ähnlich verfahren.[32]
Die Schweizerische Rettungsflugwacht setzt seit 2018 ein 15 kg schweres ECMO-Gerät auf Verlegungsflügen ein, sowohl im Ambulanzflugzeug wie auch in ihren Hubschraubern.[33]
Extrakorporale kardiopulmonale Reanimation (eCPR)
Bei der extrakorporalen kardiopulmonalen Reanimation (eCPR) wird die ECMO-Therapie innerklinisch oder auch präklinisch zur Überbrückung eines Herz-Kreislauf-Stillstandes eingesetzt und ersetzt damit nach Implantation die Herzdruckmassage und Beatmung.[34] In Deutschland wurde hierzu 2018 ein Konsenspapier formuliert, die Praxis bleibt jedoch geprägt von unterschiedlichen Erfahrungen und Möglichkeiten der örtlichen ECMO-Zentren.[35]
Mögliche Komplikationen während der Therapie
Blutungen, Infektionen und Ischämien gehören zu den häufigsten Komplikationen.[36] Daneben können technisch bedingte Probleme wie das Ansaugen der Entnahmekanüle an die Gefäßwand, eine Dislokation einer der Kanülen, ein Defekt der eingesetzten Blutpumpe oder eine Luftembolie auftreten.[37]
Entwöhnung von der ECMO
Der Entwöhnungsprozess von der ECMO beginnt, sobald sich die Tidalvolumina zu normalisieren beginnen. Der ECMO-Blutfluss wurde in der Regel auch schon in den vorangegangenen Tagen reduziert. Der Marker für die Progression ist eher die Kohlendioxid-Clearance als die Oxygenierung. Der Prozess basiert auf der Atemphysiologie.[38]
Weiterführende Literatur
- Invasive Beatmung und Einsatz extrakorporaler Verfahren bei akuter respiratorischer Insuffizienz. In: AWMF online, 2017; Leitlinie.
Weblinks
- Extracorporeal Life Support Organization
- (CESAR-Studie) Conventional Ventilation of ECMO for Servere Adult Respiratory Failure
- Erläuterung der ECMO-Behandlung im Zusammenhang mit COVID-19 im heute journal vom 11.05.2020
Einzelnachweise
- R. Kopp, D. Henzler, R. Dembinski, R. Kuhlen: Extrakorporale Membranoxygenierung beim akuten Lungenversagen. In: Der Anaesthesist. Band 53, 2004, S. 168–174, doi:10.1007/s00101-003-0643-3.
- P. Feindt, C. Benk, U. Boeken, A. Bauer, U. Mehlhorn, J. Gehron, A. Markewitz, A. Beckmann, F. Beyersdorf: Einsatz einer extrakorporalen Zirkulation außerhalb eines herzchirurgischen Operationssaals. In: Kardiotechnik. Band 19, Nr. 3, 2010, S. 58–60, dgfkt.de (PDF; 47 kB).
- DIVI Intensivregister Tagesreport. (PDF) DIVI Intensivregister, 4. November 2021, abgerufen am 4. November 2021.
- M. Hartmann, O. Boehm, A. Koch, St. Loer, K. Zacharowski: Das Gerinnungssystem während extrakorporaler Zirkulation In: Kardiotechnik. 2005(14), 2, ISSN 0941-2670, S. 43–48, dgfkt.de (PDF; 134 kB).
- M. Walter, C. Brendle, A. Stollenwerk, R. Kopp, J. Arens, R. Bensberg, S. Leonhardt: Patient oriented closed loop control of extracorporeal lung assist. In: Journal of Critical Care. 2012, S. e8–e9, ISSN 0883-9441, rwth-aachen.de (PDF).
- B. Baumgartner, A. Mendoza, S. Eichhorn, U. Schreiber, A. Knoll: A comparative study on extra-corporal circulation control. In: Intl Conf IEEE Engineering in Medicine and Biology Society (EMBC). 2011, S. 4287–4290; tum.de (Memento vom 6. September 2015 im Internet Archive; PDF)
- N. Madershahian, J. Wippermann, T. Wittwer, J. Strauch, Y.-H. Choi, K. Liebing, M. Kaluza, T. Wahlers: Veno-arterielle ECMO zur Therapie des therapierefraktären ARDS bei adultem Polytrauma In: Kardiotechnik. 16, 4, 2007, S. 98–101, ISSN 0941-2670, dgfkt.de (PDF; 126 kB)
- A. Liebold, A. Philipp, M. Kaiser, J. Merk, F. X. Schmid, D. E. Birnbaum: Pumpless extracorporeal lung assist using an arterio-venous shunt. Applications and limitations. In: Minerva Anestesiol. 68(5), Mai 2002, S. 387–391. PMID 12029251
- R. Kopp, R. Bensberg, M. Wardeh, R. Rossaint, R. Kuhlen, D. Henzler: Pumpless arterio-venous extracorporeal lung assist compared with veno-venous extracorporeal membrane oxygenation during experimental lung injury. In: British Journal of Anaesthesia. 108, 5, 2012, S. 745–753, doi:10.1093/bja/aes021, bja.oxfordjournals.org.
- Änderungsvorschlag für den OPS 2017 beim DIMDI, abgerufen am 26. April 2021.
- Nicola von Lutterotti: Neue Methode zur Wiederbelebung: unversehrt trotz eineinhalbstündigem Herzstillstand. In der NZZ vom 22. April 2021, abgerufen am 26. April 2021.
- J. D. Hill, T. G. O’Brien, J. J. Murray u. a.: Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shocklung syndrome). In: N Engl J Med. 286, 1972, S. 629. PMID 5060491.
- W. M. Zapol, M. T. Snider, J. D. Hill u. a.: Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study. In: JAMA. 242, 1979, S. 2193–2196. PMID 490805.
- L. Gattinoni, A. Pesenti, D. Mascheroni u. a.: Low- frequency positive- pressure ventilation with extracorporeal CO2 removal in severe acute respiratory failure. In: JAMA, 256, 1986, S. 881–886. PMID 3090285.
- G. Mols u. a.: Zehn Jahre Erfahrung mit extra-korporaler Membranoxygenierung (ECMO). In: Anästhesiol Intensivmed Notfallmed Schmerzther, 36, 2001, S. 4–14, doi:10.1055/s-2001-10241.
- G. J. Peek, F. Clemens, D. Elbourne, R. Firmin, P. Hardy, C. Hibbert, H. Killer, M. Mugford, M. Thalanany, R. Tiruvoipati, A. Truesdale, A. Wilson: CESAR: Conventional ventilatory support vs extracorporeal membrane oxygenation for severe adult respiratory failure. In: BMC Health Services Research. 6, 2006, S. 163, PMC 1766357 (freier Volltext)
- G. Peek: CESAR: adult ECMO vs conventional ventilation trial. Society of Critical Care Medicine 37th Critical Care Congress; February 2-6, 2008; Honolulu. Zusammenfassung in: Schuerer 2008.
- D. J. Schuerer, N. S. Kolovos, K. V. Boyd, CM. Coopersmith: Extracorporeal membrane oxygenation: current clinical practice, coding, and reimbursement. In: Chest. 134(1), Jul 2008, S. 179–184. PMID 18628221.
- H. D. Schulte, W. Bircks, R. Dudziak: Preliminary results with the Bramson membrane lung. (Also report of a successful, clinical long-term perfusion). In: Thoraxchir Vask Chir. 20, 1972, S. 54–59. PMID 4537173
- W. R. Thies, M. Breulmann, U. Lenhsen u. a.: Pulmonary function during a 10-day successful extracorporeal CO2 elimination in acute respiratory failure. Case report. In: Der Anaesthesist. 34, Apr 1985, S. 197–202. PMID 3923858.
- K. Rommelsheim, F. J. Birtel, K. H. Seidat u. a.: Anwendung der „GE-DUALUNG“ bei pulmonaler Diffusionsstörung nach einem Verbrennungsfall. In: Wissenschaftl. Inform. d. Freseniusstiftg. 4, 1975, S. 185.
- K. Rommelsheim, F. J. Birtel, K. H. Seidat u. a.: Prolongierte extrakorporale Membranoxygenisierung wegen Schocklunge bei drittgradiger Verbrennung. In: Prakt. Anästhesie. 11, 1976, S. 8–16. PMID 967804.
- R. H. Bartlett, A. B. Gazzaniga, M. R. Jefferies u. a.: Extracorporeal membrane oxygenation (ECMO) cardiopulmonary support in infancy. In: Trans Am Soc Artif Intern Organs. 22, 1976, S. 80–93. PMID 951895.
- R. H. Bartlett, A. B. Gazzaniga, J. Toomasian u. a.: Extracorporeal membrane oxygenation (ECMO) in neonatal respiratory failure. 100 cases. In: Ann Surg. 204, 1986, S. 236–245. PMID 3530151.
- W. Kachel, D. Arnold: Extrakorporale Membranoxygenierung beim Neugeborenen. In: Schriftenreihe Intensivmedizin Notfallmedizin Anästhesiologie. Band 73, 1. deutschsprachiges Symposium in Mannheim.
- UK collaborative randomised trial of neonatal extracorporeal membrane oxygenation. In: Lancet. 348, 1986, S. 75–82.
- H. McNally, C. C. Bennett, D. Elbourne u. a.: United Kingdom Collaborative Randomized Trial of Neonatal Extracorporeal Membrane Oxygenation: Follow-up to Age 7 Years. In: Pediatrics. 117, 2006, S. e845–e854.
- ECLS Registry Report. International Summary. ECMO Registry of the Extracorporeal Life Support Organization (ELSO), Ann Arbor MI, Januar 2013. (elsonet.org).
- Mobile Herz-Lungen-Maschine. 17. Juli 2006, abgerufen am 6. November 2021.
- Schnelle Hilfe bei akutem Lungenversagen mit dem ECMO-Mobil. Abgerufen am 15. Mai 2021.
- Ralf Offermann: ECMObil. Abgerufen am 15. Mai 2021.
- Cornelia Werner: UKE setzt transportable Herz-Lungen-Maschinen ein. 4. August 2014, abgerufen am 15. Mai 2021 (deutsch).
- Harald Schreiber: Medizinische Spezialtransporte: Die Rega fliegt sieben ECMO-Einsätze in nur zehn Tagen. Schweizerische Rettungsflugwacht Rega. 31. Januar 2018. Abgerufen am 15. November 2021.
- A. Supady, T. Wengenmayer, C. Bode, D. L. Staudacher: Extrakorporale CPR (eCPR): Seit Oktober 2015 ist die extrakorporale CPR (eCPR) Teil der ALS-Leitlinie. In: Notfall + Rettungsmedizin. Band 19, Nr. 7, November 2016, ISSN 1434-6222, S. 574–581, doi:10.1007/s10049-016-0166-5 (springer.com [abgerufen am 6. November 2021]).
- G. Michels, T. Wengenmayer, C. Hagl, C. Dohmen, B. W. Böttiger: Empfehlungen zur extrakorporalen kardiopulmonalen Reanimation (eCPR): Konsensuspapier der DGIIN, DGK, DGTHG, DGfK, DGNI, DGAI, DIVI und GRC. In: Der Kardiologe. Band 12, Nr. 5, September 2018, ISSN 1864-9718, S. 332–341, doi:10.1007/s12181-018-0268-z (springer.com [abgerufen am 6. November 2021]).
- Valeria Lo Coco, Roberto Lorusso, Giuseppe M. Raffa, Pietro Giorgio Malvindi, Michele Pilato: Clinical complications during veno-arterial extracorporeal membrane oxigenation in post-cardiotomy and non post-cardiotomy shock: still the achille’s heel. In: Journal of Thoracic Disease. Band 10, Nr. 12, Dezember 2018, S. 6993–7004, doi:10.21037/jtd.2018.11.103, PMID 30746245, PMC 6344687 (freier Volltext) – (amegroups.com [abgerufen am 6. November 2021]).
- T. Neitzel, M. Stiller, H. Bushnaq, R.-E. Silber, I. Friedrich: Extracorporeal Live Support (ECLS) bei akutem kardiogenen Schock In: Kardiotechnik. (18), 3, 2009, S. 77–80, ISSN 0941-2670, dgfkt.de (PDF; 105 kB).
- Lars M. Broman, Maximilian V. Malfertheiner, Andrea Montisci, Federico Pappalardo: Weaning from veno-venous extracorporeal membrane oxygenation: how I do it. In: Journal of Thoracic Disease. Band 10, Suppl 5, März 2018, ISSN 2072-1439, S. S692–S697, doi:10.21037/jtd.2017.09.95, PMID 29732188, PMC 5911556 (freier Volltext) – (nih.gov [abgerufen am 16. Mai 2021]).