Baricitinib
Baricitinib ist ein immunsuppressiver und entzündungshemmender Arzneistoff aus der Wirkstoffgruppe der Januskinase-Inhibitoren. Als erster Vertreter dieser Gruppe (first in class) ist er in der Europäischen Union seit 2017, in den USA seit 2018, unter dem Namen Olumiant zugelassen zur oralen Behandlung von mittelschwerer bis schwerer aktiver rheumatoider Arthritis. 2020 folgte in der EU eine Erweiterung der Anwendungsgebiete um die Behandlung der atopischen Dermatitis (Neurodermitis), wenn eine systemische Therapie infrage kommt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
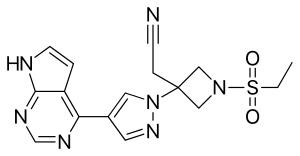 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Baricitinib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C16H17N7O2S | |||||||||||||||||||||
| Kurzbeschreibung |
Weißes bis leicht rosafarbenes, nicht hygroskopisches Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L04AA37 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 371,42 g·mol−1 | |||||||||||||||||||||
| Löslichkeit |
Wenig löslich in 0,1 N HCl und praktisch unlöslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Ebenfalls im November 2020 wurde in den USA eine Notfallzulassung erteilt zur Anwendung bei Kindern ab 2 Jahren und Erwachsenen mit bestätigter COVID-19-Erkrankung; er muss jedoch zusammen mit dem antiviralen Wirkstoff Remdesivir verabreicht werden und darf nur bei hospitalisierten Patienten mit schwerem Krankheitsverlauf eingesetzt werden. Die europäische Arzneimittelagentur prüft seit April 2021 einen Antrag auf Erweiterung der zugelassenen Anwendungsgebiete um die Behandlung von COVID-19. Die WHO empfiehlt seit dem 14. Januar 2022 zur Behandlung von COVID-19-Erkrankten. Diese Empfehlung basiert auf sieben Studien mit mehr als 4000 Patienten.[3]
Eigenschaften
Baricitinib ist ein Inhibitor (Hemmstoff) der Januskinasen (JAK). Er wirkt selektiv und reversibel an der JAK1 und JAK2; die Wirksamkeit an der JAK3 oder Tyrosinkinase 2 (TYK2) ist nur gering. Januskinasen sind Enzyme, die Signale von Zytokinen und Wachstumsfaktoren von der Zelloberfläche ins Zellinnere weiterleiten. Ihre Unterdrückung verhindert, dass proinflammatorischen Zytokine wie IL-6, GM-CSF und INF-α/β eine Signalkaskade in Gang setzen, die für eine verstärkte Immunantwort und Entzündungsreaktionen verantwortlich sind. Baricitinib moduliert diese Signalwege, indem es die enzymatische Aktivität von JAK1 und JAK2 teilweise hemmt und damit die Phosphorylierung und Aktivierung von Signaltransduktoren und Aktivatoren der Transkription (STATs) reduziert.[4]
Nach oraler Gabe wird Baricitinib rasch resorbiert, die Bioverfügbarkeit liegt bei ca. 79 %. Baricitinib wird zu weniger als 10 % metabolisch umgewandelt, die Biotransformation wird durch CYP3A4 vermittelt. Baricitinib wird zu 69 % unverändert über den Urin und zu 15 % über die Fäzes ausgeschieden.[4]
Therapeutische Verwendung
In der Behandlung der mittelschweren bis schweren rheumatoiden Arthritis kommt Baricitinib zum Einsatz bei erwachsenen Patienten, die auf eine vorangegangene Behandlung mit einem oder mehreren krankheitsmodifizierenden Antirheumatika (disease-modifying antirheumatic drug, DMARD) unzureichend angesprochen oder diese nicht vertragen haben. Es kann allein oder in Kombination mit Methotrexat gegeben werden. Zur Behandlung von mittelschwerer bis schwerer atopischer Dermatitis kann Baricitinib gleichzeitig mit oder ohne örtliche (topische) Therapie mit Corticosteroiden angewendet werden, die Wirksamkeit kann bei gleichzeitiger Gabe von topischen Corticosteroiden verbessert sein. Auch die Anwendung von topischen Calcineurin-Inhibitoren gleichzeitig zu Baricitinib ist möglich, sollte aber auf empfindliche Hautstellen (Gesicht, Hals, Genitalbereich, intertriginöse Bereiche) beschränkt werden.[4]
Baricitinib erhielt in den USA im November 2020 eine Notfallzulassung zur Anwendung bei Kindern ab 2 Jahren und Erwachsenen mit bestätigter COVID-19-Erkrankung; er muss jedoch zusammen mit dem antiviralen Wirkstoff Remdesivir verabreicht werden und darf nur angewendet werden bei hospitalisierten Patienten, die zusätzlichen Sauerstoff benötigen, mechanisch beatmet oder mittels extrakorporaler Membranoxygenierung (ECMO) versorgt werden.[5] Die Genehmigung durch die amerikanische Behörde Food and Drug Administration (FDA) beruht auf Ergebnissen der ACTT-2-Studie, in der die Kombination aus Baricitinib und Remdesivir bei moderat bis schwer erkrankten Covid-19-Patienten untersucht wurde. Unter der Kombinationstherapie erholten sich die Patienten rund einen Tag rascher als unter der Behandlung mit Remdesivir allein, nämlich in sieben statt acht Tagen. Die Kombination war ferner mit weniger schwerwiegenden unerwünschten Ereignissen verbunden.[6] Am 29. April 2021 begann die europäische Arzneimittelagentur mit der Prüfung eines Antrags auf Erweiterung der zugelassenen Anwendungsgebiete von Baricitinib um die Behandlung von COVID-19 bei Patienten ab einem Alter von 10 Jahren, die zusätzlichen Sauerstoff benötigen. Es wird angenommen, dass sich der Wirkungsmechanismus als Januskinase-Hemmer auch günstig bei den mit schweren COVID-19-Verläufen einhergehenden Entzündungen und Gewebeschädigungen auszuwirken vermag.[7]
Anwendungsbeschränkungen und Nebenwirkungen
Baricitinib ist in der Schwangerschaft kontraindiziert. Frauen im gebärfähigen Alter müssen während der Anwendung und nach Beendigung der Behandlung mindestens noch eine weitere Woche zuverlässig verhüten. Es ist nicht bekannt, ob Baricitinib in die Muttermilch übergeht. Jedoch zeigten Daten aus Tierversuchen einen Übertritt in die Muttermilch, sicherheitshalber sollte während einer Baricitinib-Einnahme nicht gestillt werden.[4]
Sehr häufige Nebenwirkungen in klinischen Studien waren Hypercholesterinämie und Infektionen der oberen Atemwege. Weiterhin traten häufig Übelkeit, Bauchschmerzen, Kopfschmerzen, Gürtelrose und Harnwegsinfektionen auf.[4]
Einzelnachweise
- Assessment report Procedure No. EMEA/H/C/004085/0000, CHMP, 16. Dezember 2016 (PDF)
- Cayman Chemical: Baricitinib (INCB 028050, LY3009104, CAS Number: 1187594-09-7) | Cayman Chemical, abgerufen am 27. Dezember 2020.
- The BMJ: Covid-19: WHO recommends baricitinib and sotrovimab to treat patients (Cite this as: BMJ 2022;376:o97. doi: https://doi.org/10.1136/bmj.o97 ).
- Olumiant: Zusammenfassung der Merkmale des Arzneimittels, Stand Oktober 2020 (PDF).
- A.Rößler: Notfallzulassung für Baricitinib in den USA, www.pharmazeutische-zeitung.de, 20. November 2020.
- Andre C. Kalil et al.: Baricitinib plus Remdesivir for Hospitalized Adults with Covid-19. In: The New England Journal of Medicine. 11. Dezember 2020, doi:10.1056/NEJMoa2031994.
- EMA starts evaluating use of Olumiant in hospitalised COVID-19 patients requiring supplemental oxygen. 29. April 2021, abgerufen am 30. April 2021.