Ameisensäureethylester
Ameisensäureethylester (nach IUPAC-Nomenklatur: Ethylmethanoat, auch Ethylformiat) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Carbonsäureester. Er hat einen typischen Geruch nach Rum bzw. Arrak.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
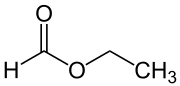 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ameisensäureethylester | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H6O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit arrakartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 74,08 g·mol−1[2] | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,92 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
leicht in Wasser (105 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,3609 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
Als natürlicher Aromastoff kommt Ameisensäureethylester in vielen verschiedenen Pflanzen vor. Es wurde auch als eines der kompliziertesten Moleküle im Weltall, genauer in der Sternentstehungsregion Sagittarius B2 in der Nähe des Milchstraßenzentrums, gefunden.[6]
Gewinnung und Darstellung
Carbonylierung von Ethanol
Ethylformiat kann großtechnisch durch Carbonylierung von Ethanol mit Kohlenstoffmonoxid bei Temperaturen von 60–70 °C und Drücken von 40–50 bar hergestellt werden.[7]
.svg.png.webp)
Als Katalysatoren werden meist Metallalkoholate wie Natriumethanolat eingesetzt.[8]
Veresterung
Im Labor kann Ameisensäureethylester durch säurekatalysierte Veresterung von Ameisensäure mit Ethanol hergestellt werden.
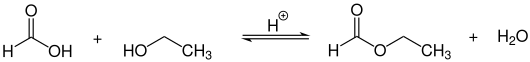
Aufgrund der im Vergleich zu anderen Carbonsäuren leichten Dehydratisierbarkeit der Ameisensäure können hierbei allerdings keine starken Trockenmittel wie z. B. konz. Schwefelsäure verwendet werden. Nach dem Prinzip von Le Chatelier bewirkt eine Abtrennung des entstehenden Wassers bzw. das Abziehen des Esters eine Verlagerung des Gleichgewichts auf die Produktseite (siehe auch Massenwirkungsgesetz).
Eigenschaften
Physikalische Eigenschaften
Ethylformiat ist eine farblose Flüssigkeit, die unter Normaldruck bei 54 °C siedet.[3] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 6,1384, B = 1151,08 und C = −48,94 im Temperaturbereich von 213 bis 336 K bzw. mit A = 6,4206, B = 1326,4 und C = −26,867 im Temperaturbereich von 327 bis 498 K.[9] Die kritischen Größen betragen 506,8 K für die kritische Temperatur, 4691 kPa für den kritischen Druck und 0,228 m3·kmol−1 für das kritische Volumen.[9]
Chemische Eigenschaften
Der Ester kann durch Reaktion mit Wasser in Umkehrung der Bildungsreaktion verseift, d. h. hydrolysiert werden. Die Hydrolyse kann durch Säuren katalysiert werden und verläuft dann in genauer Umkehrung der Veresterungsreaktion; es entstehen wieder Ethanol und Ameisensäure. Bei der basischen Hydrolyse erhält man dagegen Ethanol und ein Salz der Ameisensäure, ein Formiat.
Sicherheitstechnische Kenngrößen
Ethylformiat bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −20 °C.[2][10] Der Explosionsbereich liegt zwischen 2,8 Vol.‑% als untere Explosionsgrenze (UEG) und 16 Vol.‑% als obere Explosionsgrenze (OEG).[2] Die Grenzspaltweite wurde mit 0,94 mm bestimmt.[2][10] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Zündtemperatur beträgt 445 °C.[2][10] Der Stoff fällt somit in die Temperaturklasse T2. Die elektrische Leitfähigkeit ist mit 1,45·10−7 S·m−1 eher gering.[11]
Verwendung
Ethylformiat wird vorwiegend zur Herstellung künstlicher Rum- und Arrakessenzen verwendet.[3] Zudem dient es als Zusatzstoff zu Pfirsich-, Bananen-, Apfel- und Ananasaromen.[3] Weiterhin kann es als Fungizid in Getreide- und Tabakkulturen benutzt werden.[3] Der Einsatz von Ethylformiat im Vorratsschutz wurde zumindest diskutiert.[12] In Deutschland, Österreich und der Schweiz besteht keine Zulassung von Ethylformiat als Pflanzenschutzmittel.[13][14]
Ethylformiat dient als Zwischenprodukt bei verschiedenen organischen Synthesen (Formylierung). In der Industrie wird es auch als Lösemittel für Nitrocellulose und Celluloseacetat eingesetzt.[3]
Sicherheitshinweise
Der Ester ist sehr leicht entzündlich und reagiert auch mit vielen Oxidationsmitteln. Dabei können gefährliche Stoffe wie Ameisensäure, Formaldehyd und Kohlenstoffmonoxid entstehen. Ameisensäureethylester kann sowohl über die Haut, als auch die Atemwege aufgenommen werden, wobei Reizung von Augen, Schleimhäuten und Atemwegen auftreten. Höhere Konzentrationen oder Aufnahme über einen längeren Zeitraum können Schädigungen des Zentralnervensystems und der Lunge hervorrufen.[2]
Weblinks
Einzelnachweise
- Eintrag zu ETHYL FORMATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Dezember 2021.
- Eintrag zu Ethylformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Ethylformiat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Januar 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-244.
- Eintrag zu Ethyl formate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Januar 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Wissenschaft-aktuell: Komplexe Moleküle im All (Memento vom 10. Juni 2009 im Internet Archive).
- Patent CN102746145B: Preparation method for ethyl formate. Veröffentlicht am 8. Oktober 2014, Anmelder: Linhai Liansheng Chemical Co. Ltd., Erfinder: Yijian Deng, Weiguo Huang; Haibo Hu.
- Jukka Hietala, Antti Vuori, Pekka Johnsson, Ilkka Pollari, Werner Reutemann, Heinz Kieczka: Formic Acid. In: Ullmann´s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA, 21. März 2016, abgerufen am 13. Januar 2019 (englisch).
- Richard M. Stephenson, Stanislaw Malanowski: Handbook of the Thermodynamics of Organic Compounds, Elsevier 1987, ISBN 978-94-010-7923-5, doi:10.1007/978-94-009-3173-2, S. 79.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- Bericht zur 7. Internationalen Konferenz über kontrollierte Atmosphäre und Begasung bei gelagerten Produkten - CAF2004: Vorratsschutz bei Lebensmitteln – Quo vadis?.
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 12. März 2016.
- Haritos VS, Damcevski KA, Dojchinov G: Improved efficacy of ethyl formate against stored grain insects by combination with carbon dioxide in a 'dynamic' application. In: Pest Manag. Sci.. 62, Nr. 4, April 2006, S. 325–33. doi:10.1002/ps.1167. PMID 16470681.

